Актуальность
Невропатия (НП) – невоспалительное поражение нервной ткани – может наблюдаться при различных заболеваниях и состояниях. НП проявляется на фоне интоксикаций (алкогольная, уремическая, при отравлении солями тяжелых металлов и некоторыми лекарственными препаратами), диагностируется при недостаточности определенных витаминов (тиамин, цианокобаламин, пантотеновая кислота, a-токоферола ацетат), при некоторых инфильтративных и воспалительных заболеваниях (саркоидоз, туберкулез, грыжа межпозвонковых дисков, узелковый периартериит), при депрессии или истерии. Но наиболее часто НП является осложнением эндокринных заболеваний – гипотиреоза, акромегалии и сахарного диабета (СД).
Принимая во внимание высокую распространенность СД, частоту развития поздних осложнений, их влияние на течение СД, на продолжительность и качество жизни пациентов, изучение механизмов формирования и разработка методов лечения такого осложнения, как диабетическая НП (ДНП), приобретают большое значение.
ДНП определяется как комплекс неврологических симптомов, основной причиной появления которых является СД, при этом рассматривается как многофакторное осложнение с мультифокальным поражением соматической и автономной нервной системы. В Алгоритмах диагностики и лечения СД в редакции 2023 г. выделяют диффузную НП, которая включает периферическую (моторная, сенсорная, смешанная) и автономную (кардиальная, гастроинтестинальная, урогенитальная, судомоторная, бессимптомная гипогликемия и др.); мононевропатию (мононевриты различной локализации) и др. [1].
Однако, какая бы классификация ни применялась для структурирования НП, мы понимаем, что это деление достаточно условно, поскольку процесс формирования НП изначально генерализованный и происходит с вовлечением всех нервных клеток организма, а разделение на клинические формы обусловлено преобладанием в клинической картине тех или иных проявлений.
Цель статьи – на основании анализа научной литературы выделить основные патофизиологические звенья в развитии ДНП и провести параллели между происходящими патологическими процессами в нервной ткани и механизмом действия наиболее часто применяемых средств, представить обзор опубликованных стратегий в лечении этого осложнения СД с акцентом на средства многокомпонентного воздействия.
Нервная ткань и гипергликемия
Пусковым механизмом ДНП является гипергликемия, поскольку именно при наличии повышенного уровня гликемии в организме пациента начинаю происходить структурные изменения. Транспорт глюкозы осуществляется двумя группами транспортеров глюкозы: белки переносчики (Glucose Transporter – GLUT) и натрий глюкозные ко-транспортеры (sodium-glucose cotransporters – SGLT). Изучение транспорта глюкозы проводится достаточно давно [2–4].
К настоящему моменту установлено 14 типов белков-переносчиков от GLUT1, -2, -3 до -14 и они находятся на мембранах всех клеток человеческого организма. Группа SGLT включает 2 типа транспрортеров – SGLT1 и SGLT2 [2, 4].
Нервная ткань наиболее уязвима, т.к. относится к инсулиннезависимым тканям и не содержит белков-переносчиков 4-го типа (GLUT-4). В этом случае транспорт глюкозы в клетки осуществляется по градиенту концентрации при помощи облегченной диффузии с участием других белков-переносчиков – глюкозных транспортеров GLUT-1.
Наиболее изученными являются GLUT-1 и GLUT-4 [5]. Чувствительным к инсулину является только GLUT-4, который находится в клетках мышечной ткани, в т.ч. миокарда, и в жировой ткани. Находится под контролем инсулина, который соединяется со своим рецептором, что приводит к активации киназ, перемещению GLUT-4 к плазматической мембране, встраиванию в нее и проникновению глюкозы в клетку через протеиновые каналы GLUT-4 [2, 4].
GLUT-1 обнаружен в эритроцитах, мембранах клеток плаценты, мозга, канальцев почек и клеток кишечника; GLUT-2 – в мембране клеток печени, β-клеток, энтероцитов; GLUT-3 – в мембране клеток мозга, плаценты и в почечных клубочках; GLUT5 – в мембране клеток тонкого кишечника, почек, тестикул (GLUT5 является переносчиком фруктозы) [5, 6]. Некоторые ткани могут содержать несколько типов белков-переносчиков.
Так, например, на подоцитах почек экспрессируются GLUT-1, -2, -3, -4 и -8 [5].
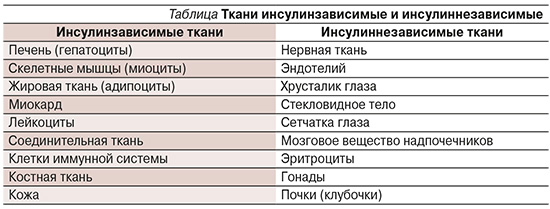
Инсулиновые рецепторы присутствуют только в инсулинзависимых тканях и увеличивают поступление глюкозы в 30–40 раз. Однако практически 70% всей поступающей в организм глюкозы расходуются инсулиннезависимыми тканями (45–60%, мозг и нервная ткань), см. таблицу.
Патофизиология ДНП
Изучение патогенетических механизмов развития ДНП – процесс перманентный, и на сегодняшний день основные звенья патогенеза уже известны. Ведущие механизмы, участвующие в процессе развития ДНП, были известны достаточно давно и какое-то время существовали в виде отдельных теорий: теория полиол-сорбитолового шунта, теория недостаточности миоинозитола, теория эндоневральной микроангиопатии, оксидативного стресса и прямого глюкозотоксического действия. Однако на сегодняшний день уже доказано, что все эти механизмы в той или иной мере участвуют в процессах, происходящих в нервной ткани пациентов с СД. Запускает механизм формирования НП несомненно гипергликемия, которая и в дальнейшем поддерживает одновременно несколько процессов. Происходит развитие микроангиопатии vasa nervorum с атеросклерозом эпиневральных сосудов и гипоксией аксонов. Усиливается процесс превращения глюкозы в сорбитол (с 1% в норме до 7–8% при СД). Наблюдается активация альдозоредуктазы с последующей денервацией шванновых клеток, сегментарной демиелинизацией и аксонопатией. Имеют значение и снижение антиоксидантной защиты, недостаточность миоинозитола, ферментативное и неферментативное гликозилирование белков нервных волокон. Влияет на формирование и прогрессирование НП наличие антител к инсулину и аутоантител против симпатических ганглиев, блуждающего нерва и мозгового вещества надпочечников.
Изначально гипергликемия запускает каскад механизмов, приводящих к развитию оксидативного стресса, активации перекисного окисления липидов и усилению образования конечных продуктов избыточного гликирования (см. рисунок). Процесс продолжается избыточным образованием свободных радикалов, которые активно реагируют с белками, нарушают целостность клеточных структур (в первую очередь эндотелия) и вызывают эндоневральную гипоксию [7–10]. Факторы, связанные с СД 1 типа (снижение уровня инсулина и С-пептида), СД 2 типа (инсулинорезистентность и дислипидемия) или обоими (гипергликемия), вызывают повреждение ДНК, стресс эндоплазматического ретикулума, дисфункцию митохондрий и необратимое повреждение клеток [9–11]. Активность собственной антиоксидантной системы (супероксиддисмутаза, сукцинатдегидрогеназа, каталаза, глутатион и др.) при СД снижена. В конечном итоге оксидативный и воспалительный стрессы на фоне метаболической дисфункции повреждают нервные клетки.

Существующий патофизиологический механизм ДНП сложный и многокомпонентный, создает достаточно большие затруднения в достижении терапевтического эффекта.
Патоморфология
Соматические двигательные и чувствительные нервы покрыты миелином, который обеспечивает электрическую изоляцию аксона и увеличивает скорость проведения импульса по волокну. Периферические нервы представлены нервными клетками, покрытыми концентрически расположенными шванновскими клетками (миелиновая оболочка), способными к регенерации.
При СД накопление натрия в узлах Ранвье в связи со сниженной активностью Na-К-АТФазы избирательно блокирует деполяризацию нервных волокон и снижает скорость проведения нервного импульса. Локальный отек усиливает аксоглиальное разъединение, потерю кальциевых каналов, что и приводит к сегментарной демиелинизации. При метаболической агрессии погибают шванновские клетки (демиелинизация). Но те же клетки активируют регенерацию нерва из проксимального отрезка и выделяют нейротропные факторы роста нервов. Скорость регенерации аксонов составляет 0,25–4,0 мм/сут. В соединительнотканной оболочке нерва (периневрий) проходят сосуды (vasa nervorum) и нервы (nervi nervorum).
Морфологически при ДНП патологический процесс неспецифичен, наблюдаются аксональная дегенерация, фокальная и сегментарная демиелинизация, атрофия шванновских клеток, нарушение аксоплазматического транспорта и деполяризация клеточных мембран [12]. Насколько обратимы эти изменения и обратимы ли вообще – вопрос, очень важный при выборе терапии.
Клинические проявления
Выраженность клинических проявлений НП зависит от продолжительности СД и достижения или недостижения целевых показателей гликемического контроля. У пациентов с СД 2 типа НП может быть диагностирована уже при первичной постановке диагноза. Наиболее частым и ранним признаком периферической ДНП является повреждение «мелких» волокон, что проявляется в виде боли и дизестезии. Боль и является самой распространенной причиной, по которой пациенты с СД обращаются за медицинской помощью. При обследовании выявляются нарушение тактильной, температурной и вибрационной чувствительности, признаки мышечной слабости.
Вегетативная НП – серьезное осложнение СД, при котором доказано снижение качества и продолжительности жизни пациентов. Проявления этого осложнения определяются преимущественностью зоны поражения (преобладают кардиальная, гастроинтестинальная, урогенитальная формы и др.), что «маскирует» их под соматические заболевания, затрудняет диагностику и своевременное назначение терапии. У пациентов наблюдаются нарушение терморегуляции, ортостатическая гипотензия, нарушение ночного зрения и повышенная предрасположенность к гипогликемии [12].
Достаточно неплохо разработаны методы диагностики кардиальной НП, и включены в алгоритмы [1]. Однако, по данным некоторых исследований, проявления, например, гастроинтестинальной формы могут наблюдаться более чем у половины пациентов, даже не предъявляющих никаких жалоб со стороны желудочно-кишечного тракта (ЖКТ). А это фактор значимого влияния на эффективность применения энтеральных лекарственных препаратов.
Современные подходы к терапии
При любом осложнении СД, в т.ч. и ДНП, не может быть достигнут хороший эффект от терапии без нормализации показателей гликемического контроля [13, 14]. Однако в отношении лечения ДНП гипогликемизирующая терапия – ответ неоднозначный. По мнению B.C. Callaghan et al. (2020) контроль гликемии оказывает существенное влияние на профилактику НП у лиц с СД 1 типа, но не с СД 2 типа, которые составляют подавляющее большинство пациентов [15]. Но, несомненно, ожидать высокого эффекта от терапии осложнений без достижения целевых показателей гликемического контроля не приходится, поэтому независимо от типа СД такая задача ставится в первую очередь.
Не получено убедительных данных по влиянию на профилактику и лечение ДНП немедикаментозных методов воздействия – физических упражнений или диетотерапии, хотя некоторые положительные эффекты и наблюдались у пациентов с периферической полиневропатией и ортостатической гипотензией [16–18], а от физиотерапевтических методов – у пациентов с мононевропатией [19].
Основные методы терапии ДНП – фармакологические. Причем подходы к лечению, как правило, определяются конкретными симптомами. При наличии болевых ощущений пациентам с периферической полиневропатией назначают препараты из различных классов – антиконвульсанты, антидепрессанты, опиоидные пептиды [20–22], при ортостатической гипотонии – симпатомиметики, агонисты ά1-адренорецепторов [23]. При других вариантах автономной ДНП требуется длительное и комплексное лечение. В терапии кардиальной автономной НП помимо гипогликемизирующих средств назначают препараты для коррекции артериальной гипертензии, дислипидемии и вторичной профилактики сердечно-сосудистых заболеваний [24–25]. При гастроинтестинальной форме автономной НП индивидуально подбирают препараты, влияющие на перистальтику ЖКТ (в зависимости от того – замедленная или ускоренная), с учетом противопоказаний – опиоиды, антихолинергические средства, трициклические антидепрессанты, глюкагоноподобный пептид и др. [25–28]. Хотя по мнению некоторых ученых, существующие варианты лечения вегетативной НП ЖКТ по большей части эмпирические и неоптимальные [26]. При урогенитальной форме автономной ДНП лечение симптоматическое [29, 30].
Метаболическая терапия
Несмотря на значительные успехи в лечении большинства клинических форм ДНП, остаются открытыми вопросы патогенетического подхода. НП – осложнение СД с многофакторными причинами и множественностью происходящих одновременно нарушений, требует использования в патогенетической терапии либо препаратов с генерализованным влиянием, либо средств, включающих комплекс компонентов, действующих одновременно на несколько патогенетических механизмов [31].
В настоящее время к средствам патогенетической фармакотерапии относят анитиоксиданты, среди которых лидирует естественный липофильный антиоксидант – ά-липоевая кислота [32–33]. Но активные разработки в области патогенетической терапии продолжаются.
С учетом многофакторности причин, в первую очередь обусловленных метаболическими нарушениями, и сложности комплексного патогенеза ДНП одним из ведущих направлений в терапии становится создание комбинированных лекарственных препаратов таргетного действия с максимально возможным охватом происходящих на клеточном уровне патологических процессов. К числу таких препаратов относится препарат, содержащий в своем составе инозин, никотинамид, рибофлавин и янтарную кислоту. Препарат обладает нейрометаболическим действием, разработан для лечения заболеваний нервной системы, данные по эффективности его применения в лечении астеноневротического синдрома, цереброваскулярных заболеваний и других неврологических нарушений публикуются исследователями на протяжении последних 20 лет [34, 35].
Все компоненты препарата – это естественные метаболиты организма с фармакологической активностью в отношении стимуляции тканевого дыхания. При этом каждый из компонентов этого препарата имеет точку приложения в патогенетических процессах. Янтарная кислота – эндогенный внутриклеточный метаболит цикла Кребса, реализует свои свойства через регуляцию функциональной активности митохондрий (при гипофункции – активация, при гиперфункции – понижение активности), обладает антигипоксическим действием и стимулирует аэробный гликолиз. При этом она полностью распадается в организме до конечных продуктов (углекислый газ и вода), являющихся естественными метаболитами организма. Рибофлавин (витамин В2) активирует факторы антиоксидантной защиты (сукцинатдегидрогеназу), которые у пациентов с СД в тканях содержатся в значительно меньшем количестве, чем у здоровых лиц. Никотинамид в клетках трансформируется в форму никотинамидадениннуклеотида (НАД) и никотинамидадениннуклеотида фосфата (НАДФ), которые активируют ферменты цикла Кребса, стимулируют клеточное дыхание и синтез АТФ. Инозин активирует ферменты цикла Кребса и стимулирует синтез НАД.
Препарат обладает высокой биодоступностью, хорошо абсорбируется из ЖКТ, что имеет большое значение для пациентов с СД, имеющих не только диагностированную, но чаще недиагностированную форму гастроинтестинальной автономной НП. Поскольку в составе препарата содержатся естественные компоненты обменных процессов, они легко проникают в ткани и легко выводятся из организма. По данным, представленным производителем, доклинические исследования безопасности, включающие исследования токсичности при многократном введении, генотоксичности, репродуктивной токсичности, изучение аллергизирующих свойств не выявили наличия у препарата токсичных или потенциально опасных для человека свойств.
По данным проведенного мета-анализа [34], данный препарат при разных типах неврологической патологии достоверно повышает вероятность позитивного исхода. Комплексное влияние препарата проявляется в положительном воздействии на патофизиологические механизмы: нормализует метаболические процессы на уровне нервной клетки, оказывает антигипоксическое и антиоксидантное воздействия и улучшает процесс утилизации глюкозы. Все эти эффекты имеют большое значение для коррекции неврологических нарушений у пациентов с СД. Перспективы применения этого комбинированного препарата в диабетологии подкреплены данными проведенных исследований [36–37].
Заключение
Проведенные научные исследования в разных странах позволили достигнуть значительного прогресса в изучении патофизиологии невропатических осложнений СД и представить последовательность процессов, происходящих в нервной ткани. Все это позволило совершенствовать таргетные подходы к терапии и шире включать в терапевтический комплекс многокомпонентные препараты, имеющие несколько точек приложения для коррекции развивающихся вариантов НП с позиций патофизиологического подхода.



