Введение
Акромегалия – тяжелое хроническое заболевание, обусловленное гиперпродукцией соматотропного гормона (СТГ), которое выраженно влияет на качество и продолжительность жизни. Гиперпродукция СТГ приводит к развитию тяжелых коморбидных заболеваний, среди которых деформация осевого скелета, остеоартроз, сердечно-сосудистые заболевания, нарушения углеводного обмена, некоторые виды онкологических заболеваний [1]. У пациентов с активной акромегалией отмечается ранняя инвалидизация и повышение смертности по отношению к общей популяции [2].
Современные методы лечения и постоянно обновляемые клинические рекомендации позволили добиться более значимых успехов в лечении акромегалии за последние десятилетия. В систематическом обзоре и метаанализе было продемонстрировано, что после 2008 г. отмечается увеличение доли пациентов с акромегалией, достигших биохимического контроля этого заболевания, что сопровождается уменьшением уровня смертности [3]. Таким образом, скорейшее достижение биохимического контроля является критическим условием сохранения здоровья пациентов с акромегалией.
В настоящее время лечение акромегалии включает нейрохирургическое вмешательство, медикаментозную терапию (в РФ доступны аналоги соматостатина пролонгированного действия октреотид и ланреотид, антагонист гормона роста пэгвисомант, агонист дофаминовых рецепторов каберголин), а также лучевые методы воздействия на соматотропиному. Оправданное применение этих лечебных опций способствует достижению биохимического контроля акромегалии. Наблюдение и лечение пациента должно выполняться квалифицированной мультидисциплинарной командой, включающей нейроэндокринолога, нейрохирурга и других соответствующих специалистов, имеющих достаточных опыт ведения пациентов с опухолями гипофиза [4]. В Московской области квалифицированная мультидисциплинарная команда специалистов, занимающихся гипофизарными заболеваниями, сформирована в ГБУЗ МО МОНИКИ им. М.Ф. Владимирского. Мониторинг пациентов с акромегалией на экспертном уровне является важным условием оптимального лечения и достижения контроля заболевания.
Цель исследования
Оценить время последнего визита в Экспертный центр пациентов с акромегалией Московской области, а также – на момент последнего визита – долю пациентов с контролируемой и неконтролируемой акромегалией, проанализировать виды проведенного лечения.
Методы
Было проведено ретроспективное наблюдательное исследование. По данным ГБУЗ МО МОНИКИ им. М.Ф. Владимирского в Московской области проживают 377 пациентов с акромегалией. Для анализа были отобраны медицинские карты 327 пациентов с акромегалией, наблюдавшихся в ГБУЗ МО МОНИКИ им. М.Ф. Владимирского. Критериями включения в исследование были наличие информативной записи эндокринолога КДЦ ГБУЗ МО МОНИКИ с указанием активности акромегалии и проводимого лечения, критерием исключения – сведения о смерти пациента или отсутствие визитов пациента в КДЦ МОНИКИ с 2012 г.
В исследовании были использованы следующие данные: возраст пациентов в настоящее время и возраст на момент диагностики акромегалии, пол пациентов, размер соматотропиномы в момент диагностики, год последней консультации эндокринолога в КДЦ ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, активность акромегалии на момент последнего визита к эндокринологу КДЦ ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, виды проведенного лечения.
Контролируемой акромегалией считалось состояние, при котором уровень гормона роста был <2,5 нг/мл, а уровень инсулиноподобного фактора роста 1 (ИФР-1) находился в пределах половозрастных референсных значений (кроме пациентов, получавших пэгвисомант: в отношении них учитывался только уровень ИФР-1).
Статистическая обработка данных проводилась с использованием Microsoft Excel® 2016 MSO. Для количественных данных с нормальным распределением использовались показатели «среднее значение±стандартное отклонение». Для определения статистической значимости различий категориальных переменных в независимых группах использовался тест хи-квадрат (χ2) с поправкой Йетса. Критический уровень значимости при статистической проверке гипотез в данном исследовании был принят равным 0,05.
Результаты
Средний возраст пациентов на момент установки диагноза составил 49+14,1 года. Большинству (52%) пациентов диагноз был поставлен в возрасте от 41 до 60 лет (рис. 1). Число женщин (252 пациентки, 77%) было значительно больше по сравнению с числом мужчин (75 пациентов, 23%). В дебюте заболевания до начала лечения размер соматотропиномы соответствовал макроаденоме гипофиза (любой размер образования был более 10 мм) у 249 человек (76,2%), размеры образования гипофиза были менее 10 мм у 57 (17,4%) пациентов, предположительно с эктопической гиперпродукцией СТГ была 1 (0,3%) пациентка, и у 20 (6,1%) пациентов не было данных об изначальных размерах соматотропиномы.
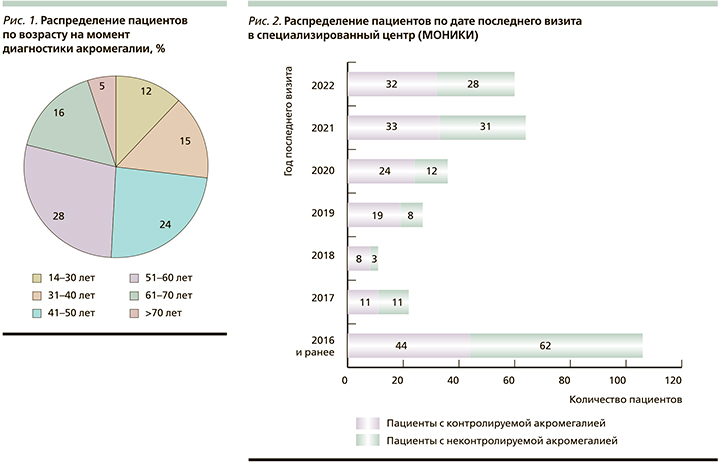
Распределение пациентов по дате последнего визита в КДЦ МОНИКИ представлено на рис. 2. На момент последнего визита средний возраст пациентов составил 58+13,4 года; контролируемая акромегалия была у 171 (52,3%) пациента, неконтролируемая – у 155 (47,4%), у 1 (0,3%) пациента на момент последнего визита не было данных о контроле акромегалии.
В целом нейрохирургическое лечение получили 56,6% пациентов, медикаментозное лечение – 65,7%, лечение аналогами соматостатина как первой линии лечения – 27,5% пациентов, лучевое лечение – 18,7% (см. таблицу). Основными видами лечения были нейрохирургическая операция и медикаментозная терапия аналогами соматостатина первого поколения, а также их комбинация в группе конролируемой акромегалии, а также монотерапия аналогами соматостатина в качестве первой линии лечения или после нерадикальной аденомэктомии в группе неконтролируемой акромегалии (рис. 3). Частота применения других видов лечения статистически значимо не различалась в зависимости от контроля заболевания (см. таблицу). Среди других возможных видов комбинированного лечения, не указанных на рис. 3, были аналоги соматостатина+каберголин, монотерапия каберголином, каберголин после нейрохирургического лечения, каберголин после нейрохирургического и лучевого лечения, аналоги соматостатина+пэгвисомант после нейрохирургического лечения, аналоги соматостатина+пэгвисомант после нейрохирургического и лучевого лечения.
Доля мужчин в группе контролируемой акромегалии была статистически значимо меньше по сравнению с таковой в группе неконтролируемой (18,1 и 28,3% соответственно; р=0,035). Средний возраст на момент диагностики акромегалии в группах контролируемой и неконтролируемой акромегалии составил 46,5+13,3 и 51,7+14,2 года соответственно (р=0,08).
Дозы аналогов соматостатина, применяемые в лечении акромегалии в Московской области, представлены на рис. 4.
Обсуждение
Результаты нашего исследования показали, что средний возраст диагностики акромегалии (49 лет), значительная доля женщин (77%), а также преобладание макросоматотропином (76,2%) в общей когорте пациентов с акромегалией в Московской области сопоставимы с данными других исследований [5–8].
Проведенный анализ позволил выявить, что 50,8% пациентов не посещали эндокринолога КДЦ МОНИКИ с 2019 г. (включительно). При этом половина (50,6%) из них были без контроля основного заболевания на момент последнего визита. В исследовании ACROSPECT, проведенном в 2014 г., показано, что в течение 2 лет 21% пациентов с акромегалией были утеряны из наблюдения специализированными центрами [9]. В нашем исследовании доля «утерянных» пациентов оказалась значительно больше. Возможно, на посещаемость специализированного центра МОНИКИ повлияла новая коронавирусная инфекция Covid-19: в исследованиях показано значительное снижение частоты визитов пациентов с акромегалией к специалистам в условиях пандемии [10, 11]. Необходимы дополнительные исследования для оценки причин выпадения пациентов с акромегалией из наблюдения, в т.ч. с уточнением влияния пандемии на качество мониторинга лечения.
Доля пациентов, достигших контроля акромегалии на момент последнего визита, составила 52,3%, что согласуется с результатами наблюдения за пациентами с акромегалией в других российских регионах, например в Москве (69%) или Республике Татарстан (60%), а также сравнима с частотой достижения контроля акромегалии по объединенным международным данным (61,2%) [5, 7, 12].
Частота выполнения нейрохирургического вмешательства была статистически значимо больше в группе контролируемой акромегалии, в то время как частота применения аналогов соматостатина (в т.ч. и в качестве первой линии лечения) – в группе неконтролируемой (см. таблицу). Аналоги соматостатина могут быть рекомендованы в качестве первой линии лечения в тех случаях, когда имеется низкий шанс радикального удаления соматотропиномы из-за особенностей ее расположения у лиц пожилого возраста, женского пола, а также при некоторых других характеристиках, которые указывают на высокую вероятность биохимического ответа на лечение [13]. Однако, если уровень ИФР-1 не снижается до целевого через 3–12 месяцев лечения высокими дозами ланреотида или октреотида, необходима смена тактики лечения, в первую очередь – рассмотрение вопроса о проведении нейрохирургического вмешательства [12, 13]. Даже если нет шанса радикальной аденомэктомии, частичное удаление опухоли повышает вероятность биохимического контроля после операции и/или дает шанс применить другие методы лечения (такие, как радиохирургия, антагонист гормона роста пэгвисомант) [1, 14]. По нашим данным, вероятность достижения контроля акромегалии после нейрохирургического вмешательства статистически значимо выше, чем без такового – отношение шансов (ОШ) – 3,819 (95% ДИ: 2,424–6,017).

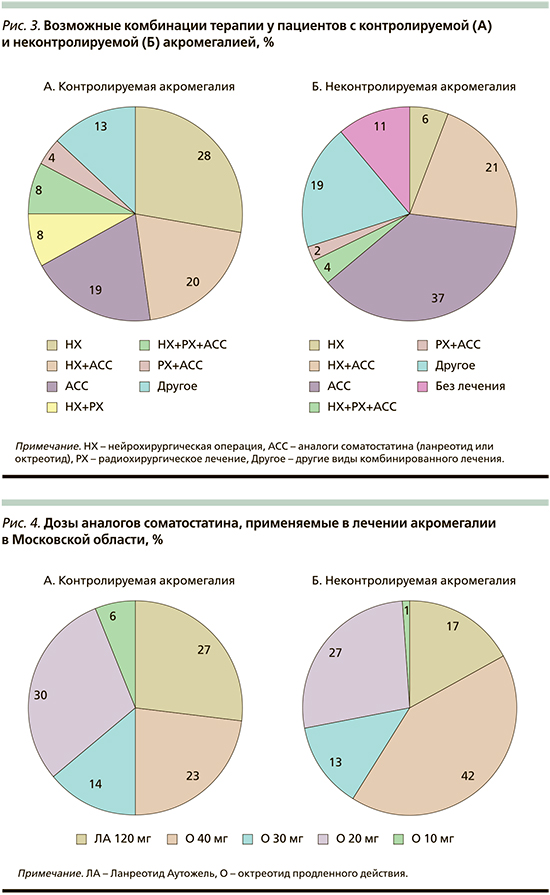
Из пациентов, получавших лечение аналогами соматостатина, максимальные дозы препаратов – Ланреотид аутожель 120 мг и октреотид продленного действия 40 мг – получали 50% с контролируемой и 59% с неконтролируемой акромегалией. Мы уже ранее публиковали данные о том, что большинство пациентов с акромегалией нуждаются в дозе октреотида продленного действия 30 мг и выше [15, 16]. К сожалению, в условиях сложившейся клинической практики старт терапии обычно начинается с 20 мг октреотида продленного действия, и дальнейшая титрация дозы может занимать значительный период времени, особенно при пропуске визита в специализированный центр, где обычно происходит оценка результатов лечения и изменение его тактики. Логичнее было бы стартовать с дозировки 30 или 40 мг и при недостаточном биохимическом ответе уже через 3 месяца от начала лечения рассматривать другие варианты лечебной тактики.
Необходимо отметить, что для старта терапии ланреотидом аутожелем в максимальной дозировке 120 мг есть своя доказательная база – в ходе исследования PRIMARYS с участием пациентов, не получавших до этого никакой терапии, был продемонстрирован как биохимический, так и опухолевый ответ на такое лечение в течение 48 недель [16, 17]. При этом было продемонстрировано, что даже у тех пациентов, кто не достиг биохимического контроля, может ожидаться противоопухолевый эффект препарата (т.е. уменьшение размера аденомы гипофиза на 20% и более) [18]. Предполагается, что в отличие от ингибиторного проапоптозное действие аналогов соматостатина в целом и ланреотида в частности большей частью обусловлено воздействием на подтип 5 рецепторов соматостатина и поэтому не всегда сопровождается достижением биохимического контроля. При снижении уровня ИФР-1 ниже половозрастных значений возможно увеличение интервала между инъекциями ланреотида, что также показано в ходе исследования LEAD [19]. Пациенту нет необходимости менять дозировку препарата: меняется периодичность введения, что снижает потребность в болезненных процедурах. Кроме того, инъекции ланреотида аутожеля технически просты (препарат производится в виде уже преднаполненного шприца удобной конструкции), и после обучения пациенты или их родственники могут выполнять их самостоятельно, что, очевидно, оказывает положительное влияние на комплаентность к лечению [20].
Среди факторов, которые являются возможным предиктором резистентности к медикаментозному лечению аналогами соматостатина, указывают мужской пол и молодой возраст.
В нашем исследовании в группе неконтролируемой акромегалии доля лиц мужского пола действительно была значимо выше, в то время как возраст пациентов в момент диагностики заболевания был несколько моложе (хотя возрастные различия не достигли статистической значимости).
Выводы
Необходимо проведение дополнительных исследований для оценки регулярности визитов пациентов с акромегалией к врачам специализированных центров областного и федерального уровней, а также обеспечение преемственности в ведении пациентов для возможности оценки отдаленных результатов лечения и оценки смертности.
Рекомендуется рассматривать применение нейрохирургического вмешательства в отношении пациентов с акромегалией во всех возможных случаях, особенно при сохраняющейся активности заболевания на фоне терапии аналогами соматостатина в максимальных дозировках.
Принимая во внимание в целом накопленный многолетний опыт применения и благоприятный профиль эффективности/безопасности аналогов соматостатина, проведение ими медикаментозной терапии лицам без достижения целевых гормональных критериев контроля акромегалии целесообразно начинать или сразу с высоких дозировок, или путем быстрого увеличения дозы до максимально возможной. Реальная клиническая практика показывает, что данный подход позволяет наилучшим образом использовать все преимущества как ингибиторного, так и противоопухолевого действия этой группы препаратов, минимизируя время до наступления биохимической ремиссии и обеспечивая контроль над ростом аденомы. Кроме того, старт терапии аналогами соматостатина с высоких доз также позволяет быстрее оценивать эффективность назначенного лечения, чтобы в случае необходимости без больших потерь времени производить ее коррекцию, тем самым снижая риски развития возможных осложнений акромегалии.


