Введение
Развитие остеопороза (ОП) является одним из наиболее частых и серьезных осложнений ревматоидного артрита (РА) [1–4], во многом определяет его неблагоприятное течение и прогноз, ассоциированные с высокой частотой остеопоротических переломов [5–7] и летальным исходом после их развития [8, 9].
ОП при РА относится к иммуно-опосредованным вторичным остеопатиям, при которых нарушение костного ремоделирования с преобладанием процессов резорбции костной ткани ассоциировано с наличием системного воспаления, циркулирующими аутоантителами и секрецией провоспалительных цитокинов [10]. Несмотря на многочисленные исследования, в которых оценивалась роль как общих факторов риска ОП (пол, возраст, генетическая предрасположенность, гипогонадизм, курение и др.), так и факторов, связанных с самим РА (длительность и активность заболевания, тяжесть функциональных нарушений, терапия глюкокортикоидами [ГК], прием синтетических базисных противовоспалительных препаратов [сБПВП] и др.), роль каждого из этих факторов в нарушении костного метаболизма до конца не изучена [11].
Большинство имеющихся данных об ОП, ассоциированном с РА, как и в общей популяции, получены в исследованиях с участием женщин. Данные об особенностях костного ремоделирования у мужчин при РА все еще малочисленны и весьма противоречивы. Однако по данным некоторых авторов, показано, что частота ОП при РА у мужчин сопоставима с распространенностью его среди женщин с РА [12, 13]. В то же время остеопоротические переломы у мужчин в общей популяции случаются на 4 года раньше, чем у женщин, а смертность после них в течение первого года значительно выше (37,1% у мужчин против 26,4% у женщин) [14]. Кроме того, у пациентов с РА низкоэнергетические переломы могут развиваться при более высокой минеральной плотности костной ткани (МПКТ) по сравнению с пациентами без РА [15].
Цель исследования: оценить состояние МПКТ и показатели андрогенного статуса у больных РА мужского пола старше 50 лет.
Методы
В исследование были включены 96 мужчин в возрасте от 50 до 70 лет (медиана возраста 59 [54; 64,75] лет) с достоверным диагнозом РА, установленным на основании критериев ACR (1987) и/или ACR/EULAR (2010), с длительностью заболевания не менее года и не получавших ранее генно-инженерных биологических препаратов. В исследование не включались лица, имевшие тяжелые сопутствовавшие соматические заболевания с выраженной органной недостаточностью и принимавшие лекарственные средства, оказывавшие существенное влияние на процессы костного ремоделирования, за исключением ГК. Проведение исследования одобрено этическим комитетом ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России до начала набора материала. Все пациенты, вошедшие в исследование, подписали добровольное информированное согласие на участие в нем.
Выполнялась оценка антропометрических данных (рост, масса тела, окружность талии и бедер), суставного статуса (число болезненных и припухших суставов из 28), активности заболевания по индексу DAS28-СОЭ, функциональных нарушений по опроснику состояния здоровья HAQ (Health Assessment Questionnaire). Стандартное лабораторное обследование включало определение СОЭ (по методу Вестергрена) и СРБ.
Характеристика больных РА, составивших основную группу, представлена в табл. 1. Среди обследованных преобладали пациенты с развернутой стадией (84,4%), умеренной и высокой активностью заболевания (84,4%), наличием эрозий по данным рентгенографии суставов кистей и стоп (64,6%), позитивные по ревматоидному фактору (РФ) (78,1%); внесуставные проявления выявлены в 47,9% случаев и преимущественно представлены ревматоидными узелками. 44,8% пациентов с РА принимали ГК на протяжении 3 и более месяцев в средней суточной дозе 5 [5; 7,5] мг. Все пациенты получали базисную терапию синтетическими болезнь-модифицирующими антиревматическими препаратами.
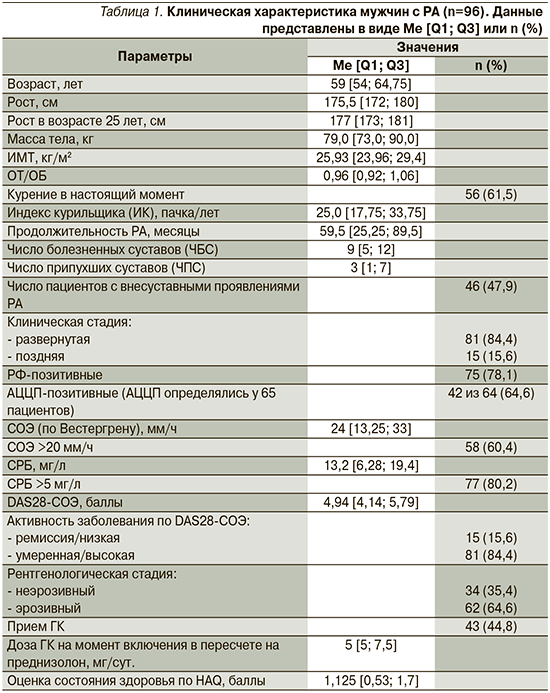
В группу контроля вошли 30 практически здоровых мужчин, сопоставимых по возрасту (медиана возраста – 61,0 [56,75; 64,5] лет, р>0,05).
Лабораторная оценка андрогенного статуса включала определение уровня общего тестостерона и глобулина, связывающего половые гормоны (ГСПГ), иммунохимическим методом на автоматическом хемилюминесцентном анализаторе ARCHITECT i2000 SR (Abbott). Содержание свободного и биодоступного тестостерона определялось расчетным методом с использованием электронного калькулятора (http://www.issam.ch/freetesto.htm). Также дополнительно был рассчитан индекс андрогенной активности, представляющий собой отношение общего тестостерона к ГСПГ (выраженное в %).
Андрогенный статус был определен у 59 мужчин с РА и у 30 – контрольной группы. Андрогенный дефицит устанавливался при значении общего тестостерона менее 12 нмоль/л и/или свободного тестостерона менее 225 пмоль/л [16, 17].
Всем пациентам основной группы и мужчинам группы контроля проведено определение МПКТ поясничного отдела позвоночника, шейки бедра и проксимального отдела бедра в целом методом двухэнергетической рентгеновской абсорбциометрии (DXA) на аппарате Stratos dR (DMS, Франция). Полученные результаты оценивались в абсолютных значениях (г/см2) и по Т-критерию в величинах стандартного отклонения (SD) от нормальной пиковой костной массы. В соответствии с рекомендациями Всемирной организации здравоохранения (ВОЗ, 1994) диагноз ОП устанавливался мужчинам старше 50 при значении Т-критерия ≤-2,5 SD, при значении Т-критерия в диапазоне от -1,0 до -2,5 SD снижение МПКТ соответствовало остеопении, а при Т-критерии от +2,5 до -1,0 SD показатели МПКТ были в пределах нормы [18].
Статистическая обработка полученных данных выполнена с использованием пакета прикладных программ IBM SPSS Statistics. 26. Поскольку большинство полученных данных имело неправильное распределение, были использованы методы непараметрического анализа. Количественные переменные описывались числом пациентов, медианой (Me) и 25-м и 75-м процентилями (Ме [Q1; Q3]). Сравнение двух групп по количественным признакам осуществлялось с использованием критерия Манна–Уитни. Направление и теснота корреляционной связи между двумя количественными показателями оценивались с помощью коэффициента корреляции Спирмана. Различия по частоте качественных признаков проверялись с использованием критерия χ2 (хи-квадрат). Статистически значимыми считались различия при p <0,05.
Результаты
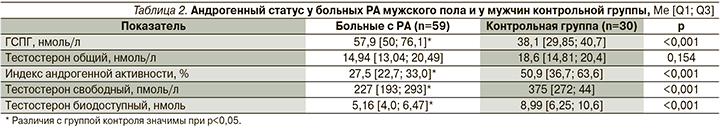
Результаты оценки андрогенного статуса у мужчин с РА и контрольной группы представлены в табл. 2. Как видно из данных таблицы, больные РА имели статистически значимо более высокие показатели ГСПГ, чем пациенты контрольной группы. При этом у 29 (49,2%) мужчин с РА уровень ГСПГ оказался выше верхней границы нормы (60 нмоль/л), в то время как в группе контроля ни у одного из мужчин отклонений от референсных значений выявлено не было.
Уровень ГСПГ статистически значимо не различался у больных РА в зависимости от длительности и активности заболевания, позитивности по РФ и АЦЦП, наличия внесуставных проявлений, а также от длительности приема и кумулятивной дозы ГК. Однако нами была установлена умеренная отрицательная корреляция ГСПГ с суточной дозой ГК (r=-0,431, p=0,036) и слабая положительная корреляционная связь с концентрацией СРБ (r=0,312, р=0,016). Также уровень ГСПГ у пациентов с эрозивным течением РА был статистически значимо выше, чем у больных без эрозий по данным рентгенографии (62,0 [52,4; 78,1] нмоль/л против 50,9 [48,8; 62,6] нмоль/л, р=0,023) и у больных на поздней клинической стадии заболевания, чем на развернутой (71,0 [62,2; 92,9] нмоль/л против 55,0 [49,3; 69,9] нмоль/л, р=0,023).
Нами была установлена статистически значимая положительная корреляционная связь слабой силы ухудшения качества жизни по опроснику HAQ с более высоким уровнем ГСПГ (r=0,27, р=0,039).
Несмотря на отсутствие статистически значимых различий между мужчинами с РА и без РА по уровню общего тестостерона, в основной группе статистически значимо чаще выявлено его снижение менее 15 нмоль/л (р=0,059), а у 13,6% больных РА снижение уровня общего тестостерона было менее 12 нмоль/л, при этом в группе контроля данное снижение выявлено только у одного пациента. Уровень общего тестостерона имел сильную отрицательную корреляционную связь с ИМТ (r=-0,512, р<0,001). Прием ГК не оказывал больным РА статистически значимого влияния на концентрацию общего тестостерона (р=0,192). Нами определена тенденция к более высокому уровню общего тестостерона у больных с серопозитивным РА, чем при серонегативном течении (15,49 [13,46; 21,41] нмоль/л и 13,07 [12,81; 14,9] нмоль/л соответственно, р=0,051)
При расчете индекса андрогенной активности, уровня свободного и биодоступного тестостерона установлены статистически значимые различия между группами. Свободный тестостерон ниже 225 пмоль/л определялся у 29 (49,2%) больных РА и лишь у 2 мужчин контрольной группы. Корреляции уровня свободного тестостерона с уровнем ГСПГ в основной группе нами не выявлено, при этом в группе контроля получена достоверная ассоциация показателей свободного тестостерона с уровнем ГСПГ (r=-0,569, p=0,007).
Выявлена обратная корреляционная связь индекса андрогенной активности, концентрации свободного и биодоступного тестостерона с суточной дозой ГК (r=-0,46, r=-0,471 и r=-0,483 соответственно), а также концентрации свободного и биодоступного тестостерона со значениями ИМТ (r=-0,298 и r=-0,274 соответственно) у мужчин с РА (во всех случаях р<0,05). Различий в показателях свободного и биодоступного тестостерона в зависимости от длительности РА, его активности и наличия внесуставных проявлений не выявлено.
Андрогенный дефицит на основании лабораторных показателей был выявлен у 30 (50,8%) пациентов.
Выявлено статистически значимое снижение МПКТ по данным DXA во всех отделах исследования пациентов с РА по сравнению с показателями МПКТ лиц контрольной группы (табл. 3). Наиболее значимое снижение МПКТ в основной группе отмечено в шейке бедренной кости как в абсолютных значениях, так и по Т-критерию, составив соответственно 0,821 [0,736; 0,952] г/см2 и -1,3 [-1,9; -0,5] SD.
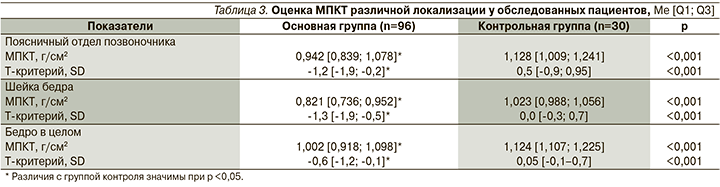
Частота снижения МПКТ в различных областях измерения представлена в табл. 4. Остеопенический синдром на основании оценки Т-критерия определен у 69 (71,9%) мужчин с РА: в 11 (11,5%) случаях снижение МПКТ хотя бы в одной области соответствовало ОП и в 58 (60,4%) случаях – остео-пении.

У 6 больных РА снижение МПКТ до уровня ОП выявлено только в поясничном отделе позвоночника, у 3 – в шейке бедра, у 2 пациентов определено снижение в двух областях (поясничный отдел позвоночника и шейка бедра). Нормальные показатели МПКТ во всех трех отделах исследования имели 27 (28,1%) мужчин основной группы.
В контрольной группе остеопенический синдром верифицирован в 20% случаев: у пяти мужчин снижение МПКТ до остеопении выявлено в поясничном отделе позвоночника и у одного – в шейке бедра.
Поскольку практически половина всех мужчин с РА (44,8%) принимали ГК, нами был проведен сравнительный анализ денситометрических показателей в зависимости от данного фактора риска развития ОП. Так, у пациентов с РА и находившихся на терапии ГК МПКТ поясничного отдела позвоночника и проксимального отдела бедра в целом была статистически значимо ниже, чем у больных без глюкокортикоидной терапии, – 0,875 [0,817; 0,942] против 0,999 [0,901; 1,109] г/см2 (р<0,001) и 0,975 [0,882; 1,065] против 1,038 [0,942; 1,158] г/см2 (р=0,036) соответственно. Влияния ГК на МПКТ шейки бедра в исследуемой когорте больных нами выявлено не было (р=0,227). Необходимо отметить, что у 27 (46,6%) пациентов с остеопенией и принимавших ГК выявлено снижение Т-критерия ≤-1,5 SD.
У пациентов с остеопеническим синдромом активность заболевания по DAS28-СОЭ была статистически значимо выше, чем у пациентов с нормальными показателями МПКТ (5,37 [4,52; 5,86] против 4,67 [3,50; 5,25], р=0,032). Также остеопенический синдром выявлялся статистически значимо чаще у пациентов, позитивных по РФ, чем у серонегативных (р=0,032). Качество жизни по опроснику HAQ не различалось у лиц основной группы в зависимости от наличия или отсутствия остеопенического синдрома (1,32 [0,62; 1,62] и 0,88 [0,31; 1,55] соответственно, р=0,097).
Результаты анализа МПКТ различных локализаций в зависимости от наличия внесуставных проявлений и эрозий, а также от рентгенологической стадии РА не показали статистически значимых различий. Однако у пациентов на развернутой клинической стадии заболевания МПКТ поясничного отдела позвоночника была статистически значимо ниже, чем у пациентов на поздней стадии (р=0,046).
Установлено, что у позитивных по АЦЦП пациентов отмечалось значимое снижение МПКТ поясничного отдела позвоночника (р<0,001) и тенденция к снижению денситометрических показателей в шейке бедра и бедра в целом.
Была продемонстрирована тенденция к уменьшению частоты выявления остеопенического синдрома у пациентов с более высоким ИМТ, однако разница в частоте не достигала статистической значимости (р=0,065). Слабая положительная корреляционная связь установлена между ИМТ и МПКТ шейки бедра (r=0,256, р=0,012), а также между ИМТ и МПКТ проксимального отдела бедра в целом (r=0,265, р=0,009).
Среди 59 мужчин с РА, которым проведено лабораторное определение андрогенного статуса, 10 пациентов имели ОП, 40 – остеопению и 9 пациентов – нормальные показатели МПКТ. Значимое снижение общего тестостерона (менее 12 нмоль/л) и/или свободного тестостерона (менее 225 пмоль/л) выявлено у 7 (70%) пациентов с ОП, у 20 (50%) с остеопенией и только у 3 (33,3%) мужчин с РА и нормальной МПКТ (табл. 5).

Нами был проведен анализ МПКТ различных локализаций в зависимости от андрогенного дефицита, который выявил существенные различия только в МПКТ поясничного отдела позвоночника. Так, у пациентов с андрогенным дефицитом МПКТ поясничного отдела составила 0,85 [0,80; 0,96] против 0,94 [0,84; 1,08] г/см2 у больных с нормальными показателями андрогенного статуса (р=0,036).
Обсуждение
Начиная с конца 1980-х гг. стали появляться единичные работы, посвященные изучению роли изменений андрогенного статуса в развитии и течении РА у мужчин. Показано, что более высокий уровень тестостерона у молодых мужчин может иметь протективную роль в развитии РА [19], а гипоандрогенемия, по данным ряда авторов, наоборот, способствует возникновению РА и/или развивается как следствие хронического воспалительного процесса. Так, T.D. Spector et al. при обследовании 87 мужчин с РА выявили достоверно более низкий уровень общего тестостерона и более высокие показатели ГСПГ по сравнению с контрольной группой [20]. Схожие данные в отношении общего тестостерона были получены B. Tengstrand et al. при изучении андрогенного статуса у мужчин с РА и без РА только в возрастной группе 50–59 лет (14,9+5,1 против 18,6+6,0, р<0,01), в то время как у мужчин с РА в возрасте 60–69 лет статистически значимых различий с сопоставимой по возрасту группой контроля не установлено (14,1+4,9 против 16,6+5,6 нмоль/л, р>0,05). [21]. В исследовании M. Lashkari et al., включившем 29 пациентов с РА мужского пола и 24 контрольной группы, было показано, что достоверных различий в уровне общего тестостерона между группами нет (p=0,923) [22], что также согласуется с полученными в нашей работе данными (р=0,154). Кроме того, авторы выявили достоверное снижение уровня дигидроэпиандростерона сульфата у мужчин с РА по сравнению со здоровыми лицами, однако в нашем исследовании изучение данного гормона не проводилось.
Нами выявлена статистически значимо более высокая сывороточная концентрация ГСПГ у мужчин с РА по сравнению с лицами контрольной группы (р<0,001), а у 49,2% больных его содержание оказалось выше нормальных значений. Схожие данные продемонстрированы в недавно опубликованной работе Z. Qu et al. (2020) при анализе большой когорты больных РА (1259 мужчин и 2758 женщин) [23], что указывает на возможную роль ГСПГ в развитии РА независимо от гендерной принадлежности. В исследовании B. Tengstrand et al. [21] статистически значимых различий в концентрации ГСПГ между пациентами с РА и здоровыми мужчинами не было определено ни в группе наблюдения 50–59 лет, ни в группе наблюдения 60–69 лет. При наблюдении 38 мужчин с РА в течение 2 лет отмечалось увеличение уровня ГСПГ по сравнению с исходными показателями пациентов как с положительной динамикой на фоне терапии РА (n=22), так и с ухудшением показателя активности заболевания (n=16) [24]. А.L. Mirone et al., наоборот, выявили у больных РА значительно более низкие уровни ГСПГ по сравнению с группой контроля [25]. По данным M. Pikwer et al. [26] уровень ГСПГ был выше у пациентов, позитивных по РФ, чем у серонегативных, но, по данным нашего анализа, подобных различий между подгруппами пациентов не получено.
Данные о влиянии глюкокортикоидной терапии на уровень андрогенов в сыворотке крови весьма противоречивы. По данным B. Lunenfeld et al., у пациентов, длительно принимающих ГК, может развиваться гипоандрогенемия [16]. Нами не было выявлено статистически значимых различий в содержании общего тестостерона в зависимости от приема больными РА глюкокортикоидных препаратов, однако уровень свободного и бидоступного тестостерона имел отрицательную корреляционную связь с более высокой суточной дозой ГК. B. Tengstrand et al. [21] и L. Mateo et al. [27] не обнаружили никакой корреляции между кумулятивной дозой ГК и уровнем свободного тестостерона.
В настоящей работе установлено: уровень ГСПГ имел отрицательную корреляционную связь с суточной дозой ГК независимо от продолжительности глюкокортикоидной терапии. M. Navarro et al. также показали, что более низкие концентрации ГСПГ в сыворотке наблюдались в группе пациентов с РА, получавших лечение ГК [28], на основании чего ими сделано предположение, согласно которому уровень ГСПГ положительно связан с тяжестью РА. Нами установлено, что ГСПГ был выше у пациентов с эрозивным течением РА и с поздней клинической стадией.
M. Pikwer et al. [26] продемонстрировали, что у серопозитивных пациентов мужского пола уровень как общего, так и свободного тестостерона был статистически значимо выше, чем у серонегативных пациентов. Схожая тенденция была получена нами только между общим тестостероном и позитивным по РФ течением РА (р=0,051).
Продемонстрированное нами отсутствие различий в уровне свободного и биодоступного тестостерона в зависимости от продолжительности и активности РА, а также наличия внесуставных проявлений согласуется с данными B. Tengstrand et al. [29].
В настоящей работе выявлено, что, по данным DXA, МПКТ любой локализации у мужчин с РА была статистически значимо ниже по сравнению с таковой, согласно данным, полученным в группе контроля. Схожие результаты определены в работах Т.А. Раскиной и соавт. [30], B. Hauser et al. [4]. Однако в одномоментном поперечном исследовании, выполненном S.M. Kweon et al., показано, что достоверные различия в МПКТ у мужчин с и без РА определены только на уровне проксимального отдела бедра в целом, без статистически значимых различий в других отделах скелета [12]. Сопоставимые показатели МПКТ поясничного отдела позвоночника у мужчин с РА и у здоровых мужчин продемонстрированы Z. Zhu et al. (2021) [31]. В то же время Z. Hu et al. [32] показали, что у пациентов с РА мужского пола в возрасте 50 лет и старше частота остеопении и ОП в поясничном отделе позвоночника выше в 1,3 раза, чем в общей популяции.
Снижение МПКТ до уровня остео-пенического синдрома (Т-критерий <-1,0 SD) нами выявлено у 69 (71,9%) больных основной группы, среди которых преобладали пациенты с остеопенией (60,4%). Частота остеопении в исследованиях других авторов была в 1,5–2 раза меньше [33, 34], чем по нашим данным.
В настоящем исследовании ОП среди больных РА выявлен в 11,5% случаев и наиболее часто отмечался на уровне поясничного отдела позвоночника (8,3%), реже – в шейке бедра (5,2%). Сопоставимую частоту ОП установили M. Güler-Yüksel et al., анализируя данные DXA 109 мужчин с недавно установленным диагнозом РА (менее двух лет): снижение МПКТ до уровня ОП в поясничном отделе позвоночника было в 9,3% случаев, в проксимальном отделе бедра в целом в 3,3%, а любой локализации (поясничный отдел позвоночника и проксимальный отдел бедра) в 11% случаев [34]. Еще более низкая частота ОП определена M.C. Lodder et al.: ОП поясничного отдела позвоночника и шейки бедра выявлены в 8 и 3,5% случаев соответственно [35]. В то же время, по данным других авторов, частота ОП среди больных РА мужчин составляет 21–23% [12, 13, 36].
L. Stafford et al. [37] выявили снижение уровня тестостерона у 46% больных, но дефицит андрогенов, по их данным, не ассоциировался со снижением МПКТ и переломами. И хотя, по нашим данным, у 70% больных РА и ОП выявлен андрогенный дефицит, достоверные различия в МПКТ в зависимости от андрогенного статуса определены только в поясничном отделе позвоночника.
В ранее проведенных исследованиях выявлены ассоциации структурных изменений в суставах, активности заболевания и функциональных нарушений со снижением МПКТ у мужчин с РА [3, 29, 35]. В нашем исследовании частота остеопенического синдрома положительно ассоциировалась с высокой активностью заболевания, но не зависела от функциональных нарушений и рентгенологической стадии. Хотя снижение МПКТ поясничного отдела позвоночника было более выраженным у пациентов на поздней стадии заболевания. У пациентов, позитивных по РФ и АЦЦП, остеопенический синдром в нашей работе выявлялся статистически значимо чаще, что подтверждает данные одних авторов [34, 38] и противоречит другим [39].
Заключение
Таким образом, снижение МПКТ у больных РА мужского пола имеет высокую распространенность и требует своевременной диагностики, особенно у пациентов с высокой активностью заболевания, поздней стадией, позитивных по РФ и АЦЦП и находящихся на терапии ГК. Выявленные высокая частота повышения ГСПГ и снижения свободного (и биодоступного) тестостерона у мужчин с РА служат дополнительным фактором риска снижения МПКТ, что диктует необходимость включения в рутинное обследование таких пациентов определения андрогенного статуса. Возможность использования заместительной андрогенной терапии в коррекции нарушений костного метаболизма с точки зрения эффективности и безопасности еще предстоит определить в будущих клинических исследованиях.
Дополнительная информация Исследование не имело спонсорской поддержки. Все авторы принимали участие в разработке концепции статьи и в написании рукописи. Окончательная версия рукописи была одобрена всеми авторами. Авторы не получали гонорар за статью.


