Введение
Наиболее важным гормоном в процессе созревания, роста и старения мужского организма является тестостерон. Будучи мощным стимулятором всех обменных процессов в организме, тестостерон модулирует широкий круг физиологических реакций, влияя на физическую, сексуальную и эмоциональную активность [1]. Можно выделить следующие основные эффекты тестостерона: андрогенный – влияние на рост и развитие половых органов, появление вторичных половых признаков, эректильную функцию; анаболический – поддержание мышечной массы и плотности костной ткани, стимуляция синтеза органоспецифических белков; антигонадотропный – подавление секреции гонадотропинов; репродуктивный – поддержание сперматогенеза; психофизиологический – формирование стереотипа мужского поведения, либидо, стремления к лидерству, активного положительного настроения, памяти, внимания и др. [2].
Именно многофакторность воздействия тестостерона определяет диапазон метаболических нарушений, развивающихся вследствие его дефицита. В возрасте старше 40 лет у большинства мужчин начинает проявляться возрастной андрогенный дефицит, который сопровождается определенными клиническими симптомами, характерными для недостатка тестостерона в организме. Согласно рекомендациям Международного общества по изучению проблем пожилых мужчин ISSAM (The International Society for The Study of the Aging Male), при уровне общего тестостерона в крови ниже 12,1 нмоль/л и наличии клинических признаков андрогенного дефицита верифицируют состояние гипогонадизма, который может неблагоприятным образом влиять на функции различных органов и тканей, ухудшая качество жизни [3, 4].
С целью предотвращения развития ассоциированных с андрогенным дефицитом заболеваний, повышения качества жизни у стареющих мужчин были разработаны международные рекомендации по терапии гипогонадизма препаратами тестостерона [3–5].
Ранее нами было показано, что у молодых мужчин (возраст 21–35 лет) с метаболическим синдромом с высокой частотой выявляется андрогенный дефицит и определяются его клинические признаки, что в итоге позволило выявить гипогонадизм у 42% обследованных мужчин с метаболическим синдромом по сравнению с 5% мужчин того же возраста без этого синдрома [6].
У некоторых практически здоровых мужчин уровень тестостерона в крови на 5–20% ниже принятых нормальных значений, поэтому очень сложно провести четкую линию между гипогонадным и нормальным статусом мужского организма. Более того, пороговый уровень гормона, при котором у мужчины начинают проявляться симптомы гипогонадизма, индивидуален и варьируется от крайне низких значений до величины, превышающей нижнюю границу нормальных показателей для молодых мужчин [7].
Существует еще одна проблема в гормональной диагностике гипогонадизма, которая связана с лабильностью содержания тестостерона в крови. Этот феномен связан с множеством физиологических процессов в организме, влиянием на уровень тестостерона других гормонов, в частности глюкокортикоидов, которые являются основными гормонами стресса, и их уровень в циркуляции отражает выраженность стрессорных и компенсаторно-приспособительных процессов в организме. Поскольку мы живем в урбанизированной среде и подвергаемся действию множества психосоциальных стрессоров, влияние глюкокортикоидов на уровень тестостерона имеет существенное значение для лабораторной диагностики гипогонадизма.
Целью работы было изучить индивидуальную вариабельность уровня тестостерона в крови как лабораторного критерия диагностики гипогонадизма у мужчин.
Материал и методы
Для проверки предположения о наличии колебаний уровня тестостерона в крови и оценки их выраженности провели 10-кратное исследование содержания этого гормона в сыворотке крови у 16 мужчин в возрасте от 23 до 60 лет. Набор пациентов проводили в Региональном медико-диагностическом центре. Мужчины были отобраны в случайном порядке вне зависимости от наличия или отсутствия жалоб на какую-либо урологическую патологию. Обследование проведено с соблюдением Этических принципов проведения научных медицинских исследований с участием человека и в соответствии с правилами надлежащей клинической практики в Российской Федерации, одобрено локальным Комитетом по биомедицинской этике. С мужчинами проводили беседу, объясняющую цель и задачи исследования. Все обследованные мужчины дали информированное согласие на участие в исследовании.
Критериями исключения мужчин из группы для проведения обследования были наличие инфекционного заболевания на момент обследования; подтвержденные диагнозы рака простаты, грудной железы и опухолей яичек; наличие врожденных заболеваний, сопровождающихся гипогонадизмом (анорхизм, монорхизм, синдром Клайнфельтера, синдром Каллмана, пангипопитуитаризм); лекарственно-обусловленное (глюкокортикоиды, антиандрогены, эстрогены) снижение секреции тестостерона; заболевания, приводящие к снижению секреции тестостерона (гипотиреоз, опухоли гипофиза); прием ингибиторов 5-альфа-редуктазы и препаратов тестостерона в последние 6 месяцев относительно начала исследования; ранее проведенные операции на органах половой системы.
Всем мужчинам проводили анкетирование по шкале симптомов старения мужчины – AMS (Aging Male’s Symptom), число баллов 27 и выше интерпретировали как наличие клинических признаков гипогонадизма.
Исследование уровня общего тестостерона (ОТ) в крови проводили в течение 10 дней. Кровь для исследования забирали из локтевой вены с 08 до 10 часов натощак. Какой-либо подготовки накануне забора крови не проводили, привычный образ жизни у обследуемых мужчин не менялся. Концентрацию ОТ в сыворотке крови определяли методом твердофазного иммуноферментного анализа с использованием набора реагентов «Стероид ИФА-тестостерон-01» («Компания Алкор Био», Санкт-Петербург).
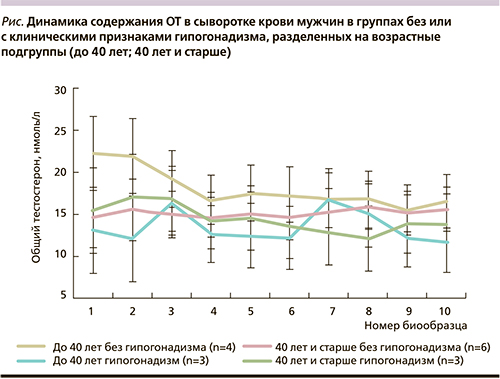
Анализ полученных результатов проводили в зависимости от наличия или отсутствия клинических признаков гипогонадизма и в зависимости от возраста включенных в обследование мужчин. Для этого всех мужчин на основании величины AMS в баллах распределили на 2 группы – с наличием (n=6) или отсутствием (n=10) клинических признаков гипогонадизма, и определяли вариабельность средних величин показателя ОТ в группе в динамике обследования. Внутри каждой группы мужчин подразделили на подгруппы – в возрасте до 40 лет и 40 лет и старше.
Статистическую обработку результатов проводили с использованием пакета анализа программы Microsoft Excel 2010 и пакета статистических программ «STATISTICA» v.10.0 (StatSoft Inc., США). Вариабельность уровня ОТ определяли с использованием коэффициента вариации. Совместные эффекты влияния возраста, наличия гипогонадизма и индивидуальной динамики на значения концентрации тестостерона оценивали методом многофакторного дисперсионного анализа для связанных выборок (Repeated Measures ANOVA). Уровень значимости был принят равным 0,05 (р<0,05).
Результаты и обсуждение
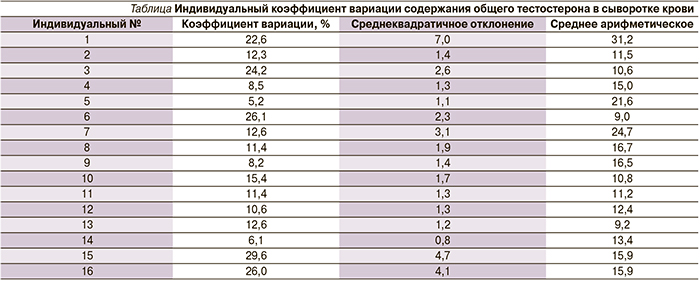
В таблице представлены результаты определения индивидуального коэффициента вариабельности уровня ОТ в крови у обследованных мужчин.
Величины индивидуальных коэффициентов вариации содержания ОТ в сыворотке крови у обследуемых мужчин менялись от 5,2 до 29,6%, что указывает на существенную вариабельность этого признака и ставит вопрос о возможных закономерностях этого явления.
Можно предположить, что вариабельность уровня ОТ в крови может зависеть от исходного функционального состояния половых желез и в условиях «нормальной» секреции гормона или в условиях патологии, например сниженной активности синтеза и секреции гормона в кровь, вариабельность этого признака будет различаться. Для проверки этого предположения был рассчитан средний коэффициент вариации уровня ОТ в группе мужчин без признаков гипогонадизма или с его клиническими проявлениями.
Величина коэффициента вариации средних величин ОТ в группе мужчин без клинических признаков гипогонадизма составила 13,3±2,2%, у мужчин с признаками гипогонадизма – 18,3±2,5%. Разница между величинами недостоверна (р>0,05), однако можно отметить тенденцию к повышению лабильности содержания тестостерона в группе мужчин с клиническими проявлениями гипогонадизма.
На рисунке показано, что наибольший диапазон колебаний уровня ОТ наблюдался в сыворотке крови у мужчин в возрастных подгруппах до 40 лет, причем как у мужчин без, так и с признаками гипогонадизма. У мужчин в возрастных подгруппах 40 лет и старше без клинических признаков гипогонадизма уровень ОТ практически не менялся на протяжении 10 дней.
С использованием метода многофакторной ANOVA показано, что совместное влияние факторов возраста, клинических проявлений андрогенного дефицита и динамики забора крови на уровень ОТ в крови статистически достоверно (p=0,01378).
Первые рекомендации по диагностике и лечению гипогонадизма были опубликованы в 2002 г. междисциплинарной группой экспертов ISSAM [4]. В связи с постоянным обновлением доказательной базы по данному вопросу рекомендации по ведению пациентов с гипогонадизмом регулярно обновляются (2005, 2009, 2013, 2015), но до сих пор на практике у врача уролога-андролога возникают вопросы по интерпретации получаемых гормональных исследований и тактике ведения пациентов.
Проведенное исследование показало, что разброс величины лабораторного критерия гипогонадизма – содержания ОТ у пациента, может быть значительным, в связи с чем можно сделать заключение, что использовать только первичную лабораторную диагностику как основной критерий выявления гипогонадизма нельзя, необходимо ориентироваться в первую очередь на симптомы данного состояния, а не только на лабораторные показатели. При этом стоит указать, что для повышения эффективности выявления гипогонадизма следует использовать комплексный подход к лабораторной диагностике, измеряя в крови не только ОТ, но и уровень лютеинизирующего гормона, а также уровень глобулина, связывающего половые гормоны (ГСПГ), с последующим расчетом уровня свободного тестостерона [8]. Известно, что модуляции уровня ГСПГ в крови могут менять содержание свободного биологически активного тестостерона в крови, что закономерно будет изменять выраженность его эффектов на уровне тканей-мишеней. Так, нами ранее было показано, что у молодых мужчин с метаболическим синдромом уровень ГСПГ снижается, что приводит к повышению уровня свободного тестостерона и нивелирует снижение содержания ОТ в крови [9].
Диапазон нормального значения уровня ОТ в сыворотке крови, рекомендуемый ISSAM, составляет 12–35 нмоль/л, однако при назначении гормональной заместительной терапии препаратами тестостерона стоит учитывать средний показатель величины ОТ по нескольким определениям, что может характеризоваться как «персональная норма» в отсутствие клинических симптомов гипогонадизма, позволит прогнозировать и контролировать эффективность заместительной терапии.
Мужчинам, у которых имеются клинические симптомы дефицита андрогенов, но лабораторные данные при первичной диагностике противоречивы, может быть рекомендована «пробная» терапия короткодействующими формами тестостерона в течение 1–3 месяцев. Рекомендовать многократное лабораторное исследование тестостерона сыворотки крови у мужчин в рутинной практике нецелесообразно, т.к. это может привести к снижению лояльности и мотивации пациента на лечение в связи с многократными болезненными процедурами забора крови из вены и значительными затратами временных и финансовых ресурсов. При этом следует учитывать, что лабораторные данные по содержанию ОТ необходимы для оценки эффективности проводимой терапии препаратами тестостерона. Известно, что при использовании короткодействующих гелевых форм тестостерона его уровень в сыворотке крови должен изменяться уже через 2–8 часов. На фоне проводимой гормонозаместительной терапии тестостероном уровень сывороточного тестостерона снижаться не должен [10], что можно учитывать при оценке правильного использования лекарственного препарата. Если имеется положительная динамика клинических симптомов на фоне проводимой терапии, лечение целесообразно продолжать. В случае неадекватного ответа на терапию или отсутствия положительной динамики, гормонозаместительную терапию тестостероном следует прекратить и провести комплексное дообследование пациента для выявления иных причин низкого уровня тестостерона.
Имеющиеся данные по определению «индивидуальной» нормы тестостерона недостаточны, но отмеченные тенденции при исследовании индивидуальных средних значений обосновывают необходимость продолжать исследования в этом направлении, что позволит повысить точность постановки диагноза «гипогонадизм» и эффективность персонализованного лечения.


