Понятие о функциональной диспепсии
Функциональная диспепсия (ФД) является широко распространенным функциональным заболеванием желудочно-кишечного тракта (ЖКТ), характеризующимся гетерогенным паттерном клинических проявлений и существенным негативным влиянием на качество жизни больных [1, 2]. Согласно Римским критериям 3-го пересмотра (2006), под термином ФД понимают наличие одного и более симптомов у пациента – боль или жжение в эпигастрии, чувство переполнения в эпигастрии или раннее насыщение в отсутствие данных об органической патологии, способной объяснить эти симптомы [3].
Распространенность истинной ФД среди взрослого населения достигает 15–20% с ежегодным показателем заболеваемости в 1% [4, 5]. Эти данные в целом можно экстраполировать и на нашу страну со следующей оговоркой: лишь 5% больных получают квалифицированную медицинскую помощь [6].
В зависимости от превалирования в клинической картине тех или иных диспепсических жалоб выделяют два основных клинических варианта ФД [3]:
- синдром эпигастральной боли (СЭБ);
- постпрандиальный дистресс-синдром (ПДС).
СЭБ проявляется периодическими болями (как минимум умеренной интенсивности) в эпигастрии с частотой не менее одного раза в неделю. Боль негенерализованная, имеет четкую локализацию, не изменяется после дефекации и отхождения газов. Признаков нарушения функции желчного пузыря и сфинктера Одди не наблюдается. Дополнительными критериями служат жгучий характер боли без ретростернального компонента, связь болевого синдрома с приемом пищи или возникновение боли натощак, а также сопутствующий постпрандиальный синдром [2, 3].
К диагностическим критериям ПДС относятся возникающее несколько раз в неделю, беспокоящее больного чувство полноты (тяжести в эпигастрии) после еды при приеме обычного объема пищи и (или) чувство раннего насыщения, не дающее полноценно завершить прием пищи. Данные симптомы могут сопровождаться тошнотой, отрыжкой, ощущением вздутия в верхней части живота, эпигастральной болью или жжением [2, 3].
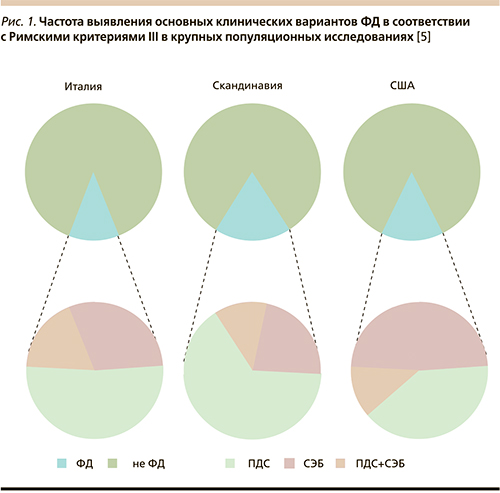
Следует сказать, что выделение данных подгрупп на основании критериев, предложенных Римскими критериями 3-го пересмотра, подтверждается популяционными исследованиями и вполне правомочно. Так, в крупных исследованиях в Италии, Скандинавии и США было обнаружено четкое разграничение между пациентами с СЭБ и ПДС. При этом перекрест (наложение) симптомов данных подтипов ФД оказался значительно ниже ожидаемого и не превысил 20% (рис. 1), что подтверждает правомочность такой стратификации [5]. В целом, согласно современным данным, превалирующей формой ФД является ПДС (45–65%), реже выявляются СЭБ (25–45%) и смешанная форма (10–15%) [2, 5].
Диагностика ФД на первичном этапе предполагает в первую очередь исключение органической причины явлений диспепсии. Многие органические, системные и метаболические заболевания, такие как язвенная болезнь, злокачественные новообразования ЖКТ и гепатобилиарной системы, паразитарные инвазии, хронические заболевания поджелудочной железы, сахарный диабет, гипо- и гипертиреоидизм, системная склеродермия, хроническая почечная недостаточность, электролитный дисбаланс, а также прием лекарственных препаратов (холинолитиков, спазмолитиков, трициклических антидепрессантов, антагонистов кальция и др.), могут вызывать симптомы диспепсии [7]. Важную роль на этом этапе играют не только рутинные лабораторные и визуализационные методы диагностики, но и клиническое выявление симптомов тревоги (дисфагия, рвота кровью, лихорадка, немотивированное похудание, возникновение симптоматики в возрасте старше 45 лет, мелена, гематохезия, анемия, лейкоцитоз, повышение СОЭ) – ориентиров органической патологии. В случае выявления последних пациенту независимо от возраста необходимо безотлагательное проведение эндоскопического исследования верхних отделов ЖКТ с прицельной биопсией и морфологическим изучением биопсийного материала [8]. Важно подчеркнуть, что, по современным рекомендациям, все пациенты старше 45 лет при наличии симптомов диспепсии должны пройти эндоскопическое обследование [9]. В случае обнаружения органической причины диспепсии устанавливается соответствующий диагноз, а в отсутствие таковых формулируется диагноз ФД (К30 Международная классификация болезней 10-го пересмотра).
Инфекция H. pylori как этиологический фактор ФД
Несмотря на существенные продвижения в области изучения механизмов, индуцирующих симптоматику ФД, к настоящему моменту единой этиопатогенетической модели формирования рассматриваемой патологии не существует. На текущий момент этиопатогенез ФД представляется как сложный многофакторный процесс, причинно-следственные связи которого продолжают активно изучаться. Наиболее вероятно, что комбинация ряда физиологических, генетических, средовых и психологических факторов у конкретного пациента ведет к развитию определенных комбинаций сенсорно-моторных нарушений ЖКТ и как следствие – к проявлению симптомов диспепсии [2, 8, 10].
Данные об участии в этиологии ФД инфекции H. pylori неоднозначны и противоречивы. Согласно различным источникам, микроорганизм выявляется у 39–87% пациентов с ФД и, как правило, в два раза чаще, чем в контроле [11, 12]. В настоящее время эпидемиологические исследования не позволяют достоверно устанавливать связь между инфекцией Н. pylori и ФД. Возможно, она и имеется, только не во всей популяции пациентов с данной патологией. В недавно завершенном крупном исследовании Y.J. Fang и соавт. (2014) было показано, что инфекция Н. pylori достоверно чаще ассоциирована с ПДС (отношение шансов [ОШ]=1,86, 99,5% доверительный интервал [ДИ] – 1,01–3,45) по сравнению с СЭБ (ОШ=1,43, 99,5% ДИ – 0,72–2,84). При этом частота выявления наиболее вирулентных штаммов (CagA+ – cytotoxin-associated gene) при ПДС была также достоверно выше, достигнув 98,4% [13].
Теоретически инфекция H. pylori может вызывать диспепсические симптомы через реализацию ряда механизмов:
- изменение секреции (гиперхлоргидрия) соляной кислоты в желудке и связанное с ней повышение сенситивности рецепторного аппарата в интерстиции;
- вторичное нарушение моторной функции желудка;
- персистирующее и активное воспаление, выходящее за пределы слизистой оболочки желудка;
- постинфекционные изменения, связанные с активацией иммунокомпетентных клеток в гастродуоденальной слизистой оболочке и интерстиции.
На сегодняшний день показано, что максимальный уровень соляной кислоты в желудке (МАО – maximal acid output), выделение которой индуцирует гастрин-рилизинг пептид, в 3 раза выше у пациентов с инфекцией H. pylori по сравнению с неинфицированными лицами [14]. При этом у половины пациентов, инфицированных H. pylori с признаками ФД, имеются эквивалентные значения МАО с больными язвенной болезнью двенадцатиперстной кишки. Инфекция H. pylori стимулирует продукцию гастрина и уменьшает синтез соматостатина, реализуя повышение секреции соляной кислоты. Помимо этого инфекция изменяет продукцию грелина, который участвует в секреции кислоты, синтезе ощущений голода и регуляции желудочно-кишечной перистальтики [15]. Обращает на себя внимание, что эти изменения секреции соляной кислоты нормализуются через 6–12 месяцев после успешной эрадикации H. pylori [16]. Таким образом, если бы диспепсические жалобы были связаны исключительно с повышенной секрецией соляной кислоты, то их нивелирование после успешной эрадикации H. pylori происходило бы не ранее чем через 6 месяцев.
Существуют следующие данные: инфекция H. pylori может замедлять эвакуаторную функцию желудка за счет инактивации III фазы мигрирующего моторного комплекса (циклическая, стереотипно повторяющаяся сократительная активность желудка в межпищеварительный период), при этом эрадикация микроорганизма приводит к нормализации сократительной активности желудка [17]. Однако крупными исследованиями такие ассоциации пока не подтверждены. Скорее всего, роль инфекции H. pylori в генезе ФД может реализовываться через ряд комплексных воспалительных механизмов, однако данных о таких взаимосвязях к сегодняшнему дню явно недостаточно.
Таким образом, накопленные на сегодняшний день данные не дают основания считать инфекцию H. pylori абсолютным этиологическим фактором ФД. Однако на основании ряда мета-анализов, демонстрирующих небольшой, но статистически значимый положительный эффект в купировании симптоматики после эрадикации инфекции (см. ниже), проведение эрадикационной терапии может быть обоснованным, особенно в регионах с высокой инфицированностью H. pylori, к которым относится и Россия. В этом случае оправданна стратегия «test and treat», когда производится неинвазивное определение H. pylori и последующая эрадикация микроорганизма [18, 19].
Лечение
В современных российских и европейских рекомендациях по лечению ФД на основании принципов доказательной медицины отражено три фармакотерапевтических направления терапии данной патологии [7, 9, 20]:
- эрадикация инфекции H. pylori;
- антисекреторная терапия;
- прокинетическая терапия.
Из перечисленных методик лечения частота ответа на терапию при лечении ФД прокинетиками составляет 42%, что выше по сравнению с другими способами: эрадикацией инфекции H. pylori (38%), антисекреторной терапией (34%) [21]. Однако нередко пациентам с ФД требуется комплексная терапия с применением всех вышеописанных методов [6, 8, 9].
Как уже говорилось выше, определенным доказательным базисом роли инфекции H. pylori в генезе ФД являются данные клинических исследований, демонстрирующих небольшой, но статистически значимый положительный эффект в купировании симптоматики ФД после эрадикации микроорганизма. Так, в Кокрановском мета-анализе было установлено, что эффективность эрадикации H. pylori на 10% (95% ДИ – 6–14) выше по сравнению с плацебо с показателем NNT (number needed to treat – число пациентов, которых необходимо пролечить, чтобы у одного пациента исчезли жалобы) – 14% (95% ДИ 10–25). При этом нивелирование симптоматики в конечном счете происходит почти в 40% случаев успешно эрадицированных больных [22]. Недавний мета-анализ B. Zhao и соавт. (2014 г), включивший более современные исследования (14 2993 пациента), подтвердил, что купирование симптоматики ФД возникает чаще после эрадикации H. pylori по сравнению с контролем (ОШ=1,38, 95% ДИ – 1,18–1,62; р<0,0001) без различий между популяциями пациентов Европы, США и Азии [23].
В соответствии с консенсусом Маастрихт-IV, в регионах с низкой резистентностью H. pylori к кларитромицину (менее 20%) в качестве эрадикационной терапии первой линии регламентируется стандартная тройная терапия, включающая ингибитор протонной помпы (ИПП), кларитромицин и амоксициллин. В регионах с высокой резистентностью H. pylori к кларитромицину (более 20%) в качестве эрадикационной терапии первой линии рекомендуется квадротерапия с препаратами висмута (ИПП+метронидазол+тетрациклин+висмута трикалия дицитрат) или последовательная эрадикационная терапия (первые 5 дней: ИПП+амоксициллин, последующие 5 дней: ИПП+кларитромицин+тинидазол/метронидазол). В случае неудачи проведенной эрадикации по схемам терапии первой линии экспертный совет консенсуса Маастрихт-IV регламентирует переход на схемы второй линии. Так, квадротерапия на основе препаратов висмута приоритетна для регионов с низкой распространенностью резистентных штаммов H. pylori к кларитромицину, а в качестве альтернативы выдвигается тройная терапия с левофлоксацином (ИПП+амоксициллин+левофлоксацин). Что же касается регионов с высокой резистентностью штаммов H. pylori к кларитромицину, то, согласно консенсусу Маастрихт-IV, терапией второй линии при неэффективности квадротерапии первой линии является тройная терапия с левофлоксацином (ИПП+амоксициллин+левофлоксацин) [24].
Хотя в настоящее время данных федерального уровня об антибиотикорезистентности H. pylori в России не существует, Российская гастроэнтерологическая ассоциация рекомендует использовать в качестве терапии первой линии стандартную тройную или квадротерапию с препаратами висмута. Последняя может применяться в качестве схемы терапии второй линии при неэффективности стандартной тройной схемы наравне с тройной терапией с левофлоксацином [25].
Контроль эффективности эрадикации H. pylori необходимо проводить каждому пациенту не ранее чем через 4 недели после окончания лечения [24, 26]. Важно отметить, что далеко не от всех больных возможно добиться 100%-ного успеха эрадикации, что определено не только ростом количества резистентных штаммов микроорганизма в популяции, а также вариативной генетической предиспозицией пациента к успешности лечения (полиморфизмы генов CYP2C19, MDR1, IL-1β) [27, 28]. Неэффективность схем первой линии обусловливает необходимость применения схем эрадикации второй линии. В свою очередь индивидуальный подбор препаратов на основании результатов тестирования резистентности H. pylori к антибиотикам показан только в случае неудачи двух линий эрадикационной терапии [24, 26, 27].
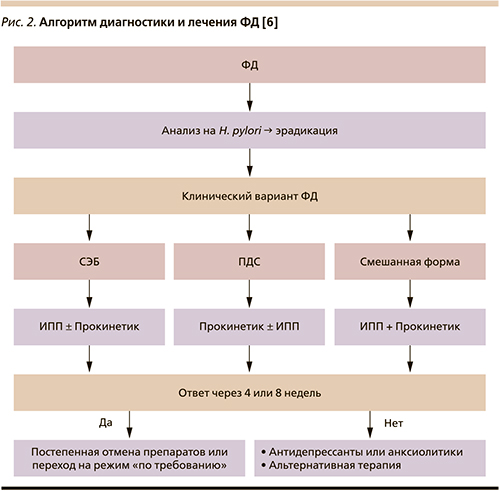
Дальнейший выбор медикаментозной терапии должен базироваться в зависимости от клинического варианта ФД [18, 21]. Так, при СЭБ препаратами выбора являются ИПП, а при ПДС – прокинетические. Эффективность обеих групп вышеназванных препаратов при ФД подтверждена мета-анализами, где выявлено статистически значимое превосходство по сравнению с плацебо [29, 30]. В случае смешанных и недифференцированных клинических вариантов ФД целесообразно использование комбинации ИПП и прокинетиков [18].
ИПП и прокинетики в современных алгоритмах терапии ФД назначают в стандартных дозировках продолжительностью основного курса от 4 до 8 недель (рис. 2). В случае успешной терапии рекомендуется постепенная отмена препаратов или переход на режим терапии «по требованию».
В отсутствие ответа на лечение пациентам с ФД целесообразно дальнейшее продолжение терапии антидепрессантами или анксиолитическими средствами.
Заключение
Таким образом, несмотря на существенные продвижения в области изучения механизмов, индуцирующих симптоматику ФД, к настоящему моменту единой этиопатогенетической модели формирования рассматриваемой патологии не существует. Данные об участии в этиологии ФД инфекции H. pylori противоречивы и на сегодняшний день не дают основания считать инфекцию H. pylori абсолютным этиологическим фактором ФД. Однако на основании ряда мета-анализов, демонстрирующих небольшой, но статистически значимый положительный эффект в купировании симптоматики ФД после эрадикации инфекции H. pylori, можно сделать следующий вывод: проведение эрадикационной терапии может быть обоснованным, особенно в регионах с высокой инфицированностью H. pylori, к которым относится и Россия. Данная позиция подтверждается современными национальными и зарубежными рекомендациями по лечению пациентов с ФД.


