Введение
В свете современных представлений о патогенезе эрозивно-язвенных состояний и рака желудка эрадикация инфекции H. pylori рассматривается как неотъемлемая часть лечения.
В схемы эрадикации входят как минимум два антибиотика и антисекреторный препарат – ингибитор протонной помпы (ИПП) [1]. Несмотря на увеличение длительности лечения до 10–14 дней, эффективность терапии продолжает снижаться в первую очередь из-за растущей резистентности к макролидам, фторхинолонам, даже – амоксициклину [2]. В связи с этим актуален поиск оптимальных стратегий эрадикации H. pylori.
Как способ повышения эффективности существующих схем эрадикации в качестве адьювантной терапии в международных и российских рекомендациях нашли отражение пробиотики и препараты висмута [3]. Опубликовано несколько исследований и мета-анализов, раскрывающих роль ребамипида в исходах лечения хеликобактерной инфекции. Ребамипид – мукопротектор, стимулирует образование слизисто-бикарбонатного барьера кишечной трубки широко применяется в Восточной Азии в качестве как моно-, так и комплексной терапии [4]. Ребамипид предотвращает образование повреждений и ускоряет репарацию слизистой желудочно-кишечного тракта за счет ингибирования активации нейтрофилов и стимулирования выработки простагландинов слизистой [5]. Доказано, что ребамипид уменьшает адгезию H. pylori к слизистой желудка и повышает вероятность эрадикации возбудителя [6]. С 2016 г. ребамипид под торговым названием Ребагит® зарегистрирован в Российской Федерации как гастро- и энтеропротективный препарат по показаниям: язвенная болезнь желудка, хронический гиперацидный и эрозивный гастрит, а также для профилактики повреждения слизистой желудочно-кишечного тракта нестероидными противовоспалительными препаратами. С учетом международного опыта применения ребамипида препарат рекомендован экспертами российской гастроэнтерологической ассоциации для лечения H. pylori-ассоциированных заболеваний [7]. Проведенное исследование БАСТИОН (исследование влияния препарата реБАмипид на эрадикацию и динамику репарации Слизистой оболочки у пациенТов с H. рylori-ассоциИрОваНными эрозивно-язвенными поражениями желудочно-кишечного тракта) направлено на уточнение роли ребамипида как стимулятора факторов защиты слизистой оболочки желудочно-кишечного тракта в клинико-лабораторных исходах хеликобактерной инфекции.
Данное исследование проведено с целью оценки влияния ребамипида на частоту достижения эрадикации H. pylori при использовании тройной 10-дневной схемы терапии с висмутом и динамику репарации слизистой желудка и двенадцатиперстной кишки у пациентов с H. pylori-ассоциированными эрозивно-язвенными поражениями.
В задачи исследования входило:
- определить эффективность «классической» (стандартной) терапии: 10 дней тройной терапии (омепразол, кларитромицин, амоксициллин, ОКА);
- определить эффективность «усиленной» терапии: 10 дней ОКА, усиленной препаратом висмута (омепразол, кларитромицин, амоксициллин, висмута трикалия дицитрат, ОКАВ);
- оценить эффективность «усиленной» терапии в сочетании с ребамипидом: 10 дней ОКАВ в сочетании с ребамипидом (ОКАВР);
- сопоставить клиническую эффективность и частоту развития нежелательных явлений на фоне различных схем эрадикации;
- определить влияние ребамипида на динамику дефектов слизистой оболочки у пациентов с H. pylori-ассоциированными эрозивно-язвенными поражениями желудка и двенадцатиперстной кишки при проведении 3-недельной постэрадикационной монотерапии ребамипидом.
Данное исследование было рандомизированным контролируемым открытым сравнительным. Процедура рандомизации осуществлена врачом по принципу простой последовательности распределения пациента в одну из трех групп лечения. Исследование проведено в соответствии с принципами Хельсинкской ддекларации Всемирной медицинской ассоциации (в редакции 2008 г.), Правилами качественной клинической практики международной конференции по гармонизации (ICH GCP), этическими принципами, изложенными в Директиве Европейского Союза 2001/20/ЕС, и с требованиями российского законодательства. Все использованные медикаменты назначались по показаниям и в режимах дозирования, утвержденных официальной инструкцией по применению препаратов в России. Клиническое исследование проведено в соответствии с Протоколом, утвержденным локальным этическим комитетом. Конечной точкой в оценке эффективности лечения считали эрадикацию H. pylori, доказанную двумя методами диагностики инфекции. Суррогатными критериями в оценке терапии были клинико-лабораторные показатели течения заболевания.
Материал и методы исследования
Шестьдесят амбулаторных пациентов обоего пола в возрасте от 18 до 60 лет с H. pylori-ассоциированными эрозивно-язвенными поражениями желудка и двенадцатиперстной кишки на основании верифицирующей методики – эзофагогастродуоденоскопии. Инфекция H. pylori верифицирована положительными результатами двух методов диагностики – 13С-уреазным дыхательным тестом и уреазным тестом с гастробиоптатами. Все пациенты подписали информированное согласие на участие в программе. На каждого пациента заполнялась специально разработанная индивидуальная регистрационная карта.
Критерии включения в исследование:
- мужчины и женщины в возрасте от 18 до 60 лет;
- пациенты, подписавшие информированное согласие на участие в исследовании;
- эндоскопическая верификация эрозивно-язвенных поражений желудка и двенадцатиперстной кишки;
- наличие инфекции H. pylori, подтвержденное двумя методами: быстрым уреазным тестом с гастробиоптатами и 13С-уреазным дыхательным тестом.
Критерии исключения:
- осложненная язвенная болезнь;
- эрозивный эзофагит;
- пациенты, ранее получавшие антимикробную терапию для эрадикации H. pylori;
- пациенты, получавшие антибиотики группы макролидов в течение года, предшествовавшего данному исследованию, или любые антибактериальные препараты на момент включения в исследование;
- продолжающийся прием нестероидных противовоспалительных препаратов (НПВП);
- пациенты, ранее получавшие мизопростол или ребамипид для лечения данного обострения;
- участие в любых клинических исследованиях в течение 6 месяцев до включения в данный протокол наблюдения.
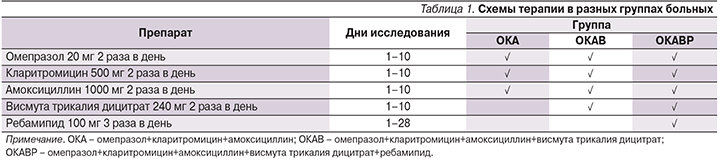
После выполнения эндоскопического исследования и подтверждения хеликобактерной инфекции в рамках рутинной клинической практики пациенты оценивались на соответствие критериям включения и отсутствие критериев исключения для участия в исследовании. Пациенты случайным методом распределены в одну из трех групп. Первая группа получала стандартную «классическую» трехкомпонентную терапию в течение 10 дней по схеме: омепразол 20 мг, кларитромицин 500 мг и амоксициллин 1000 мг – все препараты 2 раза в день (ОКА). Пациенты второй группы помимо 10-дневной стандартной триплексной терапии в течение всего курса принимали висмута трикалия дицитрат 240 мг 2 раза в день (ОКАВ). Третья группа пациентов получала стандартную трехкомпонентную терапию, висмут трикалия дицитрат вместе с ребамипидом 100 мг 3 раза в день (ОКАВР) (табл. 1).
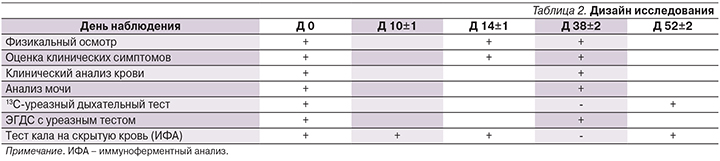
Все пациенты обследованы по единому протоколу независимо от схемы лечения (табл. 2). Точкой отсчета был принят первый день начала приема комплексной схемы эрадикации (Д 1). Оценка по заданным параметрам проведена сразу после окончания курса антибиотиков (Д 10), через 4 дня от момента окончания приема антибиотиков (Д 14), через 4 недели (Д 38) и через 6 недель (Д 52) после окончания антибактериальной терапии.
Для выявления H. pylori до лечения и контроля эрадикации применено два метода. Всем больным по стандартизованной методике выполнен неинвазивный метод диагностики – 13С-уреазный дыхательный тест с мочевиной 99%-ного обогащения [8]. Тест выполнен до начала терапии и через 6 недель после окончания лечения антибиотиками (на 24-й день отмены ребамипида для исключения влияния препарата на чувствительность метода). Динамика содержания в выдыхаемом воздухе СО2 и соотношение 13С/12С стабилизированных изотопов определены с помощью инфракрасного спектрометра IRIS (Kibion/Wagner, Швеция/Германия). Также всем пациентам проведена инвазивная диагностика инфекции – эзофагогастродуоденоскопия с забором биоптатов из антрального отдела и тела желудка для последующей оценки уреазной активности (экспресс-тест для определения уреазной активности H. рylori в биоптате, планшет с индикаторным гелем для образца производства компании Biohit, Финляндия).
На основании индивидуальных карт пациентов была сформирована база в программе Excel, 2010. Информация была закодирована в биноминальной и количественной шкалах. Статистическая обработка данных проведена с помощью программного обеспечения SPSS-19 и Medcalc с использованием следующих пакетов: частотный анализ, проверка гипотезы о нормальном распределении в выборке, сравнение средних значений (t-критерий Стьюдента, хи-квадрат Пирсона и непараметрический тест Манна–Уитни), корреляционный анализ (корреляция Пирсона для нормального распределения, корреляция Спирмена для ненормального распределения). Графика выполнена с помощью программ SPSS-19 и Excel. Нулевая гипотеза, будто различия между группами случайны, могла быть отвергнутой при значении вероятности ошибки р<0,05. Такой результат в данном исследовании считался достоверным.
Результаты
Отбор пациентов в протокол исследования проведен в амбулаторных условиях среди больных, обратившихся к гастроэнтерологу с жалобами на дискомфорт в эпигастрии, диспепсические явления и абдоминальный болевой синдром. Всем пациентам в рамках рутинной клинической практики проведено эндоскопическое исследование пищевода, желудка и двенадцатиперстной кишки (ДПК) для выявления дефектов слизистой оболочки: эрозий, язв и/или рубцово-язвенной деформации.
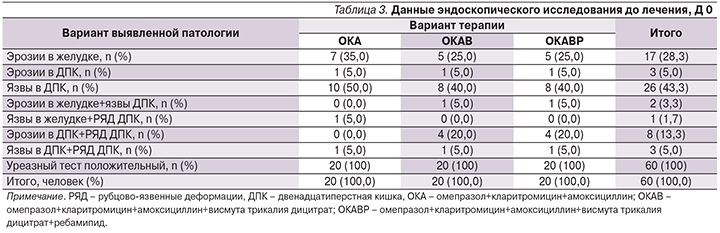
В исследование включены 60 пациентов. У всех пациентов до начала исследования проведен 3-кратный анализ кала на скрытую кровь (ИФА на наличие в кале неизмененного или измененного гемоглобина и гемоглобин/гаптоглобинового комплекса). Для всех пациентов на фоне эрозивно-язвенного поражения тест оказался положительным, что свидетельствовало о скрытой кровопотере. При эндоскопическом исследовании чаще диагностировали язвы ДПК – более чем в 40% случаев, и эрозии слизистой оболочки желудка – у 28% больных. Независимо от характера выявленных повреждений слизистой оболочки желудка и кишки пациенты рандомизировались в три группы лечения. Данная закономерность прослежена во всех трех группах лечения (табл. 3).
Из 60 участников исследования 49 – женщины (81,6%) и 11 (18,4%) – мужчины. Средний возраст пациентов составил 40,98±13,05 года. Все пациенты, включенные в исследование, закончили курс лечения, согласно протоколу. По завершении приема антибиотиков всем повторно был выполнен 3-кратный анализ кала на скрытую кровь. В 100% случаев тест оказался отрицательным на 10-й день и все последующие дни, в которые было запланировано проведение теста.
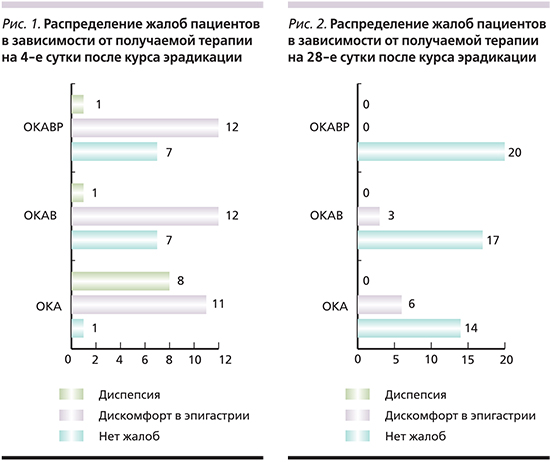
Схема эрадикационной терапии практически всегда вызывает нежелательные явления, в большей степени связанные с прокинетическим эффектом макролидного антибиотика кларитромицина [9]. Поэтому клиническая оценка эффективности терапии проведена не в день окончания антибактериальной терапии, а на 14-е сутки от начала исследования. На 4-е сутки после окончания курса антибиотиков со стороны 25% пациентов жалобы отсутствовали. При этом в группе больных, принимавших «классическую» трехкомпонентную схему терапии, только у одного пациента отмечено полное купирование клинической симптоматики, в то время как в двух других группах жалобы отсутствовали у семи пациентов в каждой группе. Дискомфорт в эпигастральной области отметили 35 (58,3%) пациентов. Частота встречаемости данного симптома не различалась во всех трех группах. Диспепсия сохранены у 10 (16,7%) пациентов, причем 8 из них лечились классической трехкомпонентной терапией (рис. 1). С учетом характера распределения симптомов статистической достоверности различий получить не удалось.
Несмотря на подписанное информированное согласие, разъяснение всех деталей протокола, 12 пациентов отказались выполнять контрольное эндоскопическое исследование, мотивируя хорошим самочувствием. На 28-е сутки после окончания антимикробной терапии 48 пациентам было выполнено контрольное эндоскопическое исследование, результаты которого суммированы в табл. 4.
При сравнении динамики эндоскопических проявлений заболевания выявлены различия в эффективности схем, включивших цитопротективный препарат, по сравнению с классической трехкомпонентной терапией. В обоих случаях в группах ОКАВ и ОКАВР выявлены достоверные различия по сравнению с ОКА группой пациентов по непараметрическому хи-квадрату с поправкой Фишера (χ2 Пирсона=4,91, р=0,049). По влиянию на репарацию слизистой между группами ОКАВ и ОКАВР различий выявлено не было. На данном этапе статистический анализ эффективности эрадикации не проведен.

Через 4 недели после окончания курса эрадикации (Д 38) у 51 (85%) пациента из 60 пролеченных жалобы отсутствовали. В группе ОКАВР, получавших ребамипид, жалобы не предъявил ни один пациент. В группе ОКАВ дискомфорт в эпигастральной области сохранен у 3 (15%) пациентов, среди пациентов, получающих терапию ОКА, – у 30% (рис. 2). При сравнении динамики жалоб на 28-й день от момента окончания терапии в группах классической трехкомпонентной терапии и трехкомпонентной терапии с висмутом достоверных различий получено не было (χ2 Пирсона=1,29, р=0,45). Однако при сравнении классической терапии со схемой, включившей ребамипид, выявлены достоверные различия в эффективности купирования симптоматики в группе с ребамипидом (χ2 Пирсона=7,06, р=0,02).
Переносимость режимов эрадикации достоверно не различалась среди разных вариантов лечения. Все пациенты завершили курс терапии, согласно протоколу. Контроль эрадикации H. pylori неинвазивным 13С-уреазным тестом был проведен на 52-й день от начала терапии (6 недель после окончания приема антимикробных препаратов), рис. 3.
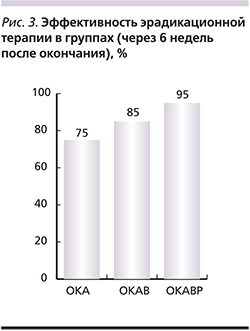 В группе пациентов, получавших классическую трехкомпонентную терапию (ОКА), эрадикация H. pylori оказалась эффективной только для 15 (75%) человек. В группе пациентов, получавших четырехкомпонентную терапию (ОКАВ), эрадикация H. pylori была эффективной для 17 (85%) пациентов (отношение шансов [ОШ)]=1,89; 95% доверительный интервал [ДИ] – 0,38–9,27). В группе пациентов, получавщих ребамипид, эрадикация H. pylori была эффективной для 19 (95%) больных (ОШ=6,33; 95% ДИ – 0,67–60,17 против ОКА и ОШ=3,35; 95% ДИ – 0,32–35,37 против ОКАВ).
В группе пациентов, получавших классическую трехкомпонентную терапию (ОКА), эрадикация H. pylori оказалась эффективной только для 15 (75%) человек. В группе пациентов, получавших четырехкомпонентную терапию (ОКАВ), эрадикация H. pylori была эффективной для 17 (85%) пациентов (отношение шансов [ОШ)]=1,89; 95% доверительный интервал [ДИ] – 0,38–9,27). В группе пациентов, получавщих ребамипид, эрадикация H. pylori была эффективной для 19 (95%) больных (ОШ=6,33; 95% ДИ – 0,67–60,17 против ОКА и ОШ=3,35; 95% ДИ – 0,32–35,37 против ОКАВ).
Обсуждение
Более 30 лет идет поиск оптимальной стратегии эрадикации H. pylori. Основным фактором, влияющим на эффективность классических схем с макролидными антибиотиками, считается чувствительность H. pylori к кларитромицину [10]. Несмотря на неуклонный рост резистентности в мире, практически все режимы эрадикации включают кларитромицин [3]. Наиболее эффективной схемой на сегодняшний день служит одновременная терапия в течение 10–14 дней, включающая ИПП и три антибиотика (кларитромицин, амоксициллин и метронидазол) [1]. Однако применение максимальной терапии не только сопряжено с увеличением нежелательных явлений, но и неизбежно способствует формированию поли- и панрезистентных возбудителей других инфекций [4, 3]. К сожалению, даже одновременная терапия не гарантирует полной эрадикации H. pylori.
В настоящее время активно обсуждается включение в схемы эрадикации препаратов, стимулирующих факторы «защиты» слизистой оболочки желудка и двенадцатиперстной кишки [1, 11–13]. Добавление ребамипида и/или висмута трикалия дицитрата способствовало заживлению эрозий и язв у всех обследованных больных, в то время как при лечении без цитопротективных препаратов у 17% больных через 4 недели после окончания терапии сохранились эрозии в двенадцатиперстной кишке. Различия по влиянию добавления цитопротокторов в схемы эрадикации достоверны.
Включение ребамипида в схему эрадикации H. pylori с последующим приемом ребамипида в течение 18 дней достоверно привело к улучшению клинической симптоматики по сравнению с классической трехкомпонентной терапией. Возможно, что этот эффект связан с доказанной способностью ребамипида уменьшать воспаление в слизистой оболочке желудка, уменьшать выраженность атрофических изменений желез желудка [14, 15]. В то же время статистический анализ показал, что добавление к классической терапии препарата висмута не оказало достоверного влияния на жалобы пациентов.
Ребамипид уникален по своему механизму действия препаратом. Он стимулирует синтез эндогенного простагландина Е2 (PGE2) в слизистой желудка и желудочном соке, улучшает кровоснабжение слизистой оболочки желудочно-кишечного тракта. Ребамипид усиливает барьерную функцию через стимуляцию пролиферации и выведения гидроксильных радикалов [16, 17]. Эффективность терапии оценивали по результатам 13С-уреазного дыхательного теста через 6 недель после окончания эрадикации. Для оценки влияния ребамипида на частоту достижения эрадикации в качестве сравнения нами были выбраны 2 схемы, рекомендованные российскими и международными согласительными документами: десятидневная классическая трехкомпонентная схема (ОКА) и схема, усиленная препаратом висмута (ОКАВ) [1, 3, 18]. Частота достижения эрадикации пациентами составила 75 и 85% соответственно. Такой результат терапии не удовлетворяет принятым стандартам эффективности – более 90% – и не может считаться удовлетворительным [3]. Низкая эффективность терапии, возможно, связана с высокой резистентностью (25%) в Санкт-Петербурге и доминированием быстрых метаболизаторов по цитохрому CYP2C19 среди европейцев [3, 4, 8]. В то же время эффективность эрадикационной терапии в группе пациентов, принимавших ребамипид, составила 95%. Таким образом, добавление к схеме лечения не только висмута, но и ребамипида позволило преодолеть 90%-ный порог эффективности. Полученные данные не противоречат результатам рандомизированных контролируемых исследований и мета-анализа. В ранее опубликованных работах показано, что добавление ребамипида к ИПП и антибиотикам достоверно повышает вероятность достижения эрадикации (отношение шансов составило 1,74 (95% доверительный интервал – 1,19–2,53) [5].
Ребамипид не обладает антибактериальным эффектом и не влияет на продукцию уреазы хеликобактером. Повышение эффективности эрадикации объясняется способностью ребамипида блокировать адгезию H. pylori к эпителию желудка [19, 20]. Доказана способность препарата блокировать пути сигнальной трансдукции, задействованного в активации синтеза интерлейкина-8 [14–16]. В исследовании in vivo лечение ребамипидом после окончания курса эрадикации существенно снижалась экспрессия интерлейкина-8 и фактора некроза опухоли альфа. Этот эффект впервые был доказан в экспериментах ученых в токийской муниципальной исследовательской лаборатории. В эксперименте in vitro ребамипид доказал дозозовисимое уменьшение H. pylori-индуцированной токсической зернистости нейтрофилов [21]. Кроме того, ребамипид способствует элиминации свободных радикалов, подавляет супероксиды, продуцируемые полиморфноядерными лейкоцитами и нейтрофилами в присутствии H. pylori, и снижает выработку интерлейкина-8 в ответ на H. pylori [22–24].
Выводы
Добавление ребамипида к эрадикационной терапии (стандартные дозы ИПП, кларитромицин, амоксициллин и висмут) и пролонгация лечения ребамипидом в течение последующих 18 дней способствуют купированию клинической симптоматики и повышают частоту восстановления слизистой оболочки желудка и двенадцатиперстной кишки по сравнению со стандартной трехкомпонентной схемой, включающей ИПП, кларитромицин и амоксициллин.
У всех пациентов, получавших дополнительную терапию ребамипидом, через 4 недели после завершения курса антибиотиков и ИПП отсутствовали жалобы со стороны желудочно-кишечного тракта, в то время как среди больных, получавших трех- или четырехкомпонентную терапию без ребамипида, жалобы сохранялись. Кроме того, добавление ребамипида к четырехкомпонентной эрадикационной терапии позволило достигнуть эффективной эрадикации 95% пациентов. Лечение стандартными трех- или четырехкомпонентными схемами терапии было эффективным в 75 и до 85% случаев соответственно, что не удовлетворяет принятым критериям эффективности эрадикационной терапии – более 90%.
Заключение
Таким образом, результаты данного исследования позволяют заключить:
- ребамипид – действенный гастропротектор, повышающий эффективность эрадикационных схем при H. pylori-ассоциированном гастрите, язвенной болезни желудка и двенадцатиперстной кишки. Таким образом, в свете современных представлений о патогенезе данных заболеваний ребамипид можно рассматривать как препарат для вторичной профилактики рецидивов;
- целесообразно использование ребамипида в постэрадикационный период для потенцирования репарации слизистой оболочки желудка и двенадцатиперстной кишки.


