За последние 20 лет в клинической практике отмечается увеличение частоты случаев инфекции Clostridium difficile в связи с активным применением антибиотиков широкого спектра действия.
Практически любой антибактериальный препарат может вызывать С. difficile-ассоциированную инфекцию. По всему миру регистрируется множество внутрибольничных инфекций, вызванных С. difficile. В США на их долю приходится до 90 % всех случаев заражений при пребывании в стационаре (примерно 1 больной гастроэнтеритом С. difficile на 1000 госпитализированных) От 3 до 6 % здоровых людей являются носителями токсигенных клостридий, однако количество С. difficile в составе нормальной микрофлоры кишечника здорового человека не превышает 0,01–0,001 %. При приеме антибиотиков может происходить угнетение нормальной флоры и рост колонизации кишечника клостридия-
ми до 15–40 % [1–6].
Клиника заболевания варьируется от легкой диареи до угрожающих жизни заболеваний – псевдомембранозного колита и токсического мегаколона, возможно развитие бактерионосительства. Иногда псевдомембранозный колит протекает без диареи, что приводит к запоздалой диагностике и развитию тяжелых осложнений. Вероятность летального исхода диареи, вызванной гипервирулентным штаммом С. difficile, колеблется от 6 до 12 %. В некоторых случаях в самом начале болезни при появлении диареи на фоне антибиотикотерапии ее отмена может быстро приводить к обратному развитию симптомов заболевания [5–7].
Патогенное действие С. difficile опосредованно энтеротоксином А (308 kDa) и цитотоксином В (270 kDa), которые являются главными факторами патогенности возбудителей. Токсин А – это летальный энтеротоксин, обусловливающий кровоизлияния и секрецию жидкости в кишечнике, а токсин В – это цитотоксин, обладающий цитопатическим эффектом в культуре ткани. Оба токсина модифицируют RAS-подобные протеины эукариотических клеток, разрушают клеточные мембраны, актиновый
аппарат клетки и синтез протеинов, стимулируют секрецию жидкости, увеличивают проницаемость кишечной стенки, нейтрофильную инфильтрацию и воспаление, активируют провоспалительные цитокины – лейкотриен В4, простагландин Е2, фактор некроза опухоли α, интерлейкин-8. Именно эти токсины рассматриваются в качестве ключевых компонентов для создания диагностических, лечебных и профилактических препаратов [8–12].
Тяжесть инфекции, вызванной С. difficile, во многом определяется активностью иммунного ответа человека на возбудитель и, в частности, на его токсины. Показано, что повышение титров антител к токсину А сопровождается снижением патогенности С. difficile и повышает вероятность бессимптомного носительства [13, 14].
Факторами риска антибиотико-ассоциированного колита (ААК) являются продолжительное пребывание в стационаре, особенно в одной палате с носителями С. difficile, возраст (менее 6 лет или более 65 лет), заболевания органов пищеварения, угнетение иммунной системы, предшествующий
дисбиоз кишечника. Даже однократный прием антибиотика широкого спектра действия может приводить к развитию ААК и псевдомембранозного колита вне зависимости от дозы и способа введения. В 80 % случаев симптоматика развивалась в течение трех дней с момента применения препарата [2–6].
Особенностью инфекции С. difficile являются ее частые рецидивы – в среднем в 20–25 % случаев, причиной которых являются сохранившиеся в кишечнике споры С. difficile или повторное заражение. Возникновение рецидива связано с уменьшением в плазме крови концентрации антител иммуноглобулина G к токсину А и уменьшением числа клеток слизистой оболочки толстого кишечника,
секретирующих иммуноглобулин A [14, 15].
В лечении рожи широко применяются антибактериальные препараты, часть из них может оказывать негативное влияние на кишечную флору. Кроме того, еще до поступления в стационар больные рожей могут иметь в составе кишечной флоры различные клостридии или возбудителей традиционных кишечных инфекций (шигелл, сальмонелл, иерсиний и др.), попавших в организм с пищевыми продуктами или водой, даже без явных клинических признаков кишечной инфекции (транзиторное носительство, субклинический вариант течения). В этих случаях на фоне антибиотикотерапии рожи возможно усиление дисбиоза и даже развитие антибиотико-ассоциированной диареи.
Выявление токсинов возбудителей в организме больных представляет значительные трудности, методики их определения (в частности, хроматографический метод) не входят в стандартный спектр таковых обследования пациентов и недостаточно чувствительны [16, 17].
Ввиду сложности бактериологической диагностики клостридиальных и других кишечных инфекций в обычной клинической практике исследование эндотоксинов возбудителей кишечных инфекций и их токсинов в качестве показателей дисбиоза кишечника у больных рожей на фоне антибактери-
ального лечения не проводилось.
Как мы показали в ранее проведенных исследованиях, присутствие токсинов клостридий у больных значительно усиливает проявления интоксикационного синдрома и утяжеляет течение острых кишечных инфекций (ОКИ). Кроме клостридиальных токсинов другим важным токсином, вырабатываемым кишечной флорой, является Шига токсин (ШТ), это наиболее широко распространенный токсин представителей семейства Enterobacteriaceae, а также некоторых других видов бактерий, он является важным фактором патогенности бактерий, обитающих в кишечнике.
Обнаружение его маркера (антигена) наряду с выявлением специфических О-антигенов шигелл, сальмонелл, йерсиний и кампилобактерий свидетельствует о присутствии в кишечнике патогенных бактерий и дисбиозе [17–19].
Целью работы стала оценка дисбиоза кишечника на основании выявления О-антигенов и маркеров токсинов А, В С. difficile и ШТ у больных рожей на фоне антибиотикотерапии основного заболевания.
Материал и методы
Обследованы 78 больных эритематозно-геморрагической и буллезно-геморрагической рожей конечностей и лица (45 – первичная рожа, 33 – рецидивирующая рожа). У 32 больных были выявлены сопутствующие заболевания, как правило, сопровождавшиеся иммунодефицитным состоянием (цирроз печени, язвенная болезнь, сахарный диабет, ожирение, хронический бронхит и др.). У 46 больных сопутствующих заболеваний не было.
Антибактериальное лечение больных осуществлялось с применением бензилпенициллина (6–12 млн ЕД/сут внутримышечно в течение 10 дней) или (по показаниям) цефалоспорина 1-го поколения цефазолина (3–6 г/сут внутримышечно в течение 10 дней), линкомицина (1,5–2,0 г/сут перорально в течение 10 дней) или гентамицина (240 мг/сут внутримышечно в течение 7 дней).
Антигены токсинов А и В С. difficile, а также ШТ определены в реакции коагглютинации на планшете в негре-тых, осветленных центрифугированием копрофильтратах с использованием соответствующих диагностикумов. Исследование копрофильтратов на присутствие О-антигенов возбудителей кишечных инфекций (шигелл Зонне, Флекснера, Ньюкастл, сальмонелл В-, С1-, С2-, Д-, Е-серогрупп, йерсиний псевдотуберкулеза 1 и 111 серотипов, йерсиний энтероколитика О3, О7, 8, О9, кампилобактерий – Campylobacter jejuni, Campylobacter coli, Campylobacter lari) проведено в реакции коагглютинации на стекле в гретых, осветленных центрифугированием копрофильтратах со специфическими антительными диагностикумами (разработаны и изготовлены в НИИЭМ
им. Н.Ф. Гамалеи) [20–23].
Контрольную группу составили 60 практически здоровых лиц. Статистическая обработка проведена
с использованием параметрических (t-критерий Стьюдента) и непараметрических (χ2) критериев на IBM PC (Biostatistica).
Результаты и обсуждение
В контрольной группе здоровых лиц О-антигены различных возбудителей ОКИ и маркеры токсинов С. difficile в кале не выявлены, а маркер ШТ (антиген) найден в 11 % случаев в титрах не выше 1 : 4 (lg10 обратного титра антигена токсина ≤ 0,602).
В копрофильтратах больных рожей ШТ А и В С. difficile в условном титре более 1 : 8 выявлены среди 72,5 % больных, ШТ – среди 45 % (р ≤ 0,05). При этом у 20 % больных определены в высоких титрах (≥ 1 : 250) маркеры токсинов А и В С. difficile и маркер ШТ (≥ 1 : 64).
У повторно обследованных больных (50 человек) уровни маркеров токсинов А и В С. difficile, а также ШТ
оставались без изменений в динамике заболевания в 28 %, 30 и 18 % случаев соответственно; снижение титров отмечено в 30 %, 32 и 36 % соответственно, повышение – в 28 % 24 и 32 % соответственно; и лишь в 14 % случаев маркеры токсинов не были выявлены. В итоге к моменту выписки больных из стационара у 64 %, 66 и 28 % из них в кале присутствовали маркеры, вышеуказанных ток-
синов, причем у каждого третьего больного – в высоких титрах маркеры токсина А и В С. difficile, а в
18 % случаев – маркер ШТ в высоких титрах.
У больных первичной рожей в 1–3-й дни заболевания средние уровни маркеров токсинов А и В С. difficile (lg10 обратного титра антигена) составляли 1,404 ± 0,278 и 1,371 ± 0,269 нарастали до 1,648 ± 0,228 и 1,538 ± 0,221 к 4–6-му дням болезни и снова снижались до исходного уровня к 7–10-му дням болезни (1,433 ± 0,215 и 1,349 ± 0,219 соответственно). Динамика ШТ в целом повторяла тенденции изменения уровней маркеров токсинов С. difficile, несколько нарастая к 4–6-му дням с 1,0 ± 0,154 до 1,144 ± 0,174 и возвращаясь к уровню 1,0 ± 0,225 на 7–10-й дни болезни (рис. 1).
Рисунок 1. Динамика уровней маркеров токсинов кишечных бактерий в КФ у больных рожей (Lg10 обратного титра маркера токсина) (n=78).
У больных рецидивирующей рожей динамика уровней маркеров токсинов С. difficile была противоположна тенденциям, наблюдавшимся при первичной роже. У больных рецидивирующей рожей средние уровни токсинов А и В С. difficile в 1–3-й дни заболевания составляли 1,751 ± 0,297 и 1,505 ± 0,229 соответственно, затем снижались до 1,355 ± 0,279 и 1,08 ± 0,231 к 4–6-му дням болезни и снова нарастали к 10-му дню болезни до уровня 1,482 ± 1,336 и 1,091 ± 0,412 соответственно. Уровни ШТ в 1–3-й дни болезни составляли 0,301 ± 0,114 и были достоверно ниже, чем при первичной роже (р ≤ 0,004), затем они достоверно нарастали к 4–6-му дням до 1,455 ± 0,239 (р1-3 ≤ 0,05) и снижались к 10-му дню болезни до 0,151 ± 0,09 (р4-6 < 0,05).
О-антигены различных возбудителей кишечных инфекций были выявлены всего среди 75 % больных (при первичной роже – среди 70 %, при рецидивирующей роже – среди 76,7 %). При этом у 65 % больных одновременно с О-антигенами выявлены токсины А и В С. difficile и ШТ.
Больные, у которых рожа протекала на фоне сопутствующих заболеваний, имели в копрофильтратах больше О-антигенов и маркеров токсинов, чем больные без сопутствующей патологии. Так, у больных рожей с сопутствующими заболеваниями выявлено в среднем 2,06 О-антигена в пробе копрофильтрата, а в группе без сопутствующих заболеваний – 1,43. Нагрузка токсинами А и В С. difficile и ШТ в группе пациентов с сопутствующими заболеваниями составила 1,22, без сопутствующих заболеваний – 0,91 (рис. 2).
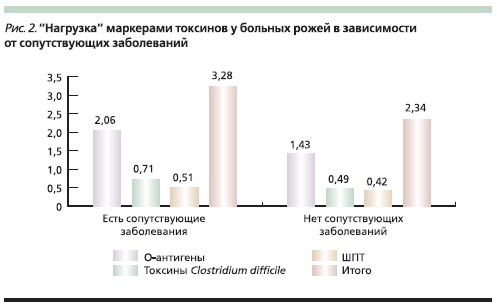
В динамике течения рожи у пациентов с сопутствующими заболеваниями уровни маркеров токсинов А и В С. difficile в кале в ходе заболевания нарастали в два раза чаще, чем у пациентов без сопутствующих заболеваний.
При исследовании влияния различных антибактериальных препаратов, применяемых в лечении рожи, был отмечен достоверный рост титров маркеров токсинов А и В С. difficile среди 27 % больных, леченных только с применением бензилпенициллина, среди 50 % больных, получавших цефазолин или гентамицин, и среди 11 % больных в случае лечения линкомицином.
При этом мы не отметили существенной разницы в частоте выявления роста титров клостридиальных
токсинов между больными первичной и рецидивирующей рожей. Как правило, направленность изменения титров токсина В С. difficile совпадала с таковой токсина А.
Маркер ШТ имел тенденцию к более частому достоверному росту его титров (≥ 1 : 4) при лечении бензилпенициллином (35,3 % больных), чем при лечении гентамицином или цефазолином (27,3 %, р ≥ 0,05).
В целом у 30 % больных рожей мы отметили рост титров маркеров ШТ и токсинов А и В С. difficile в динамике заболевания, что свидетельствовало о нарастании дисбиотических процессов в кишечнике.
Следует заметить, что в спектре биологической активности бензилпенициллина указываются спорообразующие анаэробные палочки, а линкомицина – клостридии. Полученные нами данные свидетельствуют, что назначение линкомицина при роже после проведенного курса лечения бензилпенициллином целесообразно не только с точки зрения элиминации L-форм стрептококка, но и для предупреждения возможных клостридиальных инфекций, развивающихся на фоне лечения в стационаре.
Таким образом, у значительного числа больных рожей при поступлении в стационар в копрофильтратах выявлены О-антигены различных возбудителей ОКИ и маркеры токсинов
клостридий и ШТ. Присутствие маркеров патогенной кишечной флоры – 0-антигенов возбудителей ОКИ, маркеров токсинов клостридий и ШТ свидетельствовало о дисбиозе кишечника у больных рожей, который был более выраженным у лиц с сопутствующими заболеваниями. Еще до применения антибактериального лечения среди значительного числа больных рожей выявлены маркеры токсинов А
и В С. difficile и ШТ в кале, в т. ч. в высоких титрах, однако их уровни не достигали таковых, характерных для больных ААК. В процессе проведения антибактериальной терапии отмечено достоверное нарастание уровня маркера токсина В С. difficile и некоторое нарастание продукции токсина А С. difficile. Однако это не сопровождалось клинически выраженными проявлениями колита, что может быть связано с относительно короткими курсами антибиотикотерапии и не столь высокими уровнями маркеров токсинов у больных рожей по сравнению теми, что наблюдаются у больных ААК и псевдомембранозным колитом. Как известно, возможность развития С. difficile-ассоциированных
заболеваний определяется взаимоотношениями самого возбудителя, уровня продуцируемого им токсина с факторами колонизационной резистентности индигенной микрофлоры [24].
Полученные данные позволяют отнести больных рожей, госпитализированных в стационар, к группе
риска возможного развития ААК, т. к. они, как мы установили, имеют лабораторные признаки субклинически протекающего дисбиоза кишечника. Представленные данные обусловливают необходимость своевременного выявления дисбиоза кишечника и проведения соответствующей корригирующей терапии пациентов данной группы, особенно с сопутствующими
заболеваниями, сопровождающимися иммунодефицитным состоянием (циррозом печени, язвенной болезнью, сахарным диабетом и др.), а также ставят вопрос о необходимости применения про- и пребиотиков в качестве поддерживающей терапии. Известно, что колит, диагностированный в ранней стадии, имеет благоприятный прогноз, симптомы быстро купируются, если антибиотикотерапия немедленно отменяется и проводится адекватная терапия. У пациентов с развившимися диареей и колитом после полного курса антибиотикотерапии, а также у тех, кому введение антибиотика продолжали, несмотря на диарею и колит, длительно сохранялась диарея с выраженным болевым синдромом и вероятностью летального исхода [6, 7, 10]. Полученные данные свидетельствуют о необходимости учитывать выявленные изменения микробиоценоза кишечника как при лечении рожи, так и при последующем наблюдении, и в случае проведения антибактериальной терапии (в т. ч. по поводу других заболеваний).
Примененная нами реакция коагглютинации с разработанными на основе натуральных и рекомбинантных антител диагностикумами в постановке на микропланшетах (учет результатов реакции через 12 часов) и предметных стеклах (учет через 0,5 часа) является быстрым и удобным методом выявления маркеров токсинов и О-антигенов возбудителей в копрофильтратах больных.
Выводы
1. Среди значительного числа больных рожей при поступлении в стационар в копрофильтратах выявлены О-антигены различных возбудителей ОКИ, маркеры токсинов А и В C. difficile, а также ШТ.
2. Отмечен достоверный рост титров антигенов токсинов А и В C. difficile в кале у половины из числа больных, получавших цефазолин или гентамицин, и у трети – бензилпенициллин.
3. Среди больных с сопутствующими заболеваниями при антибактериальной терапии отмечено достоверное нарастание продукции токсинов А и В C. difficile.


