Эпидемиология
Цереброваскулярные заболевания (ЦВЗ) являются важнейшей медико-социальной проблемой современной неврологии, поскольку дают самые высокие показатели по заболеваемости, смертности и инвалидности практически во всех странах мира. Так, в России ежегодно в среднем регистрируют около 400–450 тыс. инсультов (80–85 % ишемических), из которых до 200 тыс. заканчиваются летально, а из выживших пациентов не менее 80 % остаются инвалидами, несмотря на стремительное развитие медицинских технологий, сотни публикаций и диссертаций об эффективном лечении данной патологии [6]. Более того, в последние годы отмечается тенденция к увеличению частоты встречаемости инсультов у лиц молодого возраста [10]. Данная ситуация отрицательно сказывается на экономике страны и общественном настроении: требует огромных финансовых средств для лечения и реабилитации пострадавших, снижает качество жизни больных и их семей, способствует развитию массового пессимизма и депрессии.
Классификация
Цереброваскулярные заболевания разделяют на острые (инсульты и преходящие нарушения мозгового кровообращения – транзиторные ишемические атаки – ТИА) и хронические формы (хроническая ишемия мозга – “дисциркуляторная энцефалопатия”, сосудистая деменция). Такое разделение, естественно, носит условный характер, т. к. инсульт, как правило, развивается на фоне хронической ишемии мозга, т. е. является определенной стадией (промежуточной или завершающей) ЦВЗ. В основе хронических форм ЦВЗ лежит прогрессирующее многоочаговое, или диффузное, поражение головного мозга, клинически проявляющееся неврологическими, нейропсихологическими и/или психическими нарушениями.
В рамках Международной классификации болезней 10-го пересмотра (МКБ-10) классификация ЦВЗ проводится в связи с преимущественным поражением сосудистой системы мозга, что отражено в соответствующих рубриках: I 65 – “Закупорка и стеноз прецеребральных артерий, не приводящие к инфаркту мозга”, I 66 – “Закупорка и стеноз церебральных артерий, не приводящие к инфаркту мозга”, а также в зависимости от ведущего клинического синдрома в рубриках I 67 – “Другие цереброваскулярные болезни”: I 67.2 – церебральный атеросклероз, I 67.3 – прогрессирующая сосудистая лейкоэнцефалопатия, болезнь Бинсвангера; гипертензивная энцефалопатия (I 67.4), “другие уточненные поражения сосудов мозга: острая цереброваскулярная недостаточность, ишемия мозга хроническая” (I 67.8). Кроме того, выделяется сосудистая деменция – рубрика F 01 (F 01.0 – сосудистая деменция с острым началом, F 01.1 – мультиинфарктная деменция, F 01.2 – подкорковая сосудистая деменция, F 01.3 – смешанная корковая и подкорковая деменция), а также ряд неврологических синдромов, рассматриваемых в качестве последствий перенесенных ЦВЗ (рубрика I 69). В МКБ-10 термин “дисциркуляторная энцефалопатия” (ДЭ) отсутствует, однако в нашей стране он является наиболее часто используемым для обозначения различных клинических форм хронической недостаточности мозгового кровообращения.
Этиопатогенез
За редким исключением этиопатогенез ЦВЗ чрезвычайно сложен и включает комплексное взаимодействие многочисленных патогенных и лечебных факторов (климат, диета, физическая активность, черепно-мозговые травмы, вредные привычки, психологические, генетические особенности и др.).
Согласно ВОЗ, установлено свыше 300 факторов риска, связанных c инсультом, которые сведены к четырем категориям:
1. Основные модифицируемые факторы риска (высокое артериальное давление, атеросклероз, курение, гиподинамия, ожирение, нездоровая диета, диабет).
2. Другие модифицируемые факторы риска (социальный статус, психические расстройства, эмоциональное перенапряжение, злоупотребление алкоголем или наркотиками, определенные медикаменты).
3. Немодифицируемые факторы риска (возраст, наследственность, национальность, пол).
4. “Новые” факторы риска (гипергомоцистеинемия, васкулиты, анормальное свертывание крови).
Характерной чертой на сегодняшний день стало существенное “омоложение” артериальной гипертензии (АГ) и атеросклероза. Манифестация заболеваний атеросклеротического генеза стала часто встречаться даже в 30–40-летнем возрасте [10]. Не меньшее патогенетическое значение имеет характерное для значительных категорий населения состояние хронического психоэмоционального стресса, что в сочетании с нарушениями питания и беспорядочным образом жизни, а также неблагоприятными экологическими факторами приводит к раннему развитию изменений, типичных для старения мозга (ослаблению биосинтеза белков в нейронах головного мозга, нарушению проницаемости клеточных мембран, дестабилизации нейромедиаторных систем и т. д.) [8].
Главная “ось зла” в патогенезе цереброваскулярной патологии – эндотелиальная дисфункция и изменение реологических свойств крови, которые лежат в основе тромбообразования. Однако, несмотря на наличие универсальных закономерностей, процесс острой или хронической церебральной ишемии индивидуален и особенности его течения определяются компенсаторными возможностями мозгового кровотока, фоновым состоянием метаболизма мозга и реактивностью нейроиммуноэндокринной системы.
Компенсаторные и ауторегулирующие механизмы мозга в совокупности с гуморальными факторами гомеостаза столь мощны и биологически эффективны, что в каждый текущий момент времени могут обеспечивать адекватные энергетические потребности нервной системы и сохранять клиническое благополучие. Но когда наступает истощение этих механизмов, срыв ауторегуляции в условиях либо внезапного уменьшения просвета сосуда (тромбоз, эмболия), либо повреждения целостности сосудистой стенки, возникает клиническое событие – инсульт. Поэтому в современной неврологии господствует доктрина о динамическом характере и потенциальной обратимости церебральной ишемии и необходимости проведения неотложных мероприятий по восстановлению мозгового кровотока и защите мозга от ишемического поражения. Тем более изучены основные закономерности острейшего периода ишемического нарушения церебральной гемодинамики и показано, что ведущими звеньями возникающего при инсульте патологического каскада являются глутаматная “эксайтотоксичность” с активацией внутриклеточных ферментов и накоплением внутриклеточного Са2+, повышение синтеза оксида азота и формирование оксидантного стресса, развитие локальной воспалительной реакции, повреждение гематоэнцефалического барьера и внутримозговые микроциркуляторные нарушения [1].
Генетические факторы (латентные и пожизненные факторы риска) относятся к основным немодифицируемым факторам риска и получают все больше внимания в клинических исследованиях сосудистых заболеваний (использование данных генетического тестирования) [9]. Однако ассоциативные исследования между определенными генотипами и заболеваниями часто трудновоспроизводимы. Чрезвычайная сложность клеточных и молекулярных механизмов, опосредующих влияние молекулярных генов на физиологию человека, позволяет предполагать, что исследования ассоциаций генотип–фенотип будут иметь одно из самых низких соотношений сигнал/шум среди любых других видов эпидемиологических исследований типа случай–контроль. В самом деле патогенное влияние многих генетических факторов проявляется только при определенных условиях жизнедеятельности организма (курение, алкоголь, прием определенных медикаментов или наркотиков). Например, присутствие варианта Лейден увеличивает риск тромботических событий в 2,6 раза [5]. Когда же пациентки, имеющие данный нуклеотидный вариант гена F5 (или другие генетические дефекты, влияющие на свертываемость крови), принимают пероральные противозачаточные средства, риск синус-тромбозов возрастает почти в 30 раз, делая, таким образом, тромбоз синусов практически неизбежным [7]. В связи с этим все внешние факторы, такие как диета и образ жизни, теоретически могут быть правильно скорректированы для минимизации риска сосудистых заболеваний. Таким образом, генетические факторы предоставляют уникальную возможность составления индивидуальной долговременной профилактики ЦВЗ в соответствии с индивидуальными генетическими особенностями пациентов.
Несмотря на многочисленные факторы риска, различают следующие наиболее значимые клинико-патогенетические варианты хронических форм ЦВЗ:
• Атеросклеротический – характерно поражение крупных магистральных и внутричерепных сосудов по типу стеноза при развитости и сохранности коллатеральных путей кровообращения.
• Гипертонический – патологический процесс развивается в более мелких ветвях сосудистой системы головного мозга (субкортикальная артериосклеротическая энцефалопатия, энцефалопатия Бинсвангера – развитие лакунарных зон ишемии и тяжелых нейропсихологических нарушений с эпилептическим синдромом). При данном варианте часто развивается мультиинфарктная энцефалопатия – множественные, преимущественно лакунарные, мелкие инфаркты, возникающие на фоне АГ, при мелких кардиогенных эмболиях, ангиопатиях и коагулопатиях (антифосфолипидный синдром, васкулиты и т. д.).
• Кардиогенный – в развитии нарушений мозгового кровообращения патология сердца играет более значительную роль, чем предполагалось ранее. Так, кардиогенная тромбоэмболия сосудов мозга является причиной 15–20 % всех случаев возникновения ишемического инсульта. Не меньшее значение в развитии хронических форм поражения мозга имеют расстройства системной гемодинамики кардиального генеза. Они могут быть как причиной прогрессирующей глобальной ишемии мозга, так в условиях стенозирующего поражения мозговых сосудов приводить к развитию преходящей или стойкой очаговой ишемии мозга.
Клинические проявления
Начальными проявлениями ЦВЗ являются церебрастения (слабость, повышенная утомляемость, снижение умственной работоспособности), легкие когнитивные нарушения (снижение памяти, внимания, способности к обучению). Диагноз “начальные проявления недостаточности кровоснабжения мозга” устанавливается в соответствии с Классификацией сосудистых поражений головного и спинного мозга, разработанной НИИ неврологии РАМН, если у больного наряду с признаками общего сосудистого заболевания (АГ, атеросклероз) имеются жалобы на головную боль, головокружение, шум в голове, нарушение памяти, снижение работоспособности. Причем основанием для данного диагноза может быть сочетание двух и более из пяти перечисленных жалоб, которые должны отмечаться не реже одного раза в неделю на протяжении не менее трех последних месяцев. Поскольку данные жалобы носят не вполне специфический характер, такие больные длительный период наблюдаются врачами-терапевтами с диагнозом “синдром хронической усталости”, “последствия острого респираторного заболевания”, “хронический гастрит” и т. д.
При прогрессировании заболевания возникают двигательные расстройства (парезы, параличи), резкое снижение памяти, появляются преходящие церебральные сосудистые кризы, что существенно ограничивает трудоспособность и социальную адаптацию больных. Представление о ДЭ как о прогрессирующем сосудистом поражении головного мозга не всегда является правомерным. В клинической практике нередко встречаются пациенты с диагностически подтвержденной ДЭ различных стадий, неврологическое состояние которых многие годы и даже десятилетия остается стабильным.
В случае прогрессирования ЦВЗ возможно развитие сосудистой деменции, нарушение контроля функций тазовых органов, экстрапирамидного синдрома и других неврологических осложнений, приводящих к инвалидизации больных. Все неврологические нарушения часто группируют в пять основных синдромов: вестибулярно-атактический, пирамидный, амиостатический, псевдобульбарный, психопатологический. Иногда отдельно выделяют дисмнестический и цефалгический синдромы.
Одной из наиболее частых клинических разновидностей хронической мозговой недостаточности является вертебрально-базилярная сосудистая недостаточность. Ее причинами могут быть не только атеросклеротический стеноз позвоночных артерий, но и их деформация, врожденная гипоплазия, компрессия, вызванная патологией шейного отдела позвоночника и т. д. (рис. 1). Для данной клинической формы ЦВЗ характерны частые приступы головокружения, сопровождающиеся тошнотой, а иногда рвотой; шаткость походки; затылочные головные боли; снижение слуха, шум в ушах; снижение памяти; приступы “затуманивания” зрения, возникновение “пятен-мушек” в поле зрения; приступы внезапного падения, как правило, без потери сознания (“дроп-атаки”).
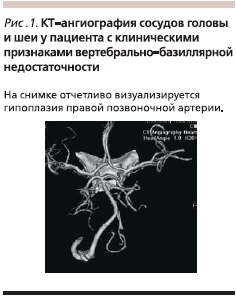
Вертебрально-базилярная сосудистая недостаточность нередко приводит к формированию псевдобульбарного синдрома, для которого характерны нарушения по типу дизартрии, дисфагии, дисфонии (голос становится тихим, монотонным), слюнотечение, снижение контроля функций тазовых органов и когнитивные расстройства. Эмоционально-аффективные расстройства (психопатологический синдром) наблюдаются на всех стадиях ЦВЗ: для ранних стадий характерны неврозоподобные, астенические и астенодепрессивные нарушения, затем к ним присоединяются дисмнестические и интеллектуальные расстройства. Причем депрессия отмечается у 25 % больных сосудистой деменцией и чаще возникает при субкортикальной локализации ишемических очагов [4].
В отечественной литературе выделяют три стадии хронической недостаточности мозгового кровообращения (ДЭ).
Для I стадии характерны астеноневротические расстройства, анизорефлексия, дискоординаторные явления, легкие глазодвигательные нарушения, симптомы орального автоматизма. Соответствует начальным проявлениям недостаточности кровоснабжения мозга.
Для II стадии характерны углубление нарушений памяти и внимания, нарастание интеллектуальных и эмоциональных расстройств, значительное снижение работоспособности, легкие подкорковые нарушения и нарушения походки (шаркающая, семенящая), более отчетливая очаговая симптоматика в виде оживления рефлексов орального автоматизма, центральной недостаточности лицевого и подъязычного нервов, координаторных и глазодвигательных расстройств, пирамидной недостаточности, амиостатического синдрома.
На III стадии возникают четко очерченные дискоординаторный, амиостатический, психоорганический, псевдобульбарный или пирамидный синдромы, наблюдаются пароксизмальные расстройства сознания (падения, обмороки, эпилептические припадки). На этой стадии заболевания больные нередко нуждаются в уходе, а иногда полностью дееспособны.
Диагностика, дифференциальная диагностика
В основе диагностики ЦВЗ лежит выявление клиническими и инструментальными методами (электро-, эхокардиография, холтеровское мониторирование, ультразвуковая допплерография магистральных, экстра- и интракраниальных сосудов, дуплексное сканирование, компьютерная томография, магнитно-резонансная ангиография, спиральная компьютерно-томографическая ангиография) отчетливой причинно-следственной связи между нарушением церебрального кровоснабжения и поражением головного мозга. Важно отметить, что грань между острыми и хроническими формами нарушения мозгового кровообращения весьма условна: причиной ДЭ и сосудистой деменции могут быть ишемические инсульты, обусловленные стенозом крупных мозговых сосудов и кардиогенными эмболиями. Сосудистая деменция в этом случае возникает либо из-за нескольких очагов, нередко в обоих полушариях головного мозга (мультиинфарктная деменция, рис. 2), либо из-за единичного ишемического очага в т. н. стратегической зоне (гиппокампе, таламусе, базальных отделах лобных долей). Существенную помощь в диагностике мультиинфарктной деменции оказывает ишемическая шкала Хачинского. Наличие у пациента пожилого возраста с нейропсихологическими изменениями в анамнезе инсульта является весомым доводом для диагностики сосудистой деменции.
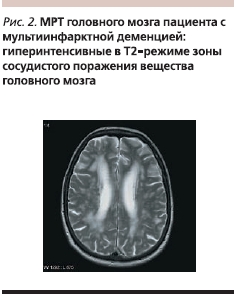
Относительными признаками, подтверждающими диагноз ЦВЗ, можно считать сосудистые факторы риска, особенно АГ, наличие в анамнезе ТИА, появление на ранних этапах заболевания тазовых нарушений или нарушений ходьбы лобного типа, локальные изменения на электроэнцефалограмме (при исключении опухоли головного мозга). При компьютерной (КТ) или магнитно-резонансной (МРТ) томографии у таких больных визуализируются множественные ишемические очаги, лейкоареоз, атрофия мозгового вещества с расширением ликворных пространств. Имеют значение локализация и размеры инфаркта, общее количество очагов.
Вместе с тем стоит помнить, что дифференциальный диагноз между дегенеративными формами возрастной деменции (слабоумие альцгеймеровского типа, фронтотемпоральная лобная деменция, деменция с диффузными тельцами Леви) и ЦВЗ, особенно на далеко зашедших стадиях, не всегда прост, тем более что почти 20 % случаев деменций пожилого возраста составляют смешанные деменции [2].
Даже на морфологическом уровне нет полной ясности: при болезни Альцгеймера в большинстве случаев обнаруживают признаки перенесенных инсультов (лакунарных или территориальных), а в случаях, казалось бы, определенной сосудистой деменции – гистологические признаки специфических дегенеративных изменений. По крайней мере половина или даже более всех случаев деменции имеют морфологические признаки обоих типов поражения.
Наличие очаговых и диффузных изменений белого вещества полушарий головного мозга (лейкоареоза) характерно для сосудистой деменции, однако единичные инфаркты и перивентрикулярный лейкоареоз в виде “шапочек” около передних и задних рогов боковых желудочков или ободка вокруг тел боковых желудочков могут выявляться и у пациентов с болезнью Альцгеймера.
Поэтому наиболее характерным признаком, подтверждающим именно сосудистый характер деменции, считается наличие множественных ишемических очагов. В целом вследствие размытости диагностических критериев категория больных “цереброваскулярной патологией” постоянно расширяется, вбирая пациентов с АГ, разнообразными хроническими психосоматическими расстройствами и т. п., поскольку врачи сугубо субъективно и умозрительно формулируют клинический диагноз на основании “церебральных” жалоб.
С другой стороны, большое внимание привлекает проблема т. н. немых инсультов, следы которых выявляют при нейровизуализации как у пациентов с впервые диагностированным острым клиническим эпизодом, так и у людей, не имевших инсульта в анамнезе. Такие инструментальные находки подтверждают представление о сосудисто-мозговом патологическом процессе как о континууме: поражение мозга не возникает просто так – без уже сложившейся морфологической подоплеки, в частности изменений сосудистой стенки.
Терапия
С учетом всего вышесказанного с акцентом на вторичность поражения вещества головного мозга в идеале лечение ЦВЗ должно включать воздействия, направленные на основное заболевание, инициирующее поражение мозговой ткани (атеросклероз, АГ, васкулиты и др.), коррекцию основных синдромов, воздействие на церебральную гемодинамику и метаболизм (рис. 3). Профилактика прогрессирования ЦВЗ проводится с учетом их гетерогенности: при субкортикальной артериосклеротической энцефалопатии и мультиинфарктном состоянии на фоне АГ в основе лежит нормализация АД с коррекцией извращенного циркадного ритма АД. При мультиинфарктном состоянии на фоне множественных кардиоэмболий, ангио- и коагулопатий (особенно при антифосфолипидном синдроме) показан прием антиагрегантов (ацетилсалициловой кислоты из расчета 1 мг на 1 кг массы тела в сутки или клопидогрел, или дипиридамол 150–200 мг/сут) и антикоагулянтов (при нарушениях ритма сердечной деятельности абсолютно показан варфарин под контролем международного нормализованного отношения).
При атеросклеротической энцефалопатии наряду с антиагрегантами и антисклеротической терапией (диета, статины) при наличии стеноза более 70 % от объема сосуда показаны реконструктивные операции [3]. Несмотря на то что первая операция при стенозе сонной артерии была выполнена De Bakey M. в 1953 г., почти 40 лет понадобилось, чтобы доказать ее безопасность и эффективность. В 1991 г. были опубликованы данные многоцентрового исследования в США и Канаде по сравнительной оценке консервативного и оперативного лечения симптомных форм стеноза сонной артерии более 70 %. И хотя исследование планировалось сроком на 5 лет, оно было досрочно прекращено через 2 года вследствие досрочного получения убедительных данных: при медикаментозном лечении больных через 2 года у 24 % наблюдался инсульт, в то время как у больных после каротидной эндартерэктомии инсульт возникал только у 7 % (включая интраоперационные осложнения) [8].
В профилактическое консервативное лечение по мере необходимости включаются вазоактивные средства: пентоксифиллин, винпоцетин и др. [9]. Лечение основных неврологических синдромов включает использование ноотропов, аминокислотных препаратов и нейромедиаторов (глицина, ипидакрина, Актовегина, церебролизина, холина альфосцерата и др.), при нарушении когнитивных функций – препараты гинкго билобы, антихолинэстеразные препараты, при головокружении и шуме в ушах целесообразно назначение бетагистина по 16 мг 3 раза в сутки.
Эффективное воздействие на церебральную гемодинамику и метаболизм оказывают антиоксиданты. Эффективное воздействие на церебральную гемодинамику и метаболизм оказывают антиоксиданты. Достижением отечественной науки в области создания антиоксидантных препаратов является мексидол. Мексидол (2-этил-6-метил-3-гидроксипиридина сукцинат) является препаратом с широким спектром фармакологических эффектов и мультифакторным механизмом действия. Наличие в структуре Мексидола сукцината имеет принципиальное значение, поскольку сукцинат является важным участником многих процессов в организме и, в частности, выступает субстратом для синтеза источника энергии – аденозинтрифосфата. Наиболее важными компонентами действия Мексидола являются его антиоксидантные, мембранотропные эффекты, способность модулировать функционирование рецепторов и мембраносвязанных ферментов и восстанавливать баланс нейромедиаторов. Именно этим мультифакторным механизмом действия обусловлены разнообразные клинические эффекты Мексидола и широкий спектр показаний к применению препарата. Фармакологические свойства Мексидола позволяют использовать его в качестве монотерапии, а также в комплексном лечении ДЭ и других клинических форм ЦВЗ. Мексидол хорошо сочетается с другими лекарственными средствами, положительно влияет на обменные процессы в нейрональных и глиальных клетках, кровоснабжение головного мозга. За последнее десятилетие в отечественной неврологии накоплен уникальный опыт применения Мексидола в медицинской практике и особенно среди больных сосудистыми заболеваниями головного мозга.
Механизм действия Мексидола связан с ингибированием свободно-радикальных процессов и перекисного окисления липидов, способностью стабилизировать биомембраны клеток, активировать энергосинтезирующие функции митохондрий, модулировать рецепторные комплексы и ионные токи, усиливать связывание эндогенных веществ, улучшать синаптическую передачу и взаимосвязь структур мозга. В экспериментальных и клинических исследованиях установлено, что Мексидол является антиоксидантом, улучшает энергетический обмен в клетке, метаболические процессы и микроциркуляцию, обладает мембраностабилизирующим действием, улучшает и стабилизирует кровоснабжение и метаболизм головного мозга. Кроме этого Мексидол подавляет агрегацию тромбоцитов, уменьшает уровень общего холестерина и липопротеидов низкой плотности, нормализует реологические свойства крови, мембранных структур клеток, ионных каналов, синаптическую передачу. Антигипоксический эффект Мексидола связан с повышением устойчивости мозга к ишемии и гипоксии, поэтому он оказывает исключительно положительное действие на течение острых и хронических нарушений мозгового кровообращения. Среди больных хронической ишемией мозга на фоне применения Мексидола уже к концу первой недели регрессируют жалобы на головные боли; мелькание “мушек”, “пятен”, тумана перед глазами; уменьшается шум в голове, улучшается память, концентрация внимания, двигательная активность, повышается работоспособность. Мексидол, являясь многофункциональным препаратом, уменьшает частоту гипертонических кризов и эпизодов резкого повышения АД. В результате применения препарата снижаются показатели вегетативных, психастенических и когнитивных расстройств уже к 6–7-му дню лечения. У больных улучшаются память, концентрация внимания, умственная работоспособность, нивелируются страх, тревога, беспокойство, напряжение и как следствие – улучшается качество жизни.
Для больных ЦВЗ лечение с применением препарата Мексидол в значительной степени снижает выраженность субъективной, в меньшей степени – объективной неврологической симптоматики. Препарат оказывает модулирующее действие на систему “кровь–сосудистая стенка”, прежде всего на больных с исходными нарушениями реологических свойств крови. По данным однофотонной эмиссионной КТ, при исследовании мозговой гемоперфузии установлено, что применение Мексидола приводит к увеличению мозгового кровотока в гипоперфузионных областях мозга, что свидетельствует о нейропротекторном и реперфузионном действии препарата. Наиболее выраженное действие Мексидола на больных ЦВЗ отмечено при кохлеовестибулярном, вестибуломозжечковом, астеническом синдромах и эмоционально-волевых расстройствах. У больных улучшалась статика и походка, регрессировали головокружение и выраженность депрессивных реакций. Причем первичная нейропротективная терапия с использованием антигипоксантов должна начинаться в пределах “терапевтического окна”, т. к. ее проведение в этот период уменьшает вероятность тяжелых инсультов, удлиняет безопасный период для проведения тромболической терапии и в ряде случаев оказывает защитное действие при синдроме избыточной реперфузии.
Поскольку самым грозным и очевидным признаком прогрессирования ЦВЗ считаются инсульты, главным направлением в ведении больных данного профиля является организация эффективных мер первичной и вторичной профилактики острых нарушений мозгового кровообращения (ОНМК). Первичная профилактика инсульта означает предупреждение ОНМК у здоровых лиц, пациентов с начальными формами цереброваскулярной патологии и в группах повышенного риска. Вторичная профилактика направлена на предотвращение повторных инсультов (общий риск повторного ОНМК в первые 2 года после перенесенного инсульта составляет от 4 до 14 %). Этот уровень риска схож с таковым у больных ТИА и в 10 раз превышает риск инсульта в общей популяции для того же возраста и пола.
Реабилитация больных и профилактика инсульта проводятся по следующей поэтапной программе:
Этап 1 – установление реабилитационного диагноза, отражающего клиническую форму, стадию заболевания, наличие сопутствующей патологии, психоэмоциональные нарушения.
Этап 2 – разработка индивидуальной реабилитационной программы с учетом биопсихосоциальной модели болезни (при активном участии пациента) на основе комплексного лечения (фармакотерапия, кинезотерапия, физиотерапия, лазеротерапия, мануальная терапия, рефлексотерапия, биомеханотерапия, психотерапия, и др.).
Этап 3 – контроль эффективности по данным клинико-неврологического обследования и нейропсихологического тестирования с последующим проведением коррекции комплекса реабилитационных мероприятий.
Этап 4 – заключительный – оценка эффективности проведенной реабилитации и составление плана по дальнейшему ведению пациента.
Стержнем вторичной профилактики считаются антигипоксанты, антиагреганты, антигипертензивные препараты и статины. Применение антиагрегантов (ацетилсалициловая кислота в суточной дозе 50–325 мг, клопидогрел, дипиридамол), по данным мета-анализа результатов 287 клинических испытаний, продемонстрировало снижение риска серьезных сосудистых событий (нефатального инфаркта миокарда, нефатального инсульта и смерти от сосудистых причин) на 25 % у больных, ранее перенесших ишемический инсульт или ТИА. Однако антиагреганты в отсутствие постоянного контроля могут вызывать осложнения (обострение гастрита или язвенной болезни, развитие сосудистого события на фоне приема антиагреганта или антикоагулянта, геморрагии).
Медикаментозное снижение АД приводит к существенному пропорциональному уменьшению риска инсульта (индапамид – на 29 %, периндоприл в дозе 4 мг вместе с индопамидом в дозе 2–2,5 мг – на 43 %). После инсульта или ТИА артериальное давление (независимо от его уровня) рекомендуется снижать с помощью диуретиков и/или ингибиторов ангиотензинпревращающего фермента с учетом индивидуальной переносимости такой терапии (уровень доказательности I). Большинство клинических исследований не подтверждает преимуществ той или иной терапии, за исключением данных о преимуществе лозартана над атенололом и хлорталидона над амлодипином.
Третьим компонентом эффективной вторичной профилактики инсульта считается снижение уровня холестерина в крови (использование статинов снижает риск повторного мозгового события в среднем на 24 %). Для пациентов с ишемическим инсультом или ТИА в анамнезе в первую очередь должна быть рассмотрена целесообразность назначения статинов (симвастатина; уровень доказательности I). Вероятно, имеет значение плейотропное действие статинов – их противовоспалительные эффекты, реализующиеся в области атеросклеротических бляшек, приводящие к стабилизации последних. В тот период применение статинов кажется достаточно адекватным даже без контроля уровня холестерина. Применение 20 мг/сут аторвастатина, симвастатина или розувастатина обеспечивает целевое профилактическое действие этих препаратов (с обязательным контролем функций печени в процессе терапии).
Таким образом, многообразие этиологических факторов, вызывающих развитие ЦВЗ, делает задачу дифференциальной диагностики их патогенетических форм архисложной, а подчас невыполнимой. В связи с этим стратегия и тактика лечения больных данной патологией попадают в поле энтропии и вряд ли в ближайшие годы станут идеальными. С учетом этого терапия пострадавших становится длительной и многодисциплинарной. Это должны понимать и принимать как врачи разных специальностей, так и пациенты, потому что лечение сердечно-сосудистых заболеваний (атеросклероза, ишемической болезни сердца, АГ, тромбозы, врожденные пороки сердца и ревматические заболевания сердца) не должно проходить изолированно – без учета сопутствующих ЦВЗ. Однако терапия последних это не только применение реликтовых лекарственных средств, к которым относятся ноотропные препараты. Современная интерпретация патогенеза ЦВЗ требует обязательного назначения пациентам рассматриваемого профиля антигипоксантов (Мексидола) длительными курсами для увеличения устойчивости жизненно важных тканей (миокарда, вещества мозга) к гипоксии как к потенциальной угрозе инфарктов или инсультов.
Максимально раннее и патогенетически обоснованное дифференцированное лечение недостаточности мозгового кровообращения в сочетании с целенаправленной профилактикой ОНМК позволят приблизиться к выполнению задач, определенных Европейским регионарным бюро ВОЗ, которые заключаются в снижении летальности в течение первого месяца заболевания до 20 % и обеспечении независимости в повседневной жизни через 3 месяца от его начала не менее чем у 70 % выживших пациентов. В последнее время приоритет отдается амбулаторному проведению профилактических и реабилитационных мероприятий. В первую очередь это объясняется значительно более низкой стоимостью и доступностью лечения в амбулаторных условиях по сравнению со стационарными, но может ли мерилом правильности ведения больного быть ”монета”, когда цена манипуляций – человеческая жизнь?


