Общая вариабельная иммунная недостаточность (ОВИН) представляет собой наиболее распространенную клинически значимую форму первичного иммунодефицита, частота встречаемости которой колеблется в пределах от 2 до 4 случаев на 100 тыс. населения. Основным патогенетическим звеном развития клинических проявлений ОВИН является значительное снижение или полной отсутствие продукции иммуноглобулинов G (IgG), IgA и/или IgM, сопровождающееся дефектом образования антител. В отличие от многих генетически обусловленных первичных иммунодефицитов пик заболеваемости приходится на молодой трудоспособный возраст (20–40 лет). Актуальность проблемы ОВИН определяется поздней диагностикой (как правило, через 6–8 лет после манифестации первых клинических проявлений), высокой частотой развития различных осложнений, госпитализаций и необходимостью пожизненной дорогостоящей заместительной терапии препаратами иммуноглобулина человека [1]. К сожалению, заместительная терапия позволяет лишь снизить риск развития острых бактериальных инфекций, в то время как лечение других многообразных клинических проявлений ОВИН, определяющих качество жизни и прогноз пациентов, до настоящего времени не разработано. Легочные проявления ОВИН включают рецидивирующие инфекции дыхательных путей и развитие хронического гранулематозного/лимфоидного инфильтративного поражения паренхимы легких. Нередко именно легочные проявления являются первой манифестацией клинической картины ОВИН, задолго предшествующей установлению диагноза [2].
Клинический случай
Пациентка К. 33 лет обратилась в госпиталь с жалобами на слабость, одышку при ходьбе на расстоянии до 200 м, при подъеме на 2-й этаж.
Из анамнеза известно, что впервые возникновение вышеописанных жалоб пациентка относит к 2007 г. В том же году был установлен диагноз саркоидоза легких, внутригрудных лимфатических узлов на основании гистологического исследования биопсированного лимфатического узла. На компьютерной томографии (КТ) органов грудной клетки отмечены увеличенные лимфатические узлы средостения, множественные очаги в обоих легких. От терапии системными глюкокортикостероидами пациентка отказалась, принимала хлорохин и пентоксифиллин курсами по 2 месяца, затем самостоятельно терапию отменяла. При ухудшении состояния указанное лечение возобновлялось вновь с незначительной динамикой со стороны легких по данным КТ.
В январе 2009 г. на коже больной появились неиндуцированные геморрагии, отмечены возникновение кашля, заложенности в грудной клетки. На КТ органов грудной клетки отрицательная динамика.
В анализе периферической крови выявлена тромбоцитопения до 20000 кл/мкл. Миелограмма – пунктат клеточный; состав миелограммы в пределах нормы. Количество мегакариоцитов достаточное, определяются преимущественно неактивные формы. Трепанобиопсия – в трепанобиоптате признаков специфического поражения костного мозга при каком-либо заболевании системы крови не обнаружены. Изменения имеют реактивный генез, могут наблюдаться при аутоиммунных процессах. Выявлены тромбоцитассоциированные антитела – 0,34 нг × 10 9 клеток, 340 % от контроля (норма – до 200 %). Уровень растворимого гликокалицина – 1,1 мкг/мл (норма – 1–4 мкг/мл), 55 % (норма – 50–200 %). Вторичный характер иммунной тромбоцитопении был исключен: антинуклеарный фактор, анти-ДНК, ревматоидный фактор – отрицательные, циркулирующие иммунные комплексы, рANCA, cANCA – в пределах нормы. Таким образом, на основании цитологического и гистологического исследований костного мозга данных за какую-либо форму гемобластоза не получено, характер имеющихся изменений не противоречил диагнозу иммунной тромбоцитопении.
Проведено лечение преднизолоном по 90 мг/сут. На фоне терапии отмечено развитие выраженного ятрогенного синдрома Иценко–Кушинга. На момент выписки в гемограмме тромбоциты 139 тыс. кл/мкл.
С середины июля 2009 г. больная отметила ухудшение самочувствия, появилась лихорадка до 38 °C, усилилась одышка. Была госпитализирована с прежним диагнозом – генерализованный саркоидоз. На КТ органов грудной клетки дальнейшая отрицательная динамика. С учетом нетипичной картины прогрессирования саркоидоза и отсутствия верификации морфологических изменений в легких пациентке была выполнена диагностическая краевая резекция 4-го сегмента левого легкого с удалением лимфоузлов 4-й и 5-й групп. Патогистологическое заключение: признаков туберкулезного воспаления не обнаружено. Картина соответствует лимфопролиферативному заболеванию легких и лимфатических узлов. С учетом этого патогистологические препараты были пересмотрены в ГНЦ РАМН, затем в патологоанатомическом бюро Санкт-Петербурга.
Патогистологическое исследование биоптата внутригрудного лимфатического узла: рисунок строения лимфатического узла сохранен, краевой и промежуточный синусы различимы. Фолликулы с крупными и мелкими светлыми центрами располагаются во всех анатомических зонах. Фолликулы окружены отчетливой зоной мантии. В некоторых местах вокруг фолликулов и перитрабекулярно обнаруживаются незначительные по объему зоны пролиферации моноцитоидных клеток. Межфолликулярные пространства несколько расширены и содержат полиморфную клеточную смесь из мелких и средних лимфоидных клеток, среди них встречаются малочисленные крупные активированные клетки и одиночные мелкие группы гистиоцитов. Гистологическое строение исследованного лимфатического узла соответствует реактивной лимфоаденопатии смешанного типа. Гистологических признаков опухолевого роста в объеме исследованного материала не обнаружено (рис. 1).
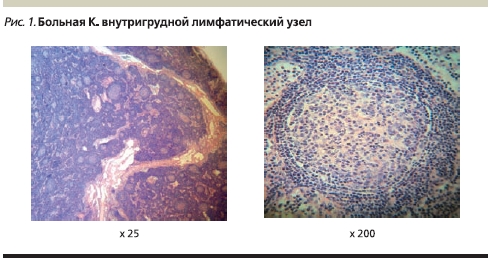
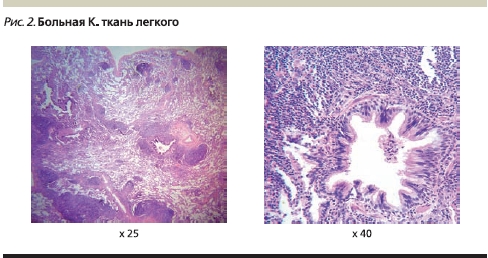
Патогистологическое, иммуногистохимическое исследование биоптата ткани легкого: в исследованном материале крупные фрагменты ткани легкого с выраженными изменениями рисунка строения. Основные изменения обусловлены многочисленными лимфоидными скоплениями фолликулярного строения, которые располагаются в тесном соприкосновении с бронхиолами и бронхами. Лимфоидные фолликулы имеют мелкие светлые центры размножения, местами хорошо различимую зону мантии и узкую маргинальную зону. На остальном протяжении в ткани легкого обнаруживаются выраженные дистелектазы и пневмофиброз. Окраска срезов карболовым фуксином по Цилю–Нильсену кислотоустойчивые палочки не выявила. Импрегнация срезов солями серебра по Грокотту и окрашивание реактивом Шиффа грибы в объеме исследованного материала не выявлены. При иммуногистохимическом исследовании клетки лимфоидных клеток фолликулов экспрессируют CD20 (L26), их строение подчеркивают фолликулярные дендритические клетки CD23 (1B12). Клетки зародышевых центров фолликулов не экспрессируют BCL-2 протеин (124). Т-лимфоциты в инфильтратах экспрессируют CD3 (PS1) и CD5 (SP19). Экспрессия легких цепей иммуноглобулинов в плазматических клетках имеет политипический характер. В просвете альвеол обнаруживаются довольно многочисленные CD68 (Ki-M1p)-позитивные макрофаги и единичные CD1a (MTB1)-позитивные ретикулярные клетки. Лимфоидные клетки не экспрессируют CD30 (Ber-H2)-антиген латентного мембранного протеина вируса Эпштейна–Барр LMP-1 (CS1-4), циклин D1 (S1-4). При иммуногистохимическом исследовании с антителами к Mycobacterium bovis (poly) антиген в ткани биоптата не обнаружен. Экспрессия эпителиальными структурами ткани легкого цитокератинов АЕ1/АЕ3 не выявила лимфо-эпителиальные повреждения в объеме исследованного материала. Гистологические изменения ткани легкого и результаты иммунофенотипического исследования соответствуют фолликулярному бронхиолиту/бронхиту. Гистологических признаков опухолевого роста в объеме исследованного материала не обнаружено (рис. 2).
При поступлении в госпиталь состояние больной было удовлетворительным. Одышки в покое не отмечено. Аускультативная картина в легких без особенностей, дыхание везикулярное. Среди показателей функции внешнего дыхания отмечено умеренно выраженное снижение проходимости на уровне дистальных отделов бронхов при нормальных показателях объема форсированного выдоха за 1 секунду. Лабораторное обследование, включая показатели полимеразной цепной реакции и иммуноферментного анализа возможных респираторных инфекций, не выявило значимых отклонений от нормы.
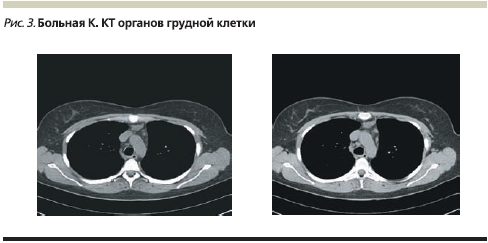
Пациентке выполнена КТ органов грудной клетки: на фоне обогащенного интерстициального компонента по всем легочным полям определяется множество очагов, различных форм и размеров, местами сливающихся между собой. Отмечаются увеличенные лимфатические узлы ретростернальной, паратрахеальной групп (рис. 3).
По данным КТ брюшной полости видимых органических изменений в абдоминальных органах не выявлено.
При бронхоскопии в просвете бронхов определено скудное количество слизистой мокроты. Слизистая оболочка бронхов бледная, с очагами гиперемии и смазанным сосудистым рисунком. Цитология бронхоальвеолярного лаважа (БАЛ): клетки цилиндрического эпителия, альвеолярные макрофаги, элементы воспаления. Посев БАЛ: выявлены Pseudomonasputida10² KOE/мл, Staphylococcusaureus10² KOE/мл, Streptococcusviridans10² KOE/мл. Роста дрожжевых и мицелиальных грибов не получено, Pneumocystis сarinii не обнаружены.
При иммунохимическом исследовании белков сыворотки крови патологических градиентов не выявлено, в т. ч. в иммунофиксации; определен полный дефицит IgA (менее 5 МЕ/мл) и частичный дефицит IgG (52 МЕ/мл).
Таким образом, на основании жалоб, данных анамнеза, объективных данных, результатов лабораторно-инструментального обследования и гистологического заключения установлен клинический диагноз "общая вариабельная иммунная недостаточность: агаммаглобулинемия – полный дефицит IgA, частичный дефицит IgG. Фолликулярный бронхиолит".
Больной проведена заместительная терапия препаратом иммуноглобулинов Интраглобин 25 мл внутривенно капельно. При контрольном иммунохимическом исследовании отмечен подъем уровня IgG до 99 МЕ/мл (в 2 раза от исходного), IgA до 16 МЕ/мл (в 3 раза от исходного).
С учетом необратимости иммунологического процесса, часто рецидивирующих инфекций в дальнейшем рекомендована ежемесячная заместительная терапия препаратами иммуноглобулинов для внутривенного введения по 25 мл на курс.
Обсуждение
Данный клинический случай в очередной раз демонстрирует трудности диагностики диффузных заболеваний легких. Несмотря на то что разработаны различные диагностические алгоритмы, основанные на особенностях клинической картины и определенных рентгенологических паттернах, выявляемых при КТ высокого разрешения и позволяющие существенно сужать спектр диагностического поиска, данная группа поражений легочной ткани, объединенных в первую очередь по принципу сходных рентгенологических изменений и являющихся следствием ряда различных по этиологии патологических процессов, продолжает оставаться серьезной диагностической проблемой [3, 4].
Взаимосвязь между наличием дисгаммаглобулинемии и развитием интерстициальных поражений легких была описана еще в 1973 г. A.A. Liebow и C.B. Carrington [5]. Причины, лежащие в основе поражения легких при ОВИН, до конца не изучены. Предполагается участие в патогенетических механизмах персистирующей вирусной или бактериальной респираторной инфекции, вируса герпеса человека 8-го типа, вируса Эбштейна–Барр, аутоиммунных процессов, изменений активности цитокинов и функции лимфоцитов [1]. Локализованные или диффузные гранулематозные поражения легочной ткани, нередко первоначально ошибочно принимаемые за саркоидоз, наблюдаются среди 8–22 % пациентов с ОВИН. Средний возраст больных составляет 26 (2–59) лет, преобладают женщины. К сожалению, на этом этапе диагностический поиск нередко завершается, диагноз “саркоидоз” считают установленным, и пациенты в течение длительного времени получают специфическую терапию. Нередко помимо легких изменения выявляются также в лимфатических узлах и селезенке. По неустановленной причине у пациентов с гранулематозными поражениями отмечено значительное увеличение риска развития различных аутоиммунных заболеваний (почти во всех случаях аутоиммунной тромбоцитопении или анемии) [1]. Вероятно, это связано с дефектом В-клеточного пула “клеток памяти”, при наличии которого выраженность системных проявлений ОВИН, особенно легочных, существенно увеличивается [6]. У этих пациентов наблюдается развитие интенсивной лимфоидной инфильтрации легочной ткани, сочетающейся с гранулематозными изменениями, что обозначается термином “гранулематозная лимфоцитарная интерстициальная болезнь легких”. При развитии данного типа поражения наблюдается ухудшение прогноза, медиана выживаемости составляет 13,7 года по сравнению с 28,8 года для пациентов без поражения легких [1].
Значительно реже у пациентов с ОВИН наблюдаются лимфопролиферативные изменения в легочной ткани без образования гранулем, связанные с гиперплазией бронхоассоциированной лимфоидной ткани и включающие фолликулярный бронхиолит, диффузную лимфоидную гиперплазию и лимфоцитарную интерстициальную пневмонию. Следует отметить весьма условную доброкачественность течения данных заболеваний, т. к. при прогрессирующем повреждении альвеол они неминуемо приводят к дыхательной недостаточности и необходимости кислородотерапии.
Фолликулярный бронхиолит характеризуется наличием множественных реактивных лимфоидных фолликулов в перибронхиальной или перибронхиолярной зоне, лимфоциты которых несут на себе маркеры В-клеток (CD20, CD79a) [7, 8]. Термин “фолликулярный бронхиолит” был впервые использован в оригинальной работе G.R. Epler и соавт. при описании изменений легких у пациентов с ревматоидным артритом [9]. Надо отметить, что фолликулярный бронхиолит является крайне редким заболеванием. В литературе имеются всего 3 серии наблюдений, включающих 37 пациентов, и серия наблюдений за 5 педиатрическими больными [10], т. е. в совокупности с единичными клиническими наблюдениями к настоящему времени описано не более 50 случаев данного заболевания [11–13], при этом у пациентов с ОВИН описано всего 4 случая [1, 14].
К настоящему времени лечение фолликулярного бронхиолита не разработано. Системная терапия кортикостероидами, как правило, не эффективна. В имеющихся единичных сообщениях имеются данные об умеренной эффективности азатиоприна, циклоспорина и азитромицина [1, 14].
Таким образом, нами представлено первое в России описание случая фолликулярного бронхиолита на фоне ОВИН. Мы полагаем, что у пациентов с наличием ретикулонодулярного рентгенологического паттерна изменений легочной ткани, гранулематозных и лимфоидных изменений, по данным морфологической картины, целесообразно проведение скрининга на наличие иммунодефицита.
Благодарность
Авторы выражают благодарность профессору Ю. Криволапову из Санкт-Петербургского патологоанатомического бюро за неоценимую помощь в установлении морфологического диагноза.


