В 1980 г. J. Ludvig описал изменения печени, аналогичные проявлениям алкогольного гепатита у лиц, не употреблявших алкоголь в гепатотоксических дозах. Для обозначения неалкогольного стеатогепатита (НАСГ) использовали различные термины: “псевдоалкогольный гепатит”, “неалкогольная болезнь Лаеннека”, “жировая печень”, “метаболический стеатогепатит”, “диабетическая гепатопатия”. Со второй половины 1990 г. диагноз “неалкогольный стеатогепатит” прочно занял место в качестве нозологической формы среди поражений печени [1].
В настоящее время НАСГ рассматривают как поражение печени “в рамках” метаболического синдрома (МС) – I тип, также выделяется НАСГ среди пациентов с нормальным индексом массы тела (ИМТ) – II тип. Возможно, вторую группу составляют пациенты, перенесшие другие болезни печени, например излеченный хронический гепатит С или поражение печени неустановленной этиологии [4].
НАСГ– это дисметаболический процесс, который характеризуется инфильтрацией и жировой дистрофией гепатоцитов (более 5 % массы печени), воспалительными изменениями с последующим цитолизом и фиброзом. На первом этапе болезни архитектоника печени остается сохранной. Однако доказано, что без правильного лечения НАСГ может прогрессировать в цирроз печени и привести к печеночно-клеточной недостаточности, а в редких случаях – к гепатоцеллюлярной карциноме. Развитие дистрофических, воспалительно-некротических и фибротических изменений в печени связано с нарушением процессов перекисного окисления липидов (ПОЛ) и является следствием инсулинорезистентности (ИР).
Распространенность
Частота НАСГ в странах Западной Европы и США составляет 7,0–9,0, в Японии – 1,2 %. В различных исследованиях признаки НАСГ описаны у 10 % больных, которым проводят биопсию печени, т. е. это пациенты с выраженной клинической симптоматикой. В действительности распространенность НАСГ может быть в 2–3 раза выше. У больных МС, протекающим с минимальными проявлениями, практически в 100 % выявляется стеатоз печени и в 25–30 % – стеатогепатит [2, 3]. В США распространенность НАСГ вышла на первое место среди болезней печени и составляет 20–30 % [3].
Факторы риска и этиология
Вопросы этиологии находятся на стадии изучения, однако факторы риска, однозначно способствующие развитию НАСГ, известны. Согласно современным представлениям о факторах риска, выделяют две группы: модифицируемые и немодифицируемые. К первой группе относят – “образ жизни”, т. е. ежедневную физическую активность, рацион питания, профессию, регион проживания и др.; ко второй – пол, возраст и генетическую составляющую.
НАСГ, как правило, развивается на фоне стеатоза печени у лиц с избыточной массой тела и/или сахарным диабетом (СД). Несомненно, что генетический фактор здесь занимает одну из ведущих позиций. Однако осуществится ли фенотипическое проявление этих генных дефектов, зависит непосредственно от “образа жизни”.
Инсулиннезависимый СД выявляется среди 70 % больных НАСГ, а у остальных 30 % в различные сроки развития болезни диагностируется нарушение толерантности к глюкозе [4, 7, 8]. По данным других исследований, стеатоз находят у 80 % больных, ИМТ которых больше 27 кг/м2. При этом, по разным данным, до 20 % всех случаев НАСГ, особенно злокачественного течения, развиваются среди лиц с нормальным ИМТ [1, 5]. Можно ли относить эти 20 % к НАСГ, или это является следствием ранее перенесенного печеночного заболевания, например вирусного гепатита, предстоит выяснить. По данным Национального института диабета, болезней пищеварения и почек (NIDDK – National Institute of Diabetes and Digestive and Kidney Diseases), в США НАСГ считается одной из основных причин возникновения цирроза печени после гепатита C и алкогольной болезни печени [4].
Среди других причин, часто способствующих развитию НАСГ, необходимо отметить быстрое снижение массы тела, например при голодании более 1 недели (низкокалорийная диета – до 500 ккал в сутки) или при хирургических вмешательствах по поводу ожирения. Эти факторы могут резко повышать активность ранее имеющегося латентного НАСГ, способствуя формированию цирроза печени и его осложнений [8, 15].
Таким образом, пациенты с наличием вышеперечисленных факторов (ИМТ более 27 кг/м2, резкое изменение ИМТ, инсулиннезависимый СД, перенесенный вирусный гепатит) с учетом генетической предрасположенности входят в группу высокого риска по НАСГ [15, 18].
Патогенез
В настоящее время известна теория “двух ударов”: первый – развитие жировой дистрофии, связанной с ИР, второй обусловлен окислительным стрессом, результатом которого является воспаление – стеатогепатит. Снижение чувствительности тканевых рецепторов к инсулину является патогенетической основой НАСГ, связанной с наследственностью. В ходе исследований выделены группы генов, ответственных за склонность к ИР и НАСГ: гены, регулирующие процессы окисления жирных кислот, окислительное равновесие в клетке и экспрессию фактора некроза опухоли α (ФНО-α) [5, 6]. Однако большинство исследователей считают, что развитие НАСГ обусловлено взаимодействием множества генов, которые могут стимулировать все компоненты МС одновременно.
О происхождении ИР, необходимой для развития НАСГ, а также о ее длительности нет единого мнения. Уменьшение количества рецепторов к инсулину в тканях и гипергликемия приводят к каскаду метаболических нарушений. В результате формируется порочный круг, включающий ИР периферических тканей, с одной стороны, и нарушение липидного обмена и НАСГ, с другой [4, 5, 10]. ИР способствует формированию стеатоза печени, а повышенная секреция ФНО-α и гипоадипонектиемия влекут за собой усугубление ИР и увеличение количества циркулирующих жирных кислот [6, 7]. Эти процессы вызывают избыточную экспрессию стеролрегулируемого протеина 1С (СРП-1С), канабиноидного рецептора 1-го типа (КР-1) и, возможно, грелина, способных стимулировать липогенез в печени [5] (см. рисунок).
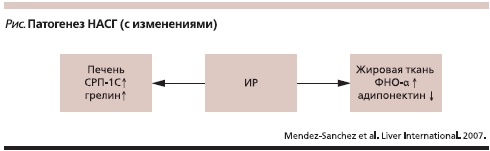
Обратим внимание на некоторые молекулярные механизмы. В регуляции метаболических процессов в печени существенная роль принадлежит α-липоевой (тиоктовой) кислоте [1, 11, 12], которая является неотъемлемой составляющей в реакциях окислительного декарбоксилирования α-кетокислот, включая превращение пировиноградной кислоты в ацетил-КоА – исходное соединение в цикле Кребса. Тиоктовая кислота в качестве кофермента участвует в углеводном и белковом обменах, является одной из важных составляющих антиоксидантной системы организма. В сложном процессе окисления тиоктовой кислоты в итоге образуется три молекулы АТФ. Таким образом, тиоктовая кислота участвует в процессах окисления жирных кислот в митохондриях и тем самым предупреждает развитие жировой дистрофии печени.
Свободнорадикальное окисление липидов является естественным биологическим процессом, протекающим в каждой клетке организма, который обеспечивает постоянное обновление липидных структур и восстановление функциональной активности рецепторов клеточных мембран, в т. ч. рецепторов к инсулину. Продукция свободных радикалов и гидроперекисей липидов лимитируется антиоксидантной системой клетки, включающей витамины Е, С, В, а также супероксиддисмутазу, каталазу, систему глутатиона и тиоктовую кислоту. Следовательно, тиоктовая кислота является регулятором количества и функциональности мембранных рецепторов, в т. ч. к инсулину. В нормальных условиях в клетке сохраняется равновесие между уровнем свободнорадикального окисления и активностью антиоксидантных систем.
При патологии имеет место или избыточное образование продуктов ПОЛ, или депрессия антиоксидантных реакций, или одновременное нарушение данных процессов, что в итоге приводит к дестабилизации и деструкции клеточных мембран, возможно – к изменению числа рецепторов к инсулину и некрозу клетки [13].
Механизм трансформации жирового гепатоза в стеатогепатит включает ряд патогенетических звеньев, идентичных как при алкогольном, так и при неалкогольном поражении. По мере накопления жира печеночная клетка становится все более уязвимой и чувствительной ктоксическим влияниям, особенно после перенесенного вирусного или токсического гепатита. В процессе оксидантного стресса образующиеся свободные радикалы запускают реакции ПОЛ, а также продукцию провоспалительных цитокинов, включая ФНО-α, СРП1С, КР-1. Эти патологические реакции приводят к развитию воспалительной клеточной инфильтрации в портальных трактах и некрозу гепатоцитов [10]. ФНО-α и КР-1 являются активаторами стеллатных клеток Ито, стимуляция которых сопровождается избыточной продукцией компонентов соединительной ткани с развитием перисинусоидального фиброза, а при длительном существовании процесса – цирроза печени [7, 13, 14]. Следовательно, различные компоненты антиоксидантной системы, в т. ч. тиоктовая кислота, могут тормозить эти процессы.
Морфологические особенности
Морфологическая картина НАСГ очень похожа на алкогольное поражение печени. В целом можно говорить о меньшей выраженности морфологических изменений при НАСГ, чем при алкогольном поражении печени. [2, 3]. В большинстве случаев выявляется крупнокапельный стеатоз, главным образом в зоне 3 (центрилобулярно), характеризующийся наличием крупных одиночных липидных капель в цитоплазме гепатоцитов со смещением ядра к периферии клетки. При мелкокапельном стеатозе в гепатоцитах выявляется множество мелких липидных капель, ядро располагается в центре клетки. Имеются также гепатоциты в состоянии баллонной дистрофии. Фокальные центрилобулярные некрозы чаще развиваются при мелкокапельном стеатозе. Воспалительный инфильтрат содержит лимфоциты, мононуклеарные клетки, преобладают нейтрофилы. Мягко и умеренно выраженные фиброзные изменения наблюдаются в 75 % случаев, выраженные – среди 15 % пациентов. Формирование цирроза выявляется среди 10 % взрослых пациентов и не характерно для детского возраста.
Клиническая картина
Течение НАСГ обычно мягкое – болезнь прогрессирует медленно, развитие цирроза печени и его осложнения наблюдаются редко. По данным исследований, 5и 10-летняя выживаемость больных НАСГ с учетом сопутствующей патологии составляет соответственно 70 и 60 % [15]. Соотношение мужчин и женщин – 1 : 3, хотя заболевание затрагивает все возрастные группы, в т. ч. детей [18]. К сожалению, число детей с МС в настоящее время, по разным данным, достигает 25 %.
Клинически НАСГ характеризуется мало- и бессимптомным течением. Пациенты редко предъявляют жалобы или они неконкретны даже в далеко зашедшей стадии болезни. Наиболее часто при НАСГ больные отмечают неопределенный дискомфорт, ноющую боль в правом подреберье, проявления диспепсического синдрома. Часто возможность развития НАСГ обсуждается после исключения других болезней печени. Характерно незначительное увеличение размеров печени, но признаки портальной гипертензии, печеночной недостаточности выявляются редко (не более 8–10 %). При анализе крови обнаруживается умеренное повышение уровня АЛТ/ АСТ (1,5–3,0 нормы) в сочетании с незначительным повышением уровней γ-глутаминтрансферазы (ГГТ) и щелочной фосфатазы (ЩФ) до 1,5–2,0 норм. Часто (до 80 % случаев) определяются гипергликемия и нарушения липидного спектра.
У больных НАСГ по определению должно быть исключено злоупотребление алкоголем. В сомнительных случаях, когда сбор анамнеза не позволяет исключить воздействие данного фактора, дополнительную информацию дают высокие уровни ГГТ, ферритина и анализ коэффициента де Ритиса (преобладание подъема уровня АСТ над АЛТ), НОМА (The Homeostatic Model Assessment) индекс и специальные тесты на скрытое употребление алкоголя, а также ФиброМакс.
В целом НАСГ рассматривают как доброкачественное заболевание, в некоторых случаях (до 10 %) он прогрессирует до цирроза печени с выраженной печеночно-клеточной недостаточностью.
Диагностика
Диагноз НАСГ чаще предполагается и устанавливается на основании совокупности признаков, характерных для НАСГ, и клинического опыта врача, но подтверждается после биопсии печени. В настоящее время “золотым стандартом” диагностики, а также определения степени и стадии заболевания печени остается биопсия.
На современном этапе в диагностике заболеваний печени широко используются новые биопрогностические технологии [4] – эластография и ФиброМакс.
Данные тесты позволяют получать точную количественную и качественную оценку фиброза, стеатоза и некровоспалительных изменений в печени с помощью математического анализа биохимических данных на всех стадиях независимо от локализации по международной общепринятой системе METAVIR. ФиброМакс является единственным методом подобного рода, поддержанным и подтвержденным более чем 40 международными клиническими исследованиями. ФиброМакс включает в свой состав следующие параметры: ФиброТест – диагностируется фиброз печени; СтеатоТест – диагностируется стеатоз печени; АктиТест – оценивается вирусная некровоспалительная активность; АшТест – диагностируется алкогольный стеатогепатит; НешТест – диагностируется НАСГ среди пациентов с избыточной массой тела, ИР, СД или гиперлипидемией.
В основе метода эластографии заложено определение плотности печени, зависящей от количества фиброзной ткани. Объем ткани, подвергающейся исследованию, составляет до 6 см3 (оценивают в килопаскалях и по таблице сопоставляют со шкалой METAVIR), что значительно превосходит объем ткани при биопсии. Этот метод дает возможность определить степень фиброза, что является основным показателем тяжести течения и критерием прогноза заболеваний печени.
Таким образом, инвазивный характер биопсии, ее возможные осложнения и развитие новых биопрогностических технологий, таких как ФиброМакс и эластография, уравнивают значимость “новых” и “старых” технологий, постепенно вытесняя простое микроскопическое исследование ткани печени.
Лечение НАСГ
При обсуждении лечения больных НАСГ первостепенное внимание следует обратить на профилактику этого заболевания и модифицируемые факторы риска – ИМТ пациента, его ежедневную физическую активность, рацион питания. На втором месте находится патогенетическая терапия, которой большинство врачей уделяют приоритетное внимание, т. к. многие механизмы болезни стали известны. Также важно тщательное наблюдение за больными, перенесшими вирусный гепатит. При этом ни у кого не возникает сомнения в значимости всех этапов профилактики и лечения.
Снижение массы тела является обязательной основой лечения МС и НАСГ, включает пожизненное изменение рациона и ежедневные физические нагрузки. Отмечено, что у пациентов с избыточной массой тела и повышенным уровнем АСТ/АЛТ уменьшение массы тела на 10 % приводит к снижению уровня трансаминаз и уменьшению размеров печени без применения лекарственных средств [3]. Пациентам, имеющим ИМТ > 27 кг/м2 и НАСГ, должна быть составлена программа снижения массы тела. Согласно рекомендациям The National Heart, Lung, and Blood Institute и The National Institute of Diabetes and Digestive and Kidney Diseases (США), снижение массы тела должно составлять около 1 кг в неделю для взрослых. При этом на фоне очень быстрого снижения массы тела существует повышенный риск развития подострого НАСГ [3].
На наш взгляд, медикаментозная поддержка пациентов, готовых к снижению массы тела, может включать препараты, уменьшающие всасывание жиров в желудочно-кишечном тракте. Одним из наиболее изученных лекарственных средств для лечения ожирения является орлистат [16]. Отсутствие системного действия и серьезных побочных эффектов, достаточное снижение ИМТ, которое сопровождается уменьшением стеатоза, дают основание рекомендовать орлистат для профилактики развития НАСГ среди лиц с избыточной массой тела.
Патогенетическая терапия – лечение ИР и окислительного стресса. В клинических исследованиях показано, что на фоне приема метформина у больных НАСГ снижается уровень гипергликемии и повышается чувствительность к инсулину, уменьшается активность печеночных ферментов, выраженность жировой дистрофии, воспалительных изменений и фиброза [3, 9, 13]. В настоящее время при лечении больных НАСГ рекомендуется применение метформина (Метфогамма, “Вёрваг Фарма”, Германия) в дозах 500– 2000 мг/сут. Показано, что применение пиоглитазона нормализует активность печеночных ферментов и уменьшает выраженность морфологических признаков стеатоза. Поиск оптимальных средств коррекции ИР продолжается: получены данные об успешном опыте комбинированной терапии метформином, росиглитазоном, эзетимибом и валсартаном [16]; изучается опыт использования натеглинида [13], улучшающего раннюю секрецию инсулина. Как важное направление можно рассматривать применение препаратов с антиоксидантной активностью [3], которое может быть оправданно с точки зрения патогенеза НАСГ.
В основе адекватного и рационального применения препаратов тиоктовой кислоты лежат результаты многочисленных зарубежных исследований (ALADIN, ORPIL, NATHAN, DECAN, SYDNEY) [12, 11]. При проведении мета-анализа результатов указанных исследований, включившего 1258 пациентов, показано, что внутривенное введение тиоктовой кислоты в дозе 600 мг в течение трех недель значительно уменьшает невропатическую симптоматику и неврологический дефицит [11, 13]. В данных исследованиях был сделан акцент на применении тиоктовой кислоты больными инсулиннезависимым СД с МС и его осложнениями. Мы обращаем внимание на то, что среди 80 % больных НАСГ выявляется инсулиннезависимый СД, а у остальных 20 % в различные сроки развития болезни диагностируется нарушение толерантности к глюкозе. Это означает, что полученные результаты в определенной мере можно экстраполировать на больных НАСГ, т. к. феномен “окислительного стресса” рассматривают в качестве основной универсальной причины формирования поздних осложнений СД и развития стеатогепатита [5, 15].
Из положительных эффектов тиоктовой кислоты следует отметить следующие:
- повышает скорость транспорта глюкозы до 84–8 % от нормальной;
- оказывает на трансмембранный транспорт глюкозы действие, сходное с таковым инсулина, активизируя на определенных этапах сигнальный каскад этого гормона [12, 18];
- положительно влияет на метаболизм холестерина;
- благотворно воздействует на репаративные процессы (уменьшает проявления висцеральной микроангиопатии в тканях при СД, в т. ч. в гепатоцитах);
- улучшает печеночную функцию [12].
Препарат Тиогамма (Вёрваг Фарма, Германия) (тиоктовая кислота) оптимально подходит для комплексного лечения пациентов с СД 2 типа, которые в 80 % случаев имеют жировой гепатоз. Обратим внимание на уникальность формы выпуска Тиогаммы – раствор, не требующий предварительного разведения, в темном флаконе объемом 50 мл. Это выгодно отличает указанный препарат, уменьшает финансовые и временные затраты при проведении инфузии. Касательно дозы было сделано заключение, что в связи с определенной инерционностью обмена тиоктовой кислоты для достижения клинического эффекта необходимым является пролонгированный курс применения [12], который состоит из двухнедельного внутривенного введения препарата Тиогамма капельно из готовых флаконов, каждая доза (флакон) содержит 600 мг тиоктовой кислоты, что является оптимальной суточной дозой по данным международных крупных исследований. После внутривенного курса терапии Тиогаммой необходимо назначение таблетированной формы, также по 600 мг в сутки утром натощак. На наш взгляд, эти рекомендации могут распространяться на лечение больных НАСГ.
Заключение
Таким образом, обязательной основой лечения НАСГ являются пожизненное изменение рациона питания и ежедневные физические нагрузки, направленные на снижение ИМТ. Напоминаем, что уменьшение массы тела на 10 % приводит к снижению уровня трансаминаз и уменьшению размеров печени без применения лекарственных средств.
Для комплексного патогенетического лечения НАСГ достаточно изученным, оптимальным и безопасным является сочетание Метфогамма (метформин) и Тиогаммы. С учетом описанного выше участия тиоктовой кислоты в антиоксидантной защите можно говорить об обоснованности назначения Тиогаммы всем больным с повышенным ИМТ и ИР для профилактики и лечения стеатоза печени и НАСГ.
Широкий спектр средств, влияющих на различные этапы патогенеза НАСГ, и отсутствие единого подхода к лечению данного заболевания определяют необходимость дальнейших исследований для определения эффективности и оптимизации различных схем лечения конкретного пациента.
Информация об авторе:
Русских Александр Вадимович – докторант кафедры терапии и профболезней МПФ.
E-mail: avrussk@yandex.ru


