Несмотря на достаточно активное изучение патогенеза, клиники, диагностики и лечения функциональных заболеваний желудочно-кишечного тракта (ЖКТ), в этой области еще сохраняется немало вопросов, ожидающих своего разрешения. Не составляет исключения и функциональная патология билиарного тракта [1, 2].
Функциональные нарушения в системе желчевыделения чаще всего носят вторичный характер, главным образом связаны с теми или иными заболеваниями гепатобилиарного аппарата, органов пищеварения или других систем организма. Однако в ряде случаев структурную патологию, обусловливающую клинические симптомы, характерные для дисфункции желчевыводящих путей (ЖВП), всеми доступными на сегодняшний день лабораторными и инструментальными методами выявить не удается. В этом случае допустимо говорить о первичных расстройствах со стороны билиарного тракта.
В настоящее время в соответствии со II и III Римскими консенсусами по проблемам функциональных заболеваний органов ЖКТ первичные функциональные расстройства ЖВП определяются как комплекс клинических симптомов (болевого абдоминального и диспепсического синдромов), развившихся в результате моторнотонических нарушений (дисфункций) желчного пузыря (ЖП) и сфинктеров (главным образом сфинктера Одди [СО]), в отсутствие признаков органической патологии билиарного тракта. Данные симптомы могут быть постоянными или возникать периодически, по крайней мере в течение не менее 3 последних месяцев с началом проявлений не менее 6 месяцев перед диагностикой.
В последней Международной классификации болезней (МКБ-10) функциональные заболевания ЖВП обозначают как “дискинезии желчного пузыря и пузырного протока” (К. 82.8) и “спазм сфинктера Одди” (К. 83.4).
Кроме того, как указывалось выше, все функциональные расстройства ЖВП часто подразделяют по этиологии:
• первичные дисфункции;
• вторичные дисфункции.
По локализации:
• дисфункция ЖП;
• дисфункция СО.
По функциональному состоянию:
• гиперфункция (ЖП/СО);
• гипофункция (ЖП/СО).
Кроме того, выделяют виды (типы) функциональных расстройств, которым подвержены следующие структуры желчевыводящей системы:
• ЖП – дисфункциональные расстройства как по гипер-, так и по гипокинетическому типам;
• СО, сфинктер Люткенса – гипертонический тип – спазм или гипотония, атония сфинктера/ов.
III Римский консенсус по функциональной патологии ЖКТ (2006) предлагает все функциональные расстройства ЖП и СО разделять на категории (Е) с субкатегориями, выделяя ведущий вид расстройства:
• Е. Функциональные расстройства ЖП и СО.
• Е1. Функциональное расстройство ЖП.
• Е2. Функциональное билиарное расстройство СО.
• Е3. Функциональное панкреатическое расстройство СО.
Вне зависимости от применяемой номенклатуры принципиальным является выделение дисфункции ЖП и СО с оценкой их функционального состояния (гипофункция или гиперфункция).
Распространенность дисфункций ЖВП, по разным оценкам зарубежных и отечественных исследователей, колеблется от 12 до 58 %. При этом среди женщин они встречаются в 2–3 раза чаще, чем среди мужчин, а первичная патология регистрируется приблизительно в полтора раза реже вторичных функциональных нарушений. Имеются сведения о зависимости частоты функциональной билиарной патологии от рода деятельности и других социальных факторов.
На долю первичных дисфункций ЖВП приходится, по данным разных авторов, от 7,6 до 20,7 % и более. Большинство пациентов в возрасте до 30 лет, преимущественно женщины, при обращении в поликлинику с жалобами на боли в правом подреберье страдают той или иной формой дисфункции ЖВП. Первичной дискинезией ЖВП страдают чаще лица молодого возраста (18–35 лет), астенической конституции и пониженного питания. Дисфункция СО может также развиться после перенесенной холецистэктомии.
Вторичные функциональные нарушения билиарного тракта (до 90 % от всех дисфункций) диагностируются чаще всего при патологии ЖВП воспалительного характера, аномалиях развития системы желчевыведения, а также при заболеваниях гастродуоденальной зоны, включая поджелудочную железу. Вторичные дисфункции ЖВП в большинстве случаев сочетаются с вариантами формы и аномалиями развития ЖП, сифонопатиями (шаровидным, удлиненным ЖП, в виде песочных часов, перегибами, перетяжками, мембранами и пр.). При сифонных аномалиях ЖП образуется острый угол в области его шейки и пузырного протока, что является препятствием для нормального выделения желчи. Следует иметь в виду, что врожденные аномалии, как и воспалительные процессы в шеечной области ЖП, пузырном, общем желчных протоках, в области фатерова соска, редко распознаются и указанные расстройства могут расцениваться как первичные дисфункции ЖВП. Тяжело бывает отдифференцировать первичную дискинезию от вторичной при бескаменном холецистите, дуодените, хроническом панкреатите, особенно при небольшом анамнезе этих заболеваний.
Кроме того, вторичные дисфункции в желчевыводящей системе могут наблюдаться при следующих заболеваниях:
• острых и хронических заболеваниях печени (гепатиты, циррозы);
• хроническом панкреатите;
• заболеваниях желудка и двенадцатиперстной кишки (ДПК; хронический гастрит, дуоденит, язвенная болезнь);
• дуоденостазе разной этиологии;
• как следствие перенесенных оперативных вмешательств на желудке, кишечнике, ЖП (холецистэктомия);
• эндокринных расстройствах (сахарный диабет, патология щитовидной и паращитовидных желез, предменструальный синдром);
• беременности;
• диэнцефальных расстройствах;
• правостороннем нефроптозе;
• на фоне побочных эффектов некоторых лекарственных препаратов (холинолитиков, неселективных спазмолитиков и др.).
Рассматривая причину первичных дисфункциональных расстройств ЖВП, в первую очередь следует учитывать нейрогуморальные нарушения регуляции моторной функции органов пищеварения и системы ЖВП как его составляющей. Ведущим является влияние центральных воздействий. При спастических нарушениях чаще регистрируется дисбаланс вегетативной регуляции в сторону парасимпатикотонии. Преобладание тонуса симпатического нерва способствует расслаблению гладкой мускулатуры ЖП.
Велико значение психогенных факторов: “соматовегетативных расстройств”, неврозов, депрессий, стрессовых факторов, отрицательных эмоций, формирующихся очагов “застойного” возбуждения в гипоталамусе, ретикулярной формации и дезрегуляции в целом по цепи “гипоталамус–гипофиз–надпочечники”. Причина избирательности поражения функции ЖКТ в ответ на стресс, возможно, связана с наследственно-онституциональными факторами, определяющими восприимчивость некоторых органов и систем, а также с патологическими установками в пищевом поведении, сформированными еще в детском возрасте. Генетические факторы предопределяют слабость механизмов, регулирующих функции желудка, кишечника, билиарного тракта и могут стать причиной тропности агента, повреждающего их функцию, к тому или иному органу ЖКТ.
Обсуждаются также нейроэндокринные и иммунные нарушения в системе автономной нервной системы органов пищеварения, вызывающие изменение чувствительности рецепторного аппарата к нейрогуморальной стимуляции и другим видам раздражителей, причем действующих и в нормальном, физиологическом диапазоне (гиперсенситивность). В возникновении указанного феномена гиперсенситивности рассматривается роль очаговых и системных хронических бактериальной и вирусной инфекций, в т. ч. с поражением автономного ганглионарного аппарата, регулирующего моторную активность гладкомышечных образований органов ЖКТ, билиарного тракта в частности.
Регистрируемые при первичных функциональных расстройствах измененные уровни многих гормонов, нейропептидов и медиаторов могут модулировать развитие дисфункций билиарного аппарата, очень чувствительного к нейрогуморальным влияниям. Известно, что большинство регуляторных пептидов, особенно холецистокинин, обладает выраженным влиянием на моторную активность органов ЖКТ. В дистальных отделах ЖВП, в т. ч. в области СО, обнаруживаются серотонин, энкефалин, нейропептид Y, соматостатин, субстанция Р, кальцитонин-генсвязанный пептид, бомбезин. Однако роль многих из названных биологически активных веществ в регуляции деятельности сфинктеров ЖВП в настоящее время до конца не ясна. Имеются данные, что соматостатин вызывает угнетение секреции желчи и ингибирование сокращений ЖП, возможно – через подавление действия холецистокинина.
Наиболее частыми причинами развития гипокинезии ЖП являются:
Первичные:
• патология гладкомышечных клеток ЖП, в т. ч. уменьшение мышечной массы пузыря;
• снижение чувствительности рецепторов к нейрогормональным стимулам;
• снижение медиаторной роли простагландина F2α;
• развитие аутоиммунной реакции (сенсибилизация лимфоцитов к холецистокинину с развитием холецистокининовой недостаточности);
• дискоординация моторной активности мускулатуры ЖП и пузырного
протока;
• длительное увеличенное сопротивление пузырного протока.
Вторичные:
• на фоне высокого уровня эстрогенов в крови (при беременности, во вторую фазу менструального цикла и при приеме гормональных противозачаточных средств), соматостатиномы, терапии соматостатином;
• в результате послеоперационных состояний (резекции желудка, наложения анастомозов, ваготомии,
холецистэктомии);
• на фоне строгой длительной диеты при заболеваниях желудка, ДПК (гастрит, язвенная болезнь), приводящей к развитию “ленивого” ЖП;
• как следствие атрофии слизистой оболочки желудка и ДПК, приводящей к снижению синтеза холецистокинина, гастрина, мотилина, секретина и др. (атрофический гастрит, дуоденит, дуоденостаз);
• при малоподвижном образе жизни, ожирении, нерегулярном питании, больших интервалах между приемами пищи; при системных заболеваниях (диабет, цирроз печени, целиакия, миотония, дистрофия);
• при воспалительных заболеваниях ЖП различной природы и наличии в его полости конкрементов.
Что касается дисфункции СО, связанной с перенесенной холецистэктомией, то здесь причин для формирования данной патологии, если она отсутствовала до операции, несколько. В первую очередь это разрушение связей между ЖП и СО. Известно, что во время сокращения ЖП рефлекторно возникает релаксация СО. Кроме того, ЖП модулирует ответ СО на гормональную стимуляцию (холецистокинин). Перечисленные причины не связаны со структурными нарушениями СО, не имеют органической природы и базируются на нарушении функциональных путей регуляции деятельности сфинктера. Однако возможны и органические его изменения (стеноз, стриктура и т. п.). Все вышеперечисленное может быть причиной клинического синдрома, ведущим симптомом которого является боль. В основе болевого синдрома лежит в первую очередь спазм гладкой мускулатуры сфинктерного образования. Данные явления особенно выражены в первые месяцы после холецистэктомии.
У большинства больных после холецистэктомии определяются признаки высокой литогенности желчи с низким холатохолестериновым коэффициентом. Выпадение физиологической роли ЖП (концентрация желчи в межпищеварительный период и выброс ее в ДПК в период пищеварения) сопровождается нарушением пассажа желчи в кишечник, расстройствами пищеварительной функции ДПК и других
отделов тонкого кишечника, появлением диспепсических расстройств (диарея или запор, метеоризм, симптомы дуоденогастрального рефлюкса, гастроэзофагеальной рефлюксной болезни). Данные явления возникают из-за изменения после холецистэктомии химического состава желчи и ее хаотичного поступления в ДПК. Это приводит к нарушению переваривания и всасывания жира и других веществ липидной природы, уменьшает бактерицидность дуоденального содержимого, приводит к микробному обсеменению ДПК, ослаблению роста и функционирования нормальной микрофлоры, расстройству энтерогепатической циркуляции желчных кислот. Под влиянием микрофлоры желчные кислоты подвергаются преждевременной деконьюгации, что сопровождается повреждением слизистой оболочки ДПК, тонкой и толстой кишки с развитием дуоденита, колита, рефлюкс-гастрита, гастроэзофагеальной рефлюксной болезни, в т. ч. ассоциированной с дуоденогастральным рефлюксом (смешанный рефлюкс). Дуоденит сопровождается дуоденальной дискинезией, функциональной дуоденальной недостаточностью, гипертензией, дуоденогастральным рефлюксом и забросом содержимого в общий желчный и панкреатический протоки. На этом фоне у 10 % пациентов после холецистэктомии развивается или усугубляется имевшаяся до операции дисфункция СО.
Очень важно провести тщательное инструментальное исследование больного и выяснить причину дисфункции СО, исключить ее органическую природу, т. к. это будет определять дальнейшую лечебную тактику – реконструктивные операции (сфинктеротомия) либо медикаментозное лечение. Полное трансабдоминальное ультразвуковое исследование (УЗИ) является наиболее важным диагностическим этапом для исключения органическойпатологии ЖВП и поджелудочной железы. В сложных случаях применяют магнитно-резонансную холангиопанкреатографию, эндоскопическую ретроградную холангиопанкреатографию с манометрией СО.
Для билиарной гипертензии с наличием органических препятствий току желчи (стенозирующий папиллит) кроме наличия болевого синдрома в правом подреберье (дистензии) характерны синдром холестаза, кожный зуд и лихорадка. У 5–20 % больных выявляется рецидивный или резидуальный холедохолитиаз, у 11–14 % – стеноз большого дуоденального сосочка, у 6,5–20,0 % – стриктуры желчных протоков и желчеотводящих анастомозов, у 0,1–1,9 % – избыточная культя пузырного протока. Аналогичный механизм болевого синдрома наблюдается и при наличии препятствия изгнанию желчи из ЖП при повышенном сопротивлении прохождения желчи по пузырному протоку (перекрут, перегиб и т. п.). Отличием является выраженность дистензии протока и, соответственно, интенсивности боли при сохраненной сократительной способности ЖП, пытающегося преодолеть сопротивление.
При нарушении мышечной сократимости ЖП, сниженном давлении в полости пузыря и протоках болевой синдром связан, что подтверждено экспериментально, с изменением чувствительности рецепторов, реагирующих уже на подпороговое раздражение растяжением стенок застойной желчью (гиперсенситивность рецепторов).
Основным клиническим проявлением дисфункциональных нарушений билиарного тракта служат эпизоды болей в правом подреберье и/или эпигастральной области. При этом, несмотря на наличие достаточно четких диагностических критериев, клиника функциональных расстройств билиарного тракта на практике трудно отличима от проявлений органической патологии. Если у пациента в анамнезе нет холецистэктомии, далеко не всегда удается четко отдифференцировать моторно-тонические нарушения ЖП от СО. Данные обстоятельства обычно требуют проведения ряда лабораторных и инструментальных исследований [3, 4]. Важной диагностической пробой для выявления дисфункции ЖП является исследование его фракции выброса в процентах. Исследование проводят с помощью меченой 99 mTc иминодиацетиловой кислоты, хорошо концентрирующейся в ЖП и выделяющейся после холецистокинетических стимуляторов. Диагностическим критерием дисфункции ЖП считается низкая фракция выброса в отсутствие признаков холелитиаза.
Кроме перечисленных неинвазивных и инвазивных методов диагностики дисфункции ЖВП отдельно стоит фракционное дуоденальное зондирование с микроскопическим и биохимическим исследованием желчи. Достоинством данного метода является возможность его применения как в амбулаторных условиях, так и в стационаре. Данный метод является достаточно информативным для диагностики функциональных расстройств сфинктерного аппарата ЖВП.
Медикаментозное лечение таких пациентов направлено прежде всего на купирование рецидивирующего спастического болевого синдрома, восстановление нормального тока желчи и секрета поджелудочной железы по билиарным, а также панкреатическим протокам. С этой целью традиционно применяют широкий спектр спазмолитических препаратов. В то же время схемы лечения данной категории больных недостаточно стандартизированы, а данные по применению многих лекарственных средств остаются противоречивыми или относительно устаревшими [5].
Одним из наиболее эффективных препаратов для купирования спастических болей и нормализации моторно-тонической функции билиарного тракта является селективный миотропный спазмолитик мебеверин. Данный препарат избирательно действует на гладкую мускулатуру ЖКТ, быстро устраняя спазм и препятствуя развитию гипотонии. При этом после подавления гипермоторики и гипертонуса нормальная перистальтика сохраняется [3, 6], что делает возможным длительное применение препарата.
Целью исследования стало изучение эффективности и переносимости мебеверина (Дюспаталина) при купировании спастического болевого синдрома у пациентов с функциональными расстройствами ЖВП.
Материал и методы
Данная работа была спланирована как проспективное открытое несравнительное исследование и проведена на клинических базах кафедры пропедевтики внутренних болезней и гастроэнтерологии МГМСУ. В исследование включили лиц обоего пола в возрасте от 18 до 70 лет. На первом этапе отобрали пациентов с жалобами на эпизоды рецидивирующих спастических болей в правом подреберье и/или эпигастральной области. Всем больным проведены стандартные лабораторные исследования (общие анализы крови и мочи, биохимический анализ крови), УЗИ органов брюшной полости и эзофагогастродуоденоскопия.
В исследование не включали пациентов с органической патологией гастродуоденальной области (желчнокаменная болезнь, хронический холецистит, хронический панкреатит, язвенная болезнь желудка и ДПК и др.). Пациентов, перенесших холецистэктомию, в отсутствие признаков холедохолитиаза из протокола не исключали. Другая функциональная патология ЖКТ (функциональная диспепсия и синдром раздраженного кишечника) исключалась на основании подробного анализа клинической картины, локализации боли, ее связи с приемом пищи и дефекацией. В протокол не включили и пациентов с признаками функционального билиарного расстройства СО I и II типов (повышение уровней аланин- и аспартатаминотрансферазы, билирубина или щелочной фосфатазы более 2 норм и расширение диаметра общего желчного протока более 8 мм), т. к. в таких случаях высока вероятность его структурных изменений. Другими критериями невключения служили известная гиперчувствительность к мебеверину, недавний прием любых спазмолитических препаратов и анальгетиков, тяжелая сопутствующая патология (сердечно-сосудистая, легочная, почечная или печеночная недостаточность, сосудистая патология головного мозга, заболевания крови, декомпенсированный сахарный диабет, онкологические заболевания и др.), алкоголизм, наркомания, токсикомания, психические заболевания, прием антидепрессантов, беременность и лактация, отсутствие информированного согласия.
В итоге на втором этапе в исследование были включены 69 пациентов (49 женщин и 20 мужчин) с диагнозом “функциональное расстройство желчевыводящих путей”, разделенных на две группы. В 1-ю группу вошел 31 обследованный с сохраненным ЖП (22 женщины и 9 мужчин, средний возраст – 33,5 года), а во 2-ю – 38 пациентов, ранее перенесших холецистэктомию (28 женщин и 10 мужчин, средний возраст – 52,4 года).
Для уточнения характера нарушения моторно-тонической функции билиарного тракта пациентам обеих групп была выполнена динамическая гепатобилисцинтиграфия. Исследование проведено на гамма-камере Siemens Orbiter. В качестве радиофармпрепарата использована Бромезида 99 mTc. Обследование выполнялось натощак. Раствор радиофармпрепарата вводили внутривенно из расчета 1,7 мБк на 1 кг массы тела пациента. Запись производили в режиме 1 кадр в минуту в течение 1,5 часа. На 30-й минуте для стимуляции желчеотделения и сокращения ЖП пациентам давали желчегонный завтрак (2 сырых яичных желтка).
По результатам исследования оценивались следующие основные функциональные параметры: длительность латентного времени (от введения желчегонного завтрака до начала сокращения ЖП), время максимального накопления и полувыведения радиофармпрепарата из ЖП, время максимального накопления и полувыведения радиофармпрепарата из холедоха, время и объем поступления радиофармпрепарата в ДПК [7].
Протокол исследования предполагал два посещения врача. Во время первого визита, который проводился после выполнения гепатобилисцинтиграфии, всем больным назначили мебеверин в дозе 200 мг 2 раза/сут за 20 минут до еды. Длительность терапии составила 28 дней. Во время второго визита (на 29–30-й день от начала терапии) проведена клиническая оценка результатов лечения.
Оценку эффективности и безопасности терапии осуществляли с помощью анкет, которые заполняли пациенты во время первого и второго визитов. Обследованные пациенты регистрировали наличие или отсутствие рецидивирующих болей в течение недели до первого и второго визитов. Интенсивность боли до начала и в конце исследования определяли по 100-миллиметровой визуальной аналоговой шкале (ВАШ), на которой отметка 0 обозначалась как “отсутствие боли”, а отметка 100 – как “наиболее сильная боль, которую можно себе представить”. Кроме этого больные отметили общую эффективность лечения как “очень хорошую” или “хорошую”, “удовлетворительную”, “неудовлетворительную”. Пациентам 1-й группы после окончания курса медикаментозного лечения для оценки моторной функции ЖП проведено динамическое трансабдоминальное УЗИ до и после приема холекинетика по стандартной методике.
Статистический анализ осуществлен с помощью программы Биостат, применялись критерии χ-квадрат и t-критерий Стьюдента.
Результаты
По данным динамической гепатобилисцинтиграфии, в 1-й группе у 71,0 % пациентов имелся спазм СО, а у 29,0 % – гиперкинетическое функциональное расстройство ЖП. У 58 % больных регистрировали гипомоторную дискинезию ЖП, которая всегда сочеталась со спазмом СО. Во 2-й группе спазм СО имелся в 89,5 % случаев. У 10,5 % пациентов нарушений моторной функции выявлено не было, однако с учетом наличия у них типичной клиники билиарной боли данные больные из протокола исключены не были.
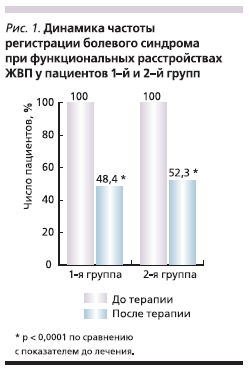
Исходно, как отмечалось ранее, у 100 % пациентов обеих групп имелись периодические (не менее одного раза в неделю) рецидивирующие боли спастического характера в правом подреберье и/или эпигастральной области. Анализ динамики болевого синдрома показал, что после 4-недельного
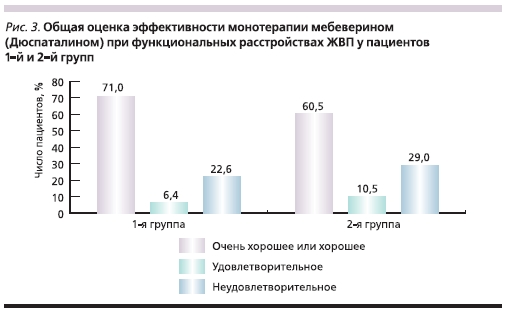
курса монотерапии мебеверином в 1-й группе боль продолжала беспокоить только 48,4 % пациентов (р < 0,0001; рис. 1). При этом у 25,8 % обследованных больных отмечено заметное уменьшение частоты и интенсивности болевого абдоминального синдрома. Лишь в 22,6 % случаев какой-либо значимой положительной динамики клинической картины достичь не удалось. Существенный положительный эффект был отмечен и при оценке интенсивности боли с помощью ВАШ. Исходная интенсивность боли в 1-й группе составила 4,4 ± 1,1 см (здесь и далее указано стандартное отклонение), тогда как по истечении 4 недель этот показатель уменьшился до 1,5 ± 1,9 см (р < 0,0001, 95 % доверительный интервал – 2,1–3,6; рис. 2). Общая самооценка терапии пациентами данной группы показала, что 71,0 % из них считали ее эффективность очень хорошей или хорошей (рис. 3). По данным динамического УЗИ, после лечения нарушения моторной функции ЖП по гипокинетическому типу продолжали выявляться только у 13 % обследованных пациентов.
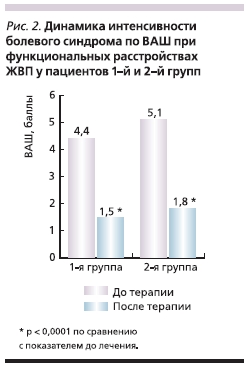
Во 2-й группе больных была также зарегистрирована значительная положительная динамика болевого синдрома, однако отмеченная у меньшего числа обследованных. К концу лечения на боль предъявили жалобы 52,3 % больных (р < 0,0001; рис. 1), причем в 26,3 % случаев отмечено уменьшение интенсивности и частоты эпизодов боли. У 29,0 % пациентов существенных изменений клинической симптоматики функциональных расстройств ЖВП выявлено не было. Как и в 1-й группе, во 2-й – достоверная положительная динамика была достигнута и по показателю интенсивности боли. До начала терапии во 2-й группе он составил 5,1 ± 1,3 см, тогда как к окончанию 4-й недели приема мебеверина – уже 1,8 ± 2,1 см (р < 0,0001, 95 % доверительный интервал – 2,5–4,1; рис. 2). Во второй группе 60,5 % больных отметили эффективность лечения как “очень хорошую” или “хорошую” (рис. 3).
Переносимость мебеверина была отличной. Ни в одном случае побочных эффектов, связанных с лечением, зарегистрировано не было.
Заключение
Таким образом, в данном клиническом исследовании была продемонстрирована эффективность терапии мебеверином (Дюспаталином) рецидивирующих спастических болей при функциональных расстройствах ЖВП. Большинство пациентов отметили полное купирование или заметное уменьшение частоты и интенсивности болевого абдоминального синдрома и оценили эффективность лечения как “очень хорошую” или “хорошую”. В то же время у части больных существенной положительной динамики достичь не удалось. Такие лица, по-видимому, с одной стороны, нуждаются в пролонгации медикаментозной терапии мебеверином, с другой – в дообследовании с уточнением необходимости эндоскопического или оперативного лечения. Выборочный анализ динамики клинической симптоматики у пациентов с пролонгацией курса лечения Дюспаталином показал дальнейшую положительную динамику более чем у трети пациентов.


