Остеопороз (ОП) – наиболее часто встречающеесяметаболическое заболевание костной системы, при развитиикоторого в первую очередь страдаетпрочность костной ткани, уменьшается ее масса, что приводит к хрупкостикостей и переломам при незначительных травмах. В основе возникновения любой формы ОП лежит дисбалансмежду процессами разрушения старойи образования новой кости. Дело втом, что в костной ткани эти процессы происходят в течение всей жизничеловека, но в зависимости от возраста они протекают с разной скоростью и направленностью. Так, до 20–25 лет происходит набор максимальной массы кости (пик костной массы),и у здорового ребенка и подросткапроцессы костеобразования преобладают над разрушением (или резорбцией, рассасыванием) старой кости. С25 до 45–50 лет у женщин и до 50–55у мужчин скорости костеобразованияи костной резорбции примерно одинаковы и соответствуют периоду т. н.плато. С возраста наступления менопаузы у женщин и примерно с 60–65лет у мужчин костное рассасывание опережает процессы костеобразованияи происходит естественная возрастнаяубыль костной ткани. Все эти процессы находятся под жестким контролембольшинства вырабатываемых в организме гормонов, их посредников –системных ростовых факторов, а также местных факторов, вырабатываемыхсамими костными клетками. Поэтомупочти все заболевания эндокриннойсистемы, сопровождающиеся избыточной или недостаточной продукцией гормонов, приводят к нарушениюобменных процессов в костной ткани,могут становиться причиной развитияОП и его осложнений – переломовкостей. Чаще всего эндокринологи занимаются диагностикой, профилактикой и лечением ОП, являющегося проявлением или осложнением тех илииных эндокринных заболеваний, т. е. вторичного ОП. Среди причин вторичного ОП болезни эндокринной системы занимают одно из первых мест.
Наиболее распространенной эндокринной патологией считаются болезни щитовидной железы (ЩЖ). С точкизрения возникновения ОП существенным фактором риска признается повышение функции ЩЖ при диффузном или узловом токсическом зобе.Показано, что у женщин, перенесших тиреотоксикоз, особенно длительнонераспознанный или плохо леченный, в пожилом возрасте значительно чаще имеют место переломы шейкибедра. Трийодтиронин (Т3) влияет нафункцию остеобластов непосредственно через тиреоидные рецепторы-α, ана остеокласты – через стимуляцию цитокинов, вовлеченных в остеокластогенез. Тироксин (Т4) является прогормоном для Т3 и обладает в 100 разменьшей аффинностью к ядернымрецепторам тиреоидных гормонов.Регулятор деятельности ЩЖ тиреотропный гормон (ТТГ) необходим дляразвития железы и продукции гормонов, но его внетиреоидные эффектыдо последнего времени были неизвестны. Недавно проведенные экспериментальные работы на животныхи культурах костных клеток человека обнаружили экспрессию рецептора кТТГ на остеобластах и остеокластах.Опыты на культурах костных клетокмышей показали, что ТТГ оказывает непосредственное воздействие какна остеобласты, так и на остеокласты, в результате чего подавляетсядифференцировка остеокластов и остеобластов из их предшественников.Отмечено, что у мышей, лишенныхрецептора к тиреоидным гормонам,нарушались рост костей и минерализация костной ткани без нарушенийремоделирования.
Клиническое значение измененияуровня ТТГ для костной ткани остается спорным. Существует ряд исследований, посвященных выявлениюфакторов риска ОП, в которых оценивалось влияние сниженного уровняТТГ на минеральную плотность кости(МПК) и переломы у женщин в менопаузе. В частности, при анализе результатов лабораторных тестов крупногоисследования по переломам (FractureIntervention Trial – FIT), включившего 15 316 женщин в постменопаузе
(55–80 лет), выявлено, что у пациенток со сниженным уровнем ТТГ (учитывался как ТТГ < 0,1 мЕД/л, так ипогранично низкий ТТГ < 0,5 мЕД/л)МПК в шейке бедра и МПК по программе “все тело” были значимо ниже, чем при нормальном содержании ТТГ.
Среди заболеваний ЩЖ наиболее часто встречаются узловые зобы и аутоиммунные тиреоидиты со снижением функции ЩЖ, при которыхчасто назначаются тиреоидные гормоны. Как оказалось, длительный (более10 лет) прием этих препаратов в дозах,превышающих 100 мкг (Т4), повышает риск развития ОП, особенно у женщинв постменопаузе. Поэтому таким больным необходимо проводить профилактику ОП наряду с назначением тиреоидных препаратов. В нашем центре была проведена работа, посвященнаядифференцированной оценке влияния субклинического тиреотоксикоза (уровень ТТГ ниже нижней границы референсных значений при нормальных значениях свободных Т3 и Т4) на костный метаболизм и МПК в зависимостиот этиологии заболевания. Были обследованы 89 женщин в постменопаузе, изкоторых 22 не имели нарушений функции ЩЖ и составили группу контроля,а у остальных был диагностирован субклинический гипертиреоз различной этиологии (болезнь Грейвса, узловойтоксический зоб, супрессивная тиреоидная терапии после тиреоидэктомиипо поводу рака ЩЖ). Было показано, что женщины в постменопаузе сэндогенным субклиническим тиреотоксикозом имеют статистически значимо более низкие показатели МПК по сравнению с группой контроля.Наиболее выраженное снижение МПКнаблюдалось в дистальных и проксимальных отделах кортикальной кости.
МПК у больных, получавшихсупрессивную терапию тироксином,не отличалась от таковой в группе контроля. Уровень маркеров костеобразования и костной резорбции был статистически значимо выше у женщинв постменопаузе с субклиническимтиреотоксикозом, чем в группе контроля. Выраженность изменения маркеров костного метаболизма и МПКу женщин в менопаузе со сниженным уровнем ТТГ зависела от этиологиитиреотоксикоза. Таким образом, субклинический эндогенный тиреотоксикоз у женщин в постменопаузе можноотнести к факторам риска ОП и считать показанием к проведению остеоденситометрии аксиальных и периферических отделов скелета.
Вторым по распространенности, нонаиболее опасным по своим последствиям среди эндокринных заболеваний является сахарный диабет (СД).Когда СД развивается в детском илимолодом возрасте (СД типа 1; СД1), вего основе лежит абсолютная недостаточность инсулина, гормона, необходимого и для развития костей. В связис этим большинство таких больныхподвержены ОП, особенно при снижении у них функции почек, что требует ранней профилактики и своевременного лечения ОП при СД. Раньшесчитали, что при СД типа 2 (СД2), когда у пациентов много инсулина, но он плохо усваевается тканями,ОП возникает редко. Большое значениев патогенезе ОП при СД обоих типов придают гликированию коллагена, а также склонности к падениям из-за нарушений зрения, полинейропатии, ангиопатии сосудов нижних конечностей. Последние исследования свидетельствуют о более высокой частоте остеопоротических переломов как приСД1 (отношение рисков = 6,00), так ипри СД2 (отношение рисков = 1,77).
Важным фактором риска развитияОП в любом возрасте как у женщин, таки у мужчин является недостаток выработки половых гормонов. Показано,что при т. н. идиопатическом ОП у мужчин в 40–60 % случаев находятгипогонадизм. Хотя диагностикой илечением многих форм гипогонадизмазанимаются и гинекологи, и урологи, ключевой фигурой в ведении этих заболеваний и профилактике ОП приних является эндокринолог. Основнымвидом лечения гипогонадизма и связанного с ним ОП признают правильноподобранную заместительную терапию половыми гормонами и их аналогами.Однако в ряде случаев при тяжелыхформах ОП, вызванных недостаточностью половых гормонов, для восстановления обмена в костной тканиприходится дополнительно назначатьдругие средства.
Наиболее тяжелые формы ОП вэндокринологии встречаются приизбыточной продукции надпочечниками глюкокортикоидов (болезнь, илисиндром, Иценко–Кушинга). При этойпатологии быстро развиваются переломы тел позвонков, ребер, уменьшается рост, беспокоят сильные боли в спине и ребрах.
Схожая картина наблюдается упациентов с глюкокортикоидным ОП,возникающим при лечении гормонаминадпочечников различных заболеваний, встречающихся в практике ревматолога, пульмонолога, гематолога,гастроэнтеролога и врачей ряда других специальностей. Особенность ОП приболезни Иценко–Кушинга состоит втом, что при успешном лечении заболевания наблюдается восстановлениекостной ткани и новые переломы ужене возникают. Следует отметить, что при подготовке к основному лечениюдля улучшения клинического состояния пациента применяется широкийспектр антиостеопоротических препаратов, в т. ч. назальный спрей кальцитонина (Миакальцик), который быстро ликвидирует костные боли и повышает двигательную активность.
Тяжелый вариант остеопатии развивается и при гиперпаратиреозе,который может проявляться только поражением костей с различными патологическими переломамиили сочетанием костной патологии с
поражением почек (почечнокаменная болезнь), желудочно-кишечного тракта. Особенность этого заболевания – резкое нарушение обмена кальция и фосфора, вызванное повышением выработки паратиреоидного гормона околощитовидными железами. В последние годы гиперпаратиреоз выявляется значительно чаще, чем раньше, более часто распознаются его нетяжелые формы. В настоящее время считается, что первичный гиперпаратиреоз – третье по распространенности эндокринное заболевание после патологии ЩЖ и СД. Это связано с более частым исследованием кальция в крови, особенно у пациентов с подозрением на ОП. Если раньше почти 95 % пациентов с установленным первичным гиперпаратиреозом оперировали в связи с выраженными костными и висцеральными проявлениями, то сегодня за рубежом в 80 % случаев диагностируют асимптомные и мягкие формы. Последние проявляются остеопенией и, как правило, требуют консервативного антиостеопоротического лечения. По данным нашего центра, в последние 5 лет до 65 % случаев первичного гиперпаратиреоза представлены мягкими и асимптомными формами.
Возможности ранней диагностики различных форм ОП существенно возросли в связи с широким внедрением в клиническую практику остеоденситометрии – измерения плотности костной ткани. Однако для уточнения причины ОП и выбора правильного лечения необходимы биохимические и гормональные исследования. Одним из простых, но важных методов выяснения природы ОП считают биохимическое исследование крови с обязательным определением кальция, фосфора, активности щелочной фосфатазы, определение выделения кальция с суточной мочой. Далее специалист, в частности эндокринолог, при необходимости может назначить другие методы обследования. Очень часто можно услышать такую фразу: “У Вас нормальный кальций в крови, Вы не нуждаетесь в лечении или профилактике ОП”. Это неверно, т. к. определение в крови и моче уровня кальция и фосфора необходимо для выяснения причин ОП, его дифференциальной диагностики с другими заболеваниями костной ткани, но не для установления диагноза ОП или остеопении.
Эндокринолог в своей практике использует весь арсенал средств для лечения и профилактики ОП, владеет методами как гормональной, так и негормональной терапии первичной и вторичной его форм. Ведь первичный (постменопаузальный и сенильный) ОП, также является следствием гормонального дефицита или нарушений фосфорно-кальциевого обмена на фоне недостаточности витамина D.
Для профилактики любого вида ОП, в т. ч. эндокринного, в первую очередь рекомендуется здоровый, рациональный образ жизни с достаточным потреблением белка, кальция, витамина D, по возможности с регулярными занятиями физкультурой и исключением вредных привычек. Очень важным фактором профилактики ОП при наличии хронических эндокринных заболеваний является их максимальная компенсация с использованием адекватных доз лекарственных препаратов.
Среди медикаментозных методов профилактики ОП на первом месте стоят препараты кальция и витамин D. Однако эти средства не пригодны для лечения уже развившегося ОП. В зависимости от выраженности ОП, наличия его осложнений и сопутствующих заболеваний только специалист назначает лечебные антиостепоротические препараты. По показаниям эндокринологи используют все препараты, зарегистрированные в России для лечения ОП.
Фармакотерапия ОП предполагает решение следующих задач:
1. Предотвращение новых переломовкостей, что достигается замедлением или прекращением потери массы костной ткани, улучшением качества кости и повышением ее прочности;нормализацией нарушенных процессов костного ремоделирования.
2. Улучшение качества жизни пациента, расширение его двигательной активности, максимальное восстановление способности к самообслуживанию при клинически выраженном ОП.
3. Удобство приема препарата и, соответственно, повышение приверженности лечению.
Критериями выбора лекарственного препарата для лечения ОП являются эффективность, безопасность и комфортность его применения.
Все средства патогенетической терапии и профилактики ОП по преобладающему механизму действия можно условно разделить на три группы:
1. Преимущественно угнетающие костную резорбцию – селективные модуляторы эстрогенных рецепторов (СМЭР), кальцитонины, бисфосфонаты.
2. Стимулирующие костеобразование – терипаратид (1–34 паратгормон).
3. Многопланового действия – активные метаболиты витамина D, стронция ранелат.
Идеальный препарат для лечения ОП должен способствовать восполнению значительных потерь костной массы и тем самым предупреждать переломы костей, положительно влиять как на трабекулярные, так и на кортикальные костные структуры, обладать минимальной токсичностью, действовать только на костную ткань. В качестве критериев оценки эффективности лечения практическому врачу доступны лишь суррогатные показатели, в частности прибавка МПК при двухэнергетической рентгеновской денситометрии и динамика маркеров костного обмена в зависимости от механизма действия препарата. Практический опыт показал, что не всегда большая прибавка МПК приводит к снижению риска остеопоротических переломов, например, при применении фторидов. Поэтому в многоцентровых слепых плацебо-контролируемых рандомизированных исследованиях с большой статистической мощностью, продолжавшихся не менее трех лет, оценивалась способность препарата снижать риск переломов наряду с его влиянием на суррогатные критерии. Данные об эффективности современных антиостепоротических препаратов, полученные в рандомизированных плацебо-контролируемых исследованиях, представлены на табл. 1.
Таблица 1. Данные по эффективности различных препаратов для профилактики и лечения постменопаузального ОП.
Следует обратить внимание на некорректность сравнения эффективности препаратов на основании исследований, проведенных с различными критериями включения в разное время. Тем не менее, согласно Российским клиническим рекомендациям по ОП, антиостеопоротические препараты подразделяются на средства первой и второй линий терапии. Также выделяются средства профилактики ОП (табл. 2). Следует отметить, что каждый препарат имеет свои особенности с точки зрения механизма действия, а также дополнительные полезные и нежелательные эффекты.
Наиболее часто в странах Западной Европы и Северной Америки для лечения установленного ОП назначаются бисфосфонаты в силу их изученности, длительного опыта применения, большой доказательной базы по антипереломной активности (табл. 1), разнообразия способов (внутрь, внутривенно) и кратности (ежедневно, 1 раз в неделю, 1 раз в месяц, 1 раз в 3 месяца, 1 раз в год) введения в организм.
Бисфосфонаты способны избирательно связываться с костным минералом, что обеспечивает им значительное преимущество в лечении заболеваний костной ткани. Основная клеткамишень для воздействия бисфосфонатов – остеокласт. Во время костной резорбции создается кислая среда, что значительно увеличивает диссоциацию бисфосфоната из гидроксиаппатита. Остеокласт захватывает бисфосфонат (наиболее вероятно с кальцием и костным матриксом), а затем азотсодержащий бисфосфонат блокирует фермент фарнезилпирофосфатсинтазу, что приводит к ухудшению функции остеокласта, уменьшению разрушения кости и последующему апоптозу остеокласта. Кроме того, имеются данные о способности бисфосфонатов увеличивать выживаемость остеоцита и предупреждать потери костной ткани у женщин в постменопаузе.
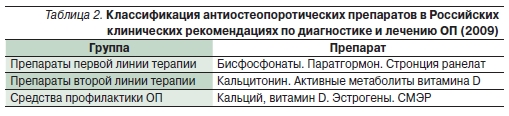
Среди недавно зарегистрированных средств для лечения ОП большой интерес вызывает стронция ранелат – препарат с доказанной эффективностью в отношении снижения риска переломов. Однако точный механизм действия этого препарата еще предстоит установить. Существует предположение, что стронция ранелат разобщает костный обмен, несколько подавляя костное разрушение и стимулируя костеобразование. Это разнонаправленное действие убедительно доказано в эксперименте. Так, в исследовании Brenan и соавт. на культуре костных клеток показано, что антирезорбтивный эффект стронция ранелата реализуется через усиление экспрессии остеопротегерина и снижение экспрессии RANKL (лиганд рецептора активатора фактора транскрипции ƙВ). Обсуждается вопрос вовлеченности кальцийчувствительного рецептора в механизмы влияния стронция ранелата на костную ткань. В III фазе клинических исследований (SOTI и TROPOS, включивших более 7000 пациенток с ОП в постменопаузе) в результате 3-месячного лечения стронцием ранелатом уровень костноспецифической щелочной фосфатазы умеренно, но
статистически значимо повысился, и этот эффект сохранялся в течение трех лет исследования. Маркер разрушения костной ткани (С-концевой телопептид коллагена типа 1) в такой же степени снизился (рис. 1).
Однако в новом исследовании Recker и соавт., в котором сравнивали влияние на костный обмен заведомо анаболического препарата – терипаратида (20 мкг подкожно) и стронция ранелата (2 г внутрь), были получены другие данные. Лечение терипаратидом привело к повышению уровня маркера костеобразования аминотерминального пропептида коллагена типа 1 (PINP) уже через месяц (+57 %; p < 0,001). В группе стронция ранелата наблюдалось снижение уровня PINP через 3 (-14 %; p < 0,005) и 6 месяцев (-19 %; p < 0,001), несколько уменьшился и уровень маркера костного разрушения – С-концевого телопептида коллагена типа 1 (-11 % через 3 и 6 месяцев; p < 0,05 для 3-го и 6-го месяцев).
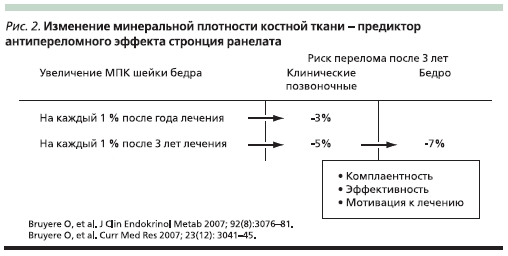
Существуют доказательства, что эффективность стронция ранелата тем значительнее, чем выше прирост МПК. Из данных, представленных на рис. 2, следует, что на каждый 1 % прироста МПК в шейке бедра через год лечения стронция ранелатом на 3 % снижается риск клинических переломов тел позвонков. А через 3 года терапии на каждый 1 % прироста МПК риск позвоночных переломов снижается на 5 %, переломов бедренной кости – на 7 %. Прибавка МПК в определенной степени обусловлена заменой атомов кальция на таковые стронция в кристаллической решетке, а т. к. атомы стронция тяжелее атомов кальция, денситометр демонстрирует заведомо лучший результат (увеличение МПК до 14 % за 3 года), но даже после пересчета на атомный вес сохраняется прирост МПК в позвонках за указанный срок на 6–8 %. Также предполагают, что противопереломная эффективность стронция ранелата может быть обусловленной именно механическим увеличением твердости кости за счет атомов стронция. Это создает предпосылки к пролонгированию противопереломной эффективности после отмены препарата до 5 (сохраняется 50 % препарата) или даже 10 лет (33 %). В проспективных исследованиях доказано достоверное снижение ОР переломов позвонков на 41–49 % и внепозвоночных переломов – на 19 %, а в группах повышенного риска – на 36 %
(для бедренной кости). На основе клинических исследований по оценке эффективности стронция ранелата проведено много субпопуляционных анализов. Показан антипереломный эффект препарата вне зависимости от возраста пациентов, исходных показателей костного обмена, МПК, наличия или отсутствия предшествующих переломов и их количества. Прослежено сохранение эффективности стронция ранелата при длительности лечения до 5 лет. В настоящее время уже есть опыт 8-летнего беспрерывного лечения этим препаратом. Абсолютных противопоказаний к применению стронция ранелата нет. С осторожностью его необходимо использовать при наклонности к тромбозам и тромбоэмболиям, диарее.
К препаратам с многоплановым действием на костную ткань и мышцы относят активные метаболиты витамина D (альфакальцидол и кальцитриол).
В соответствии с Европейскими клиническими рекомендациями по ОП альфакальцидол показан при первичном ОП у лиц старше 65 лет в следующих случаях:
• снижение функции почек (уровень креатинина у женщин и мужчин > 150 и 200 мкмоль/л соответственно;
• нет увеличения экскреции кальция с мочой или уменьшения уровня паратгормона через 6–8 недель от начала терапии нативным витамином D в дозе 600–1000 МЕ/сут;
• развитие интоксикации при применении эффективных доз холекальциферола.
Интерес к применению активных метаболитов витамина D возвращается в связи с обнаружением их плейотропных эффектов у пожилых людей, в частности способности положительно влиять на функцию мышц и таким образом предупреждать падения у пациентов старшей возрастной группы.
С учетом последних литературных данных, в Российских клинических рекомендациях по ОП альфакальцидол и кальцитриол позиционируются как препараты второй линии. При этом указывается, что активные метаболиты витамина D способны замедлять скорость костной потери при первичном и глюкокортикоидном ОП, уменьшают частоту переломов позвонков и внепозвоночных переломов кроме перелома шейки бедра у лиц с этими вариантами ОП (с разной степенью доказательности). При лечении необходим контроль уровня кальция в крови через 2, 6 и 8 недель лечения, затем – 1 раз в 3 месяца.
В настоящее время разрабатываются препараты для лечения ОП с принципиально новым механизмом действия. Так, завершены клинические исследования III фазы нового препарата деносумаб – моноклональных антител к RANKL, необходимого для активации остеокластов. Препарат продемонстрировал эффективность в плацебо-контролируемом исследовании с участием 7867 женщин в постменопаузе, снизив ОР переломов позвонков на 68 %, бедра на 40 % и других внепозвоночных переломов на 20 %. Деносумаб вводится подкожно 1 раз в 6 месяцев; ожидается его регистрация в России.
Многообещающим средством представляется и одaнaкатиб – ингибитор катепсина К, вещества, выделяемого остеокластами для разрушения костного матрикса. Пилотные исследования у женщин в постменопаузе показали, что он снижает уровень маркеров костной резорбции на 80 %. Препарат применяется один раз в неделю в любое время после еды.
При тяжелом постменопаузальном, сенильном, глюкокортикоидном ОП нередко возникает необходимость в назначении анаболических препаратов. В этой области ведутся исследования по созданию перорального аналога паратгормона – агониста кальцийчувствительных рецепторов. Предполагается, что он будет способен обеспечить анаболический эффект, сходный или даже лучший, чем при введении фрагмента паратгормона подкожно. Поиск новых антирезорбтивных и еще более эффективных анаболических препаратов продолжается; изучаются новые пути влияния на остеокласт и остеобластогенез. Однако большинство из них еще находится на уровне теоретических разработок.
Таким образом, эффективное предупреждение новых переломов у пациентов с ОП возможно уже сегодня, и есть все основания с оптимизмом смотреть в будущее.


