Актуальность
Важную роль в предупреждении развития осложнений сахарного диабета 2 типа (СД2) играет достижение и удержание целевых значений гликемического контроля. По современным представлениям, недостижение целей гликемического контроля служит основанием интенсификации сахароснижающей терапии [1, 2]. В Алгоритмах специализированной медицинской помощи больным сахарным диабетом, 10-е издание, пациентам с СД2, не достигшим целевых значений гликемического контроля на терапии пероральными сахароснижающими препаратами (ПССП) или на терапии ПССП в сочетании с базальным инсулином (БИ), может быть назначена фиксированная комбинация агониста рецептора глюкагоноподобного пептида-1 (арГПП-1) и БИ [3]. Стартом инъекционной терапии СД2 нередко является назначение БИ, что позволяет достигать адекватного уровня глюкозы плазмы натощак (ГПН), но не обеспечивает коррекции постпрандиальной гипергликемии. Это может приводить к недостижению целевого уровня гликированного гемоглобина (НbА1с) [4]. Согласно рекомендациям Американской диабетической ассоциации, начинать инъекционную терапию целесообразно с назначения арГПП-1, а при необходимости назначения БИ оправданна комбинация арГПП-1 и БИ [4]. На сегодняшний день в Российской Федерации доступны фиксированные комбинации инсулина деглудек с лираглутидом (иДегЛира) и инсулина гларгин 100 ЕД/мл с ликсисенатидом (иГларЛикси). Препарат иГларЛикси показан к использованию как в монотерапии, так и в комбинации с метформином и/или препаратами группы ингибиторов натрий-глюкозного котранспортера 2-го типа (иНГЛТ-2) при лечении взрослых пациентов с СД2. Существенным преимуществом фиксированных комбинаций арГПП-1 и БИ служит удобство терапии за счет введения 1 раз в сутки, что способствует повышению приверженности лечению.
Исследование SOLO – это ретроспективное когортное исследование, проведенное на территории Российской Федерации (Москва) для оценки показателей больных СД2, которые начали получать терапию препаратом Соликва СолоСтар® (инсулин гларгин+ликсисенатид в дозировке 100 ЕД/мл+33 мкг/мл или 100 ЕД/мл+50 мкг/мл иГларЛикси) в период с ноября 2018 по июль 2020 г., и оценки его эффективности на протяжении 6 и 12 месяцев использования в условиях реальной амбулаторной практики. Частью данного исследования стал описательный анализ основных результатов в различных подгруппах пациентов в зависимости от исходного HbA1c и возраста пациентов.
Цель исследования: в данной работе оценивали динамику показателей углеводного обмена, а также безопасность использования иГларЛикси в отдельных подгруппах пациентов: с разным уровнем HbA1c до назначения препарата (7–<8%, 8> 9%, ≥9%) и разных возрастных группах (<65 и ≥65 лет).
Методы
В ретроспективное когортное исследование в условиях реальной амбулаторной практики (SOLO) включены пациенты с СД2, которые в период с ноября 2018 по июль 2020 г. начали получать препарат иГларЛикси (индексное событие) в Москве. Дизайн исследования SOLO был опубликован ранее [8]. Пациентов включали в исследование при условии наличия ретроспективных данных не менее чем за 180 дней (6 месяцев) до индексного события. Данные для исследования получали из медицинских карт и историй болезни пациентов.
Исследуемые параметры: социально-демографические показатели (возраст, пол), анамнез СД2, общий медицинский анамнез (данные о наличии сопутствующих заболеваний, HbA1c, ГПН, масса тела, индекс массы тела – ИМТ), параметры терапии препаратом иГларЛикси (дата начала лечения, тип используемой шприц-ручки, доза и ее титрация, окончание терапии), другие препараты, применяемые в терапии СД2, терапия сопутствующих заболеваний, оказание медицинской помощи (амбулаторные приемы, госпитализация, скорая и неотложная помощь), эпизоды гипогликемии.
Полностью ретроспективный сбор основан на дате индексного события (даты начала терапии препаратом иГларЛикси в период набора пациентов. Индексное событие – начало терапии препаратом иГларЛикси.
Критерии включения в исследование: СД2, возраст ≥18 лет, терапия иГларЛикси начата с ноября 2018 по июль 2020 г., доступная ретроспективная медицинская информация за период ≥180 дней до старта терапии иГларЛикси, уровень HbA1c ≥7% в течение 90 дней до и/или в течение 14 дней после начала терапии иГларЛикси, наличие ≥1 результата уровня HbA1c в течение 150–210 дней после старта терапии препаратом иГларЛикси.
Критерии исключения: ранее проведенная терапия фиксированной комбинацией иДегЛира или иГларЛикси, СД1 и другие формы диабета, гестационный сахарный диабет.
Первичная конечная точка: динамика уровней НвА1с и ГПН через 6 месяцев после старта терапии иГларЛикси в отдельных подгруппах пациентов. Вторичные конечные точки в исследовании: динамика уровней НbА1с и ГПН через 12 месяцев после старта применения иГларЛикси, динамика массы тела через 6 и 12 месяцев, особенности титрации дозы препарата; эпизоды гипогликемии. Оценка безопасности проводимой терапии включила учет всех эпизодов гипогликемии, внесенных в электронную историю болезни. Проводился анализ зарегистрированных симптоматических гипогликемий (уровень глюкозы крови ≤3,9 ммоль/л), а также тяжелых гипогликемий.
Эффективность и безопасность иГларЛикси были также оценены в отдельных подгруппах пациентов:
- • пациенты с исходно разными уровнями HbA1c: 7–<8% (n=35), 8–<9% (n=158) и ≥9% (n=183);
- • пациенты в возрасте <65 лет (n=277) и ≥65 лет (n=106).
Категориальные признаки представлены в виде числа случаев (n) и частот (%). Непрерывные переменные представлены с использованием средних значений, стандартного отклонения (СО), медианы, квартилей и диапазонов значений. Выполнены статистические тесты – парный и непарный t-тесты. Для оценки эпизодов гипогликемии и получения медицинской помощи применены модели счетных данных. Статистический анализ выполнен с использованием R: языка и среды программирования для статистических расчетов (R Foundation for Statistical Computing, Vienna, Austria. URL https://www.R-project.org/) версии 4.0.2. Порогом статистической значимости различий считается значение р<0,05.
Результаты
Анализ результатов проведен в 3 группах пациентов: с исходным уровнем HbA1c 7–<8% (n=35), 8–<9% (n=158) и ≥9% (n=183). По основным исходным характеристикам (полу, возрасту, ИМТ) все три группы пациентов были сопоставимыми. Уровень HbA1c в группах исходно составил 7,69±0,23%, 8,47±0,26 и 9,1±0,91% соответственно. Медиана стартовой дозы препарата иГларЛикси составила от 10 до 24 ЕД, поддерживающей дозы – 34 ЕД в группе с исходным уровнем HbA1c 7–<8% и 40 ЕД в группах с более высоким уровнем HbA1c исходно.
Во всех группах с исходно разными уровнями HbA1c через 6 и 12 месяцев после перевода на терапию препаратом иГларЛикси отмечено статистически значимое снижение HbA1c (p<0,001). Исходные значения HbA1c, а также динамика в группах представлены на рис. 1.
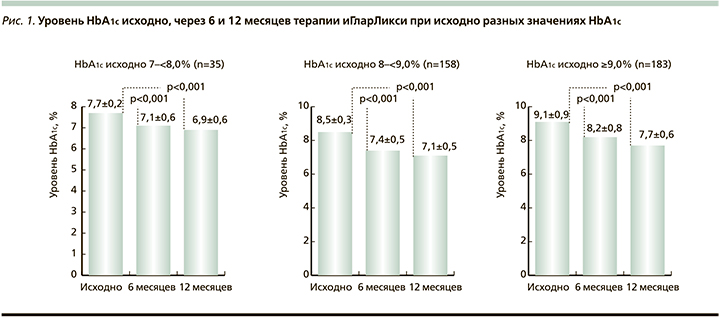
Таким образом, через 12 месяцев терапии препаратом иГларЛикси среднее снижение уровня HbA1c в 3 группах составило -0,86%, -1,33 и -2,26% (при исходном HbA1c 7–<8%, 8–<9%, ≥9% соответственно). Снижение уровня ГПН также было статистически значимым (p<0,001) через 6 и 12 месяцев после изменения терапии в группах с исходно разными значениями HbA1c. Через 12 месяцев терапии снижение ГПН в группах составило -1,52 ммоль/л, -1,95 и -3,09 ммоль/л (при исходном HbA1c 7 и <8%, 8 и >9%, ≥9% соответственно).
В качестве одного из критериев эффективности терапии иГларЛикси оценена доля пациентов, достигших уровня HbA1c <7,0%, <7,5 и <8,0%. Доля пациентов, достигших определенного уровня HbA1c, значительно различалась в группах с исходно разными значениями HbA1c. Выявлена четкая зависимость доли пациентов, достигших уровня НbА1с менее 7,0% и 7,5% от исходного уровня НbА1с. Доля больных, достигших через 12 месяцев уровня HbA1c <7,0%, составила в группе с исходным 7–<8% 53,3%, при исходном HbA1c 8–<9% – 28,1%, при HbA1c ≥9,0% исходно – 3,0%. Доля больных, достигших через 12 месяцев уровня HbA1c <7,5% составила в группе с HbA1c 7–<8% 83,3%, при исходном HbA1c 8–<9% – 78,1%, при HbA1c ≥9,0% – 30,3%. HbA1c<8,0% достигли в группе с HbA1c 7–<8% 96,7%, при исходном HbA1c 8–<9% – 95,9%, при HbA1c ≥9,0% – 65,5%.
Анализ результатов проводился в двух группах: в группе пациентов в возрасте <65 (n=277) и ≥65 лет (n=106). Уровень HbA1c исходно был 9,13± 1,07% в группе <65 лет, 9,18±1,12% в группе ≥65 лет. Уровень ГПН составил исходно 9,42±1,87 и 9,76±1,71 ммоль/л в группах соответственно. Длительность СД2 в группе пациентов <65 лет была 9,2±5,8, в группе ≥65 лет – 12,1±7,3 года. Исходно у пациентов <65 лет ИМТ составлял 36,9±6,6 кг/м2, в группе ≥65 лет 34,8±5,3 кг/м2.
В группах пациентов в возрасте <65 и ≥65 лет при переводе на терапию препаратом иГларЛикси отмечено статистически значимое снижение HbA1c (p<0,001) через 6 и 12 месяцев.
Исходные значения HbA1c, а также динамика в группах представлены на рис. 2.
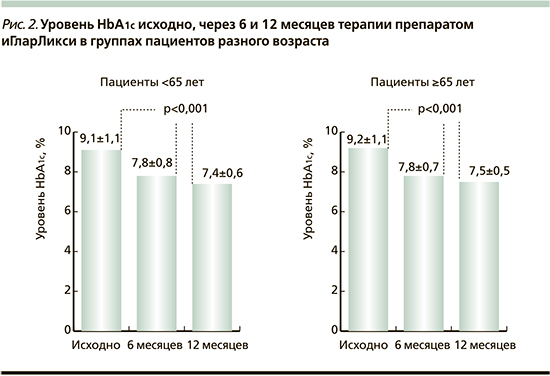
Через 12 месяцев терапии иГларЛикси снижение уровня HbA1c в группе пациентов <65 лет составило -1,76%, в группе ≥65 лет -1,68%.
В группах пациентов разного возраста при переводе на терапию препаратом иГларЛикси отмечено статистически значимое снижение ГПН (p<0,001) через 6 и 12 месяцев. Через 12 месяцев терапии иГларЛикси снижение ГПН в группе пациентов <65 лет составило -2,4 ммоль/л, в группе ≥65 лет -2,68.
Доля пациентов, достигших через 12 месяцев уровня HbA1c <7,5%, в группах <65 лет составила 57,9%, в группе ≥65 – 49,4%, доля пациентов, достигших через 12 месяцев уровня HbA1c <8,0%, в группе <65 лет составила 80,6%, в группе ≥65 лет – 83,9%.
На протяжении исследования отмечено статистически значимое снижение массы тела от исходных значений при переводе на терапию иГларЛикси во всех изучаемых группах пациентов (табл. 1).
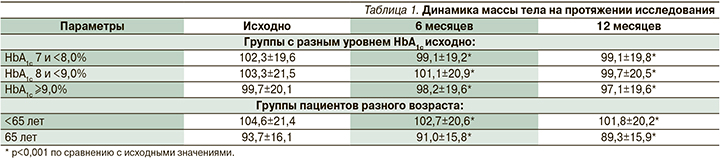
Через 12 месяцев терапии в группе пациентов с исходным HbA1c 7 и <8,0% снижение массы тела составило в среднем -3,8 кг, в группе HbA1c 8 и <9,0% -3,76 кг, в группе HbA1c ≥9,0% -2,39 кг. В среднем снижение массы тела в группе <65 лет составило через 12 месяцев -3,05 кг, в группе ≥ 65 лет -3,36 кг. Число случаев гипогликемии проанализировано отдельно в группах пациентов с исходно разными уровнями HbA1c и разного возраста (табл. 2).

Исходно число пациентов с подтвержденными симптоматическими гипогликемиями (уровень гликемии ≤3,9 ммоль/л) в разных подгруппах составило от 2 (5,71%) до 28 (25,2%) человек. Число пациентов с симптоматическими гипогликемиями на фоне терапии препаратом иГларЛикси в подгруппах с разными исходными уровнями HbA1c не превышало 1–2 человек (0,63–2,86%); В подгруппах пациентов <65 и ≥65 лет гипогликемии на фоне терапии иГларЛикси развились у 3 и 1 пациента соответственно.
Исходно число пациентов с тяжелыми гипогликемиями во всех подгруппах составило от 6 (2,21%) до 12 (10,81%) человек. После перевода на терапию иГларЛикси ни одного эпизода тяжелой гипогликемии зарегистрировано не было.
Обсуждение
По данным многочисленных рандомизированных клинических исследований, применение фиксированной комбинации гларгина 100 и ликсисенатида (иГларЛикси) характеризуется высокой сахароснижающей эффективностью и безопасностью [5–7]. Вместе с тем с клинической точки зрения важны и результаты исследований реальной клинической практики.
По данным ретроспективного исследования SOLO, в реальной амбулаторной практике применение препарата иГларЛикси пациентами с СД2, не достигших целевых значений гликемического контроля на ПССП или ПССП в комбинации с БИ, приводило к улучшению показателей гликемического контроля без увеличения массы тела и числа гипогликемических состояний. В данной работе проведен анализ эффективности и безопасности использования иГларЛикси в подгруппах пациентов с разным уровнем HbA1c до назначения препарата и в разных возрастных группах.
При оценке эффективности показано, что терапия препаратом иГларЛикси во всех анализируемых группах пациентов через 6 и 12 месяцев привела к значимому улучшению показателей гликемического контроля: снижению уровней HbA1c и ГПН. Также во всех анализируемых подгруппах пациентов через 6 и 12 месяцев отмечено статистически значимое снижение массы тела от исходных значений.
Частота гипогликемии проанализирована во всех подгруппах пациентов с разной степенью компенсации углеводного обмена исходно, в возрасте до и старше 65 лет с длительностью СД менее и более 5 лет. Во всех подгруппах применение препарата иГларЛикси сопровождалось низким риском гипогликемий; эпизоды тяжелых гипогликемий на терапии иГлрЛикси не зарегистрированы.
К ограничениям данного исследования относятся описательный характер статистического анализа, ретроспективный дизайн и отсутствие групп сравнения. Ретроспективный дизайн не дает возможности полноценной оценки частоты гипогликемических состояний, как до момента старта иГларЛикси, в процессе титрации дозы и дальнейшей терапии данным препаратом.
Заключение
В реальной амбулаторной практике применение фиксированной комбинации гларгина 100 ЕД/мл и ликсисенатида пациентами с СД2 в группах с исходно разными уровнями HbA1c в возрасте моложе и старше 65 лет приводило к значительному улучшению показателей гликемического контроля без увеличения массы тела и числа гипогликемических состояний.
Конфликт интересов. Анциферов М.Б. входил в состав экспертных советов, организованных компаниями Boehringer Ingelheim, Eli Lilly, Novo Nordisk, Sanofi, Takeda, Lifescan, Novartis, MSD, Astellas, Merck, Abbott, AstraZeneca; участвовал в клинических исследованиях компаний Boehringer Ingelheim, AstraZeneca, Novartis, MSD, Takeda, Герофарм, Bristol – Мауеrs Squibb; выступал в качестве председателя мероприятий в рамках конференций, съездов, конгрессов, организованных при участии компаний Eli Lilly, AstraZeneca, Novartis, Novo Nordisk, MSD, Sanofi, Boehringer Ingelheim, Eli Lilly, Abbott, Lifescan, Ascensia, Roche, Astellas, Takeda, Mersk, Ipsen, Stada, Promomed. Демидов Н.A. входил в состав экспертных советов, организованных Boehringer Ingelheim, Novo Nordisk, Sanofi, Novartis, Astra Zeneca и читал лекции для компаний: Boehringer Ingelheim, Eli Lilly, Novo Nordisk, Sanofi, Novartis, Astra Zeneca, Герофарм, MSD, Abbot, Medtronic, Элта. Сафронова Т.И. сотрудничала как лектор с компаниями Boerhinger Ingelheim, Eli Lilly, Novo Nordisk, Sanofi. Мишра О.А. сообщила об отсутствии конфликта интересов.
Финансирование. Исследование спонсировалось компанией Sanofi, Париж, Франция. Спонсор принимал участие в разработке протокола. Первый черновой вариант рукописи был подготовлен ООО «Лиганд Ресерч» при поддержке компании Sanofi.


