Введение
За последние годы во всем мире наблюдается закономерный рост частоты субклинического первичного гиперпаратиреоидизма (ГПТ) и выявлением морфофункциональных поражений сердечно-сосудистой системы при нормальных и/или умеренно повышенных значениях паратиреоидного гормона (ПТГ) в крови [1–3].
В связи с этим возникает потребность в уточнении уровней ПТГ, позволяющих дифференцировать клинически выявляемый ГПТ, в т.ч. на ранней стадии, от референсных значений ПТГ [4, 5]. Известно, что уровни ПТГ в зависимости от применяемых методов лабораторной диагностики и тест-систем колеблются в широком диапазоне [2, 4]. Также показано, что предельно-допустимые верхние уровни нормы ПТГ в крови у пациентов с субклиническими поражениями сердечно-сосудистой системы различаются [6, 7]. Поэтому для описания клинических ситуаций, проявляющихся неспецифическими признаками ГПТ, и сопровождающихся ремоделированием сердца и сосудов были предложены различные термины: асимптомный ГПТ, мягкий ГПТ, малосимптомный ГПТ и т.д. [3, 5, 8].
Показано, что нарушения регуляции кальциевого обмена, проявляющегося клинически выраженным ГПТ, вызывают морфофункциональные поражения сердца и артерий [9]. Одними из ключевых регуляторов кальциевого обмена в организме являются паращитовидные железы и синтезируемый ими ПТГ [2, 4]. Доказана роль первичного ГПТ в патогенезе и развитии осложнений со стороны кардиоваскулярной системы [10, 11]. В частности, повышенный уровень ПТГ может способствовать развитию артериальной гипертензии (АГ), провоцировать декомпенсацию систолической дисфункции левого желудочка и тем самым может быть неблагоприятным фактором риска смертности [6, 12, 13].
Морфофункциональные поражения сердца и сосудов, обусловленные первичным ГПТ, возникают благодаря взаимодействию циркулирующегося в крови гормона паращитовидных желез с ПТГ-рецепторами, расположенными в миокарде, миоцитах и эндотелиальных клетках сосудов [3, 14]. Кроме того, повышенные уровни ПТГ плазмы выявляются у пациентов кардиометаболическим синдромом, который является мощным фактором кардиоваскулярного риска [1, 2].
Действительно, ПТГ непосредственно вовлечен в широкий спектр сосудистых изменений, таких как эндотелиальная дисфункция, ремоделирование сосудов и кальцификация сосудов, которые приводят к развитию атерогенеза и артериальной жесткости [9, 15, 16]. Относительный вклад сосудистых изменений в увеличение частоты сердечно-сосудистых заболеваний, вызванных ПТГ, все еще обсуждается, но все больше данных подтверждают ключевую роль эндотелиальной дисфункции даже на ранних этапах хронического воздействия более высоких уровней ПТГ.
Цель исследования: оценить показатели морфофункционального ремоделирования сердца и артериальной стенки у пациентов эссенциальной АГ в сочетании с первичным субклиническим ГПТ.
Методы
В открытое клиническое исследование включено 88 пациентов (51 мужчина и 37 женщин) в возрасте от 45 до 60 лет (средний возраст – 52,6±4,1 года). Согласно клиническим рекомендациям «Артериальная гипертензия у взрослых» (2020) [17], у 32 (36,4 %) пациентов диагностирована I степень АГ, у 56 (63,6%) – II степень, у 43 (48,9%) – I стадия (неосложненная) и у 45 (51,1%) – II стадия (бессимптомная).
Протокол исследования был одоб-рен Локальным этическим комитетом института. Все пациенты подписывали информированное согласие на участие в исследовании. Критериями невключения в исследование являлись: ассоциированные клинические состояния при АГ; остеопатии, сопровождающиеся нарушениями кальциевого обмена; патология щитовидной железы.
Содержание ПТГ в венозной кро-ви определяли иммуноферментным методом с помощью тест-системы DSL-10-8000 ACTIVE I-PTH (США), для которой референсные значения ПТГ составляют от 9,5 до 75 пг/мл.
Концентрацию общего кальция в крови определяли колориметрическим методом, используя тест-набор «Calcium FL-E» (Vital Diagnostics SPh). Содержание неорганического фосфора в крови определяли фотометрическим методом с помощью анализатора Roche Cobas-8000 (Roche Diagnostics, Швейцария), референсные значения которого у взрослых составляют 0,81–1,45 ммоль/л. При этом соблюдались условия подготовки пациентов к проведению анализов. Также определяли суточный кальцийурез, который у взрослых здоровых в норме составляет от 2,5 до 7,5 ммоль/сут.
В нашем исследовании абсолютные значения ПТГ в крови разных пациентов колебались от 5 до 78 пг/мл. Для оценки возможного влияния уровня ПТГ на структурно-функциональное ремоделирование сердца и сосудистой стенки пациентов разделили на три группы.
В 1-й (28 пациентов) группе содержание ПТГ в крови составило от 5 до 20 пг/мл, что соответствует 10-му перцентилю, во 2-й (37 пациентов) – от 21 до 55 пг/мл (11–89-й перцентили) и в 3-й (23 пациента) – от 56 пг/мл до верхнего референсного значения, соответствующего 90-му перцентилю (табл. 1).
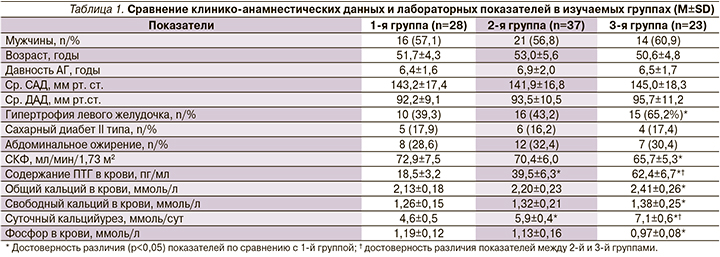
Необходимо отметить, что средние уровни ПТГ в крови женщин и мужчин среди обследованных пациентов отличались недостоверно: 40,4±18,4 против 37,4±17,7 пг/мл соответственно (р>0,05). Также достоверных различий по возрасту и давности АГ в сравниваемых группах не выявлено. Гипертрофия левого желудочка (ГЛЖ) выявлялась у 41 (46,6%) пациента, в т.ч. у 26 (51,0%) мужчин и у 15 (40,5%) женщин. Частота ГЛЖ в 3-й группе по сравнению с 1-й была достоверно выше: 65,2 против 39,3% (χ2=4,40; р=0,036). В сравниваемых группах среднесуточные показатели систолического и диастолического артериального давления (Ср. САД, Ср. ДАД) были почти сопоставимыми. Содержание ПТГ в крови и суточный кальцийурез в 3-й группе были достоверно выше по сравнению с остальными группами.
Допплер-эхокардиографию проводили на аппарате ALOKA 1700 SSD (Япония) в В- и М-режимах и использовали датчики 3,5 и 7,0 МГц. ГЛЖ диагностировали, если индекс массы миокарда левого желудочка (ИММЛЖ) у женщин составил более 95 г/м2 и у мужчин более 115 г/м2 [17]. С учетом величин ИММЛЖ и относительной толщины стенок (ОТС) ЛЖ определяли структурно-геометрические типы ЛЖ. Также вычисляли толщину межжелудочковой перегородки (ТМЖП) и задней стенки ЛЖ (ТЗСЛЖ), фракцию выброса (ФВ), сердечный индекс (СИ), объем левого предсердия (ЛП), конечный диастолический и конечный систолический размеры ЛЖ (КДР ЛЖ, КСР ЛЖ), удельное периферическое сосудистое сопротивление (УПСС). Для оценки диастолической функции ЛЖ вычисляли максимальную скорость быстрого и медленного кровенаполнения (Ve, Va), их соотношение (Ve/Va), время изоволюмического расслабления (IVRT) и время замедления потока в фазу быстрого кровенаполнения (DT).
Эндотелий-зависимую вазодилатацию (ЭЗВД) плечевой артерии (ПА) оценивали методом D.S. Celemajer et al. [16], используя пробу с реактивной гиперемией. Также определяли толщину комплекса интима-медиа (КИМ) и диаметр просвета общей сонной артерии (ОСА), отношение толщины стенки к диаметру просвета ОСА и пиковую систолическую скорость кровотока. Скорость клубочковой фильтрации (СКФ), определяемая по формуле CKD-EPI, у обследованных пациентов была выше 60 мл/мин/1,73 м2.
Суточное мониторирование АД проводили с помощью прибора BPLab (ООО «Петр Телегин», Россия) в стандартном режиме [17]. Интервалы между измерениями АД составляли 30 минут в дневное время и 60 – ночью. Вычисляли средние показатели САД и ДАД за сутки, день и ночь; степень ночного снижения САД и ДАД; индекс времени «нагрузки давлением» САД и ДАД; средние значения ЧСС за сутки, день и ночь; вариабельность САД и ДАД.
Статистическую обработку полученных данных проводили с помощью компьютерной программы Statistica 8.0 и Excel для Windows. Достоверность различий между двумя независимыми выборками при нормальном распределении определяли с помощью t-критерия Стьюдента и при асимметричном распределении – U-критерия Манна–Уитни. Для сравнения трех или более выборок использовали критерий Крускала–Уоллиса. Для сравнения долей применяли точный критерий Фишера и критерий хи-квадрат (χ2) Пирсона. Анализ связей переменных проводили с помощью ранговой корреляции Спирмена (R). Данные представлены в виде M±SD. Различие считалось достоверным при p<0,05.
Результаты исследования
По данным суточного мониторирования АД, у 38 (43,2%) пациентов выявлен суточный профиль АД типа диппер, у 43 (48,9%) – нон-диппер и у 7 (7,9%) – найт-пикер. С учетом типов суточного профиля АД уровни ПТГ в крови отличались недостоверно (p<0,05) и при типе диппер составило 35,5±12,0 пг/мл, при нон-диппер – 44,9±17,7 и найт-пикер – 37,3±16,5 пг/мл.
Изучение структурно-геометрических особенностей ЛЖ выявило концентрическую ГЛЖ у 29 пациентов, эксцентрическую у 12, концентрическое ремоделирование ЛЖ у 11 и нормальную геометрию у 36 пациентов. При этом в 3-й группе относительно чаще выявлялась концентрическая ГЛЖ (из 29 случаев ГЛЖ в 69,0%). Однако различие по типам геометрии ЛЖ в группах было недостоверно, что возможно, объясняется небольшой выборкой участников исследования.
При сопоставлении эхокардиографических показателей в группах наибольшие величины ТЗСЛЖ и ТМЖП отмечены у пациентов 3-й группы, которые превышали таковые в 1-й группе в среднем на 9,6% (p=0,011) и 10,9% (p=0,006) соответственно (табл. 2). Несмотря на отсутствие достоверных различий показателей КДР ЛЖ и КСР ЛЖ, величина ИММЛЖ у пациентов 3-й группы по сравнению с 1-й и 2-й была выше в среднем на 13,9% (p=0,003) и 8,0% (p=0,026) соответственно. Объем левого предсердия в группах различался недостоверно (p>0,05), хотя оказался выше во 2-й и 3-й группах по сравнению с 1-й. Различие показателей систолической функции ЛЖ − СИ и ФВ – в группах было недостоверным, что, возможно, объясняется однородным составом пациентов и отсутствием застойной сердечной недостаточности у пациентов, включенных в исследование.
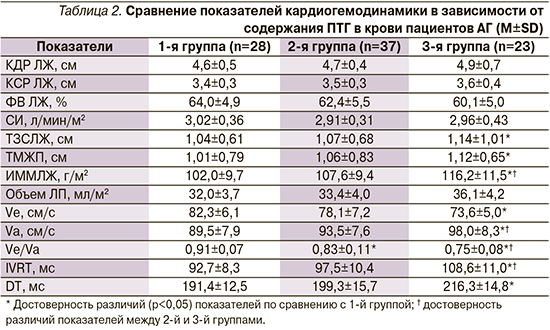
При оценке диастолической функции ЛЖ выявлено достоверное различие показателей трансмитрального диастолического потока в 3-й группе по сравнению с остальными группами. При этом отмечено более выраженное нарушение диастолической функции в 2-й и 3-й группах.
Показано, что по мере повышения содержания ПТГ достоверно уменьшаются показатели Ve и отношение Ve/Va, наоборот, увеличиваются показатели Va, IVRT и DT, что свидетельствует о нарушении релаксации миокарда ЛЖ.
Так, у обследованных пациентов диастолическая дисфункция ЛЖ (ДДЛЖ), связанная с нарушением активной релаксации миокарда, диагностировалась у 61 (69,3%) пациента, в т.ч. в 1-й группе у 15 (53,6%) пациентов, во 2-й у 27 (73,0%) и в 3-й группе у 19 (82,6%) пациентов. При этом различие частоты ДДЛЖ в сравниваемых группах недостоверно (p>0,05).
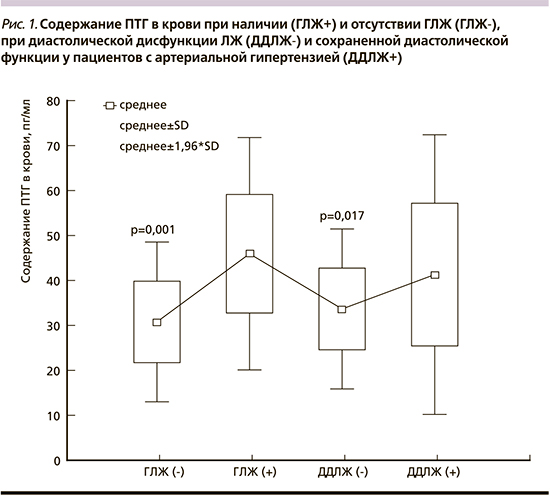
При сравнительной оценке у пациентов, имевших ДДЛЖ, выявлены достоверно более высокие уровни ПТГ, чем при сохраненной (интактной) диастолической функции ЛЖ: 41,3±15,9 и 33,6±9,1 пг/мл соответственно (p=0,017) (рис. 1). Кроме того, у пациентов с ГЛЖ содержание ПТГ в крови было достоверно выше, чем у пациентов с нормальной геометрией ЛЖ: 45,9±13,2 и 30,8±9,1 пг/мл соответственно (p=0,001).
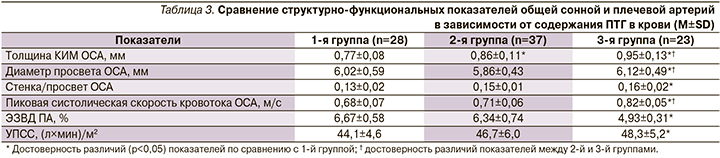
Как известно, развитие АГ тесно связано с ремоделированием сосудов и снижением вазомоторной функции эндотелия, что является одним из мощных патофизиологических механизмов прогрессирования АГ и поражения органов-мишеней [17]. При сравнительной оценке структурно-функциональных показателей ОСА и вазомоторной функции ПА с учетом содержания ПТГ выявлены признаки наиболее выраженного сосудистого ремоделирования в 3-й группе (табл. 3). Так, в 3-й группе по сравнению с 1-й показатели толщины КИМ и пиковой систолической скорости кровотока, отношение стенка/просвет были достоверно больше (в среднем на 23,4; 20,6 и 23,1% соответственно), а диаметр просвета ОСА и ЭЗВД ПА, наоборот, меньше (в среднем на 16,6 и 26,1% соответственно). При индивидуальной оценке в 1-й группе эндотелиальная дисфункция выявлена у 75,0% , во 2-й у 83,8% и в 3-й у всех пациентов (100%).
Изучение однофакторных корреляционных связей выявило наличие достоверной прямой зависимости между содержанием ПТГ и показателями ИММЛЖ (R=0,29; p=0,006), ТЗСЛЖ (R=0,45; p<0,001), ТМЖП (R=0,24; p=0,022) и толщины КИМ (R=0,57; p<0,001), IVRT (R=0,25; p=0,017) и обратной зависимости – с показателями ЭЗВД (R= -0,33; p=0,002) и Ve/Va (R= -0,61; p<0,001) (рис. 2). Кроме того, выявлены корреляции суточного кальцийуреза со структурно-функциональными показателями ЛЖ и сосудов. Однако корреляции содержания ПТГ в крови и среднесуточных показателей САД и ДАД не выявлено.
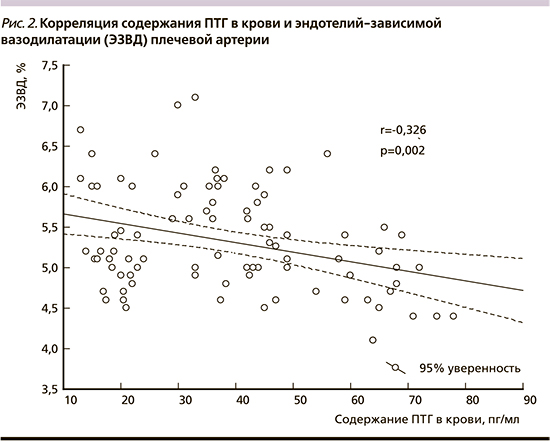
Таким образом, у пациентов с АГ неосложненного/бессимптомного течения выявлены корреляции уровня ПТГ с показателями ремоделирования ЛЖ и общей сонной артерии, а также эндотелий-зависимой вазодилатацией. Показано, что физиологически высокие уровни ПТГ, соответствующие 90-му перцентилю референсного диапазона ПТГ, ассоциируются с гипертрофией левого желудочка в 65,2% случаев, высокой частотой диастолической дисфункции ЛЖ и эндотелиальной дисфункции артерий.
Обсуждение
Результаты проведенного нами сравнительного исследования структурно-функционального состояния сердца и сосудистого русла у пациентов с эссенциальной АГ неосложненного/бессимптомного течения показали, что физиологически высокие уровни ПТГ, соответствующие 90-му перцентилю референсных значений ПТГ, ассоциируются с признаками структурно-функционального ремоделирования сердца и сосудистой стенки. Так, показано, что у пациентов с первичным ГПТ достоверно чаще выявляются ГЛЖ, нарушение диастолической дисфункции ЛЖ и снижение вазодилатирующей функции сосудистого эндотелия. Кроме того, выявлены взаимосвязи высоких референсных уровней ПТГ с высоким сердечно-сосудистым риском, развитием АГ и хронической сердечной недостаточности [1, 3, 5, 12]. По данным эпидемиологических исследований выявлено, что уровень ПТГ в крови достоверно коррелирует с массой миокарда ЛЖ [10]. Показано, что уровни ПТГ выше 97,5 перцентилей выявляются у трети мужчин с ГЛЖ, что косвенно подтверждает взаимосвязи высоких референсных уровней ПТГ плазмы и наличие ГЛЖ [18].
Следует отметить, что умеренно повышенные уровни ПТГ плазмы выявляются не только при наличии АГ, но и у лиц с нормальными показателями АД [7, 18]. Кроме того, у пациентов, подвергшихся паратиреоидэктомии, отмечается обратная динамика морфофункциональных изменений со стороны сердечно-сосудистой системы и улучшение прогноза при субклиническом ГПТ [2, 19, 20]. Так, мета-анализ 15 клинических контролируемых исследований, посвященных изучению влияния паратиреоидэктомии у пациентов с первичным ГПТ, выявил достоверное уменьшение ИММЛЖ в течение первых 6 месяцев после операции в среднем на 11,6 г/м2 [21]. Также показано, что величина уменьшения ИММЛЖ прямо коррелирует с высокими исходными уровнями ПТГ, а не с уровнем кальция в крови.
По данным клинических исследований установлено, что ПТГ вызывает нарушения функции сосудистого эндотелия, хотя механизмы полностью не выяснены [14, 22]. J. Gambardella et al. [14] в эксперименте установили, что предварительная обработка эндотелия аорты ПТГ приводит к нарушению эндотелиального ответа на брадикинин за счет перегрузки эндотелиоцитов кальцием и инактивации продукции оксида азота. Этим доказано, что ПТГ влияет на функцию эндотелия за счет продукции активных форм кислорода, вызванной перегрузкой митохондрий кальцием. Таким образом, ПТГ, участвуя в каскадной реакции окислительного стресса, может действовать как модификатор передачи сигналов, изменяя реакцию брадикининовых рецепторов на вазоактивные агенты.
G.B. Cansu et al. исследовали влияние паратиреоидэктомии на ремоделирование сонной артерии пациентов с бессимптомным первичным ГПТ [7]. Ими выявлено, что к концу 6-го месяца после оперативного лечения снижаются факторы риска субклинического атеросклероза, в частности, происходит уменьшение толщины КИМ и скорости распространения пульсовой волны, которое обратно коррелировало с исходным уровнем кальция в крови. Кроме того, уровни ПТГ и кальция в крови, а также исходные показатели толщины КИМ общей сонной артерии и скорости распространения пульсовой волны были достоверно выше, чем у здоровых лиц контрольной группы.
Анализ возможных причин развития морфофункциональных изменений кардиоваскулярной системы у пациентов с субклиническим ГПТ позволил выделить некоторые закономерности. Возможно, это объясняется повышенной чувствительностью кальций-зависимых рецепторов сердечно-сосудистой системы у пациентов с АГ даже при нормальных уровнях внеклеточного кальция. Также известно, что патофизиологическим механизмом гиперфункции паращитовидных желез может быть гиперактивация симпатической нервной системы [4]. Из-за короткого периода полураспада ПТГ, в доклинической стадии развития первичного ГПТ стабильно повышенной секреции ПТГ не отмечается. Поэтому у пациентов с субклиническим первичным ГПТ отсутствует гиперкальциемия [5]. Учитывая эти обстоятельства, необходимо проведение клинических исследований, позволяющих верифицировать высокие референсные и пороговые уровни ПТГ чтобы дифференцировать первичный ГПТ бессимптомного и/или малосимптомного течения.
Как известно, начальные проявления (субклинические) первичного ГПТ характеризуются нарушениями клеточных механизмов метаболизма кальция и при этом отсутствуют изменения со стороны органов (почки, кости, кишечник), участвующих в метаболизме кальция. Поэтому не наблюдаются характерных признаков клинически манифестирующего ГПТ. Тем не менее, исходя из доказанности корреляции показателей ремоделирования сердечно-сосудистой системы и умеренно повышенного уровня ПТГ представляется целесообразным выделять кардиоваскулярные признаки субклинического первичного ГПТ.
Заключение
Таким образом, выявлено неблагоприятное прогностическое влияние субклинического первичного ГПТ, проявляющегося высокой частотой и выраженностью ремоделирования кардиоваскулярной системы у пациентов с АГ. Поэтому целесообразно определение содержания паратиреоидного гормона и кальция в крови, суточного кальцийуреза для идентификации группы пациентов с субклиническим первичным ГПТ, что позволит оценить дополнительный сердечно-сосудистый риск и выбрать оптимальную тактику антигипертензивной терапии.
Вклад авторов. Концепция и дизайн исследования – Б.Г. Искендеров. Сбор и обработка материала – Н.В. Беренштейн. Статистическая обработка данных и обследование – И.Н. Можжухина. Написание текста – Б.Г. Искендеров.


