Введение
Латентный аутоиммунный диабет у взрослых (англ. latent autoimmune diabetes in adults, LADA; «диабет 1,5 типа») – сахарный диабет, симптомы и начальное течение которого соответствуют клинической картине диабета 2 типа (СД2), но при этом этиология лежит ближе к диабету 1 типа: обнаруживаются антитела к β-клеткам поджелудочной железы и ферменту глутаматдекарбоксилазе. По разным оценкам, в разных популяциях от 6 до 50% пациентов с диагнозом «диабет 2 типа» на самом деле поражены латентным аутоимунным диабетом взрослых [1]. Возможно, LADA представляет собой «мягкий» край спектра проявлений сахарного диабета 1 типа [2]. Главная тактика лечения больных LADA должна быть направлена на сохранение собственной секреции инсулина. Для этого необходимо своевременное назначение инсулинотерапии. Обсуждается вопрос о возможности использования препаратов периферического действия – бигуанидов и глитазонов, которые не вызывают истощения β-клеток, однако их эффективность пока не установлена. Назначение любых секретогенов противопоказано [3]. Здесь и кроется подвох амбулаторного лечения таких пациентов, ведь поставить диагноз можно лишь на основании сложных лабораторных обследований. В то же время маскировка диагноза и категорический отказ пациента от инсулинотерапии могут сыграть злую шутку с его здоровьем. К сожалению, пока нет больших исследований по правильному лечению LADA, которые оказали бы помощь в выборе терапии [3].
Поздний аутоиммунный диабет взрослых (LADA) представляет собой заболевание, патогенетически обусловленное аутоиммунным повреждением клеток островкового аппарата поджелудочной железы, характеризующееся медленнопрогрессирующим течением с конечным развитием клинической картины инсулиновой недостаточности. Основным критерием диагностики LADA-диабета является определение иммунологических маркеров аутоиммунного воспаления – GADab и ICAab. Выявление пациентов с LADA среди больных СД2 необходимо для более раннего назначения инсулинотерапии с целью преду-преждения развития инсулиновой недостаточности. Назначение малых доз инсулина больным LADA позволяет в значительной степени предохранить β-клетки от повреждающего воздействия медиаторов аутоиммунного воспаления и предотвратить процессы деструкции этих клеток. Метод определения GADab позволяет проводить массовые скрининговые исследования в группах риска с целью идентификации больных LADA на доклинической стадии заболевания и предупреждения появления инсулиновой зависимости [4].
Описание клинического случая
Пациент 34 лет. Диагноз СД2 был выставлен в декабре 2020 г., когда он обратился к эндокринологу с жалобами на полиурию и полидипсию. При этом в весе не терял. При измерении уровня гликемии по глюкометру имело место повышение до 16 ммоль/л. На момент обращения пациент страдал ожирением (индекс массы тела – 30,9 кг/м2). При расспросе о наличии СД у родственников пациент отрицает диагноз у отца, матери и сиблингов. Диабетом болеет тетя пациента по материнской линии (стаж диабета – 3 года, с возраста 64 лет).
По результатам первичной лабораторной диагностики – выраженная декомпенсация углеводного обмена (табл. 1). Также отмечен низкий уровень С-пептида. С-пептид (от англ. сonnecting peptide – связующий пептид) назван так потому, что соединяет α- и β-пептидные цепи в молекуле проинсулина. Этот белок необходим для осуществления в клетках поджелудочной железы синтеза инсулина – многоступенчатого процесса, на заключительном этапе которого неактивный проинсулин расщепляется с высвобождением активного инсулина. В результате этой реакции образуется равное инсулину количество С-пептида, в связи с чем этот лабораторный показатель используется для оценки уровня эндогенного инсулина. Уровень антител в β-клетках не определялся.
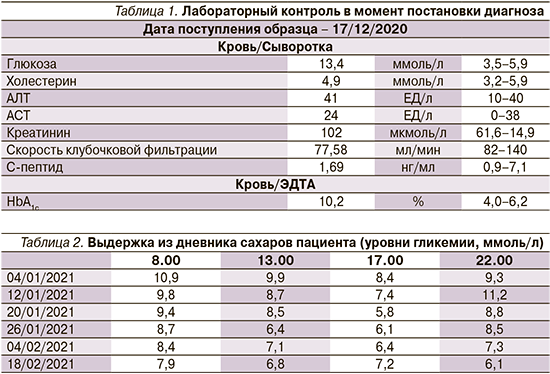
Индивидуальный подход к больному с определением индивидуального целевого уровня гликированного гемоглобина (HbA1c) должен служить основой выбора стратегии сахароснижающего лечения [4]. На основании полученных данных пациенту рекомендована инсулинотерапия (превышение уровня HbA1c более чем на 2,5%). Так как пациент, согласно режиму дня, имеет два основных приема пищи и легкий перекус в обед, принято решение о назначении препарата Райзодег в двух инъекциях. Начальные дозы по 6 ЕД подкожно перед завтраком и перед ужином. Рассматривались варианты комбинаций пероральных сахароснижающих препаратов, но после объяснения больному механизмов заболевания, патогенеза и перспектив течения сахарного диабета удалось убедить его в необходимости инсулинотерапии.
Пациент прошел цикл занятий в школе «Диабет» в январе 2021 г. Там он обучался правилам питания, введения инсулина, самоконтролю.
В течение 3 последующих месяцев пациент регулярно посещал амбулаторный прием врача по месту жительства. На каждом визите предъявлял дневник сахаров (табл. 2), демонстрировал технику введения инсулина.
На фоне изменения дозы инсулина в динамике отмечалось стабильное стойкое снижение уровней гликемии, приближавшихся к целевым показателям. Пациент строго соблюдал принципы рационального питания, занимался спортом. Ответственный подход к своему здоровью чрезвычайно важен для длительной компенсации, и данный пациент это отлично понимал.
Дальнейшее обследование пациента состоялось спустя 3 месяца (табл. 3). Согласно представленному дневнику сахаров, пациент приблизился к показателям компенсации, что наглядно подтвердили результаты лабораторного контроля. Дозировки инсулина Райзодега составляли 20 ЕД подкожно 2 раза в сутки.
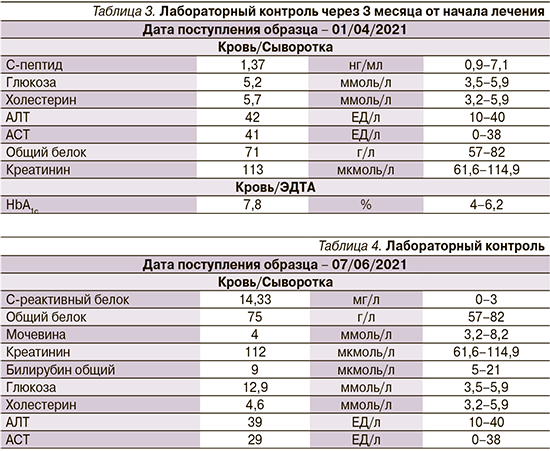
Отмечалось незначительное снижение уровня С-пептида с 1,69 до 1,37 нг/мл, что не могло не навести на мысль о необходимости верификации диагноза. Пациенту была предложена плановая госпитализация для обследования по хроническим осложнениям и уточнения диагноза. В связи со сложной эпидемио-логической обстановкой госпитализация была отложена. Пациент продолжал наблюдаться амбулаторно, вести дневник сахаров.
В июне 2021 г. пациент заболел новой коронавирусной инфекцией. По результатам лабораторных анализов (табл. 4), назначенных терапевтом, выявлена декомпенсация углеводного обмена.
Лабильность гликемии в период заболевания: максимальный уровень глюкозы натощак – 13 ммоль/л, в течение дня постпрандиально – до 25 ммоль/л. По данным компьютерной томографии, поражение легких соответствовало 1-й степени, лечился дома, получал противовирусную и антибиотикотерапию. На период лечения пациент самостоятельно добавил к терапии инсулин короткого действия по 6–8 ЕД подкожно 2–3 раза в сутки.
На прием к эндокринологу пациент явился в конце августа 2021 г. с жалобами на лабильность сахаров, полиурию, сильную слабость.
Отмеченное очередное снижение уровня С-пептида до 1,26 нг/мл (табл. 5), несмотря на инсулинотерапию, подталкивает к диагностике LADA-диабета. Также после перенесенной новой коронавирусной инфекции наблюдалось повышение уровня HbA1c до 8,6%, что свидетельствовало о неудовлетворительном контроле гликемии после положительной динамики до июня 2021 г.
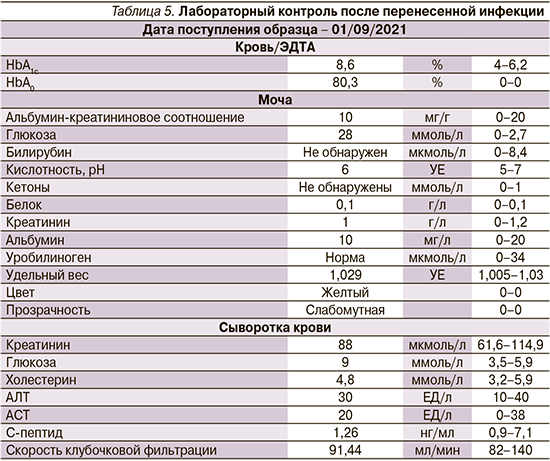
На основании полученных данных и оценки возможностей амбулаторной помощи пациенту выдано направление на плановую госпитализацию в ФГБУ «НМИЦ им. В.А. Алмазова», куда он поступил в сентябре 2021 г.
В ходе настоящей госпитализации с пациентом проводились беседы о необходимости соблюдения диеты, подсчета ХЕ, необходимости введения инсулина короткого действия на каждый прием пищи, регулярного измерения уровня гликемии, постоянного приема сахаро-снижающей терапии. Пациент комплаентен, изучал обучающую литературу в период госпитализации, обучился подсчету ХЕ, заинтересован в понимании природы собственного заболевания.
Оценен уровень антител к инсулину: 1,75 RU/ml (0–10), суммарные антитела к GAD/тирозинфосфатазе – 9,04 МЕ/мл (0–4), повышены.
Также была выполнена проба со стандартным завтраком на фоне отмены пероральной сахароснижающей терапии. Результаты пробы: С-пептид-фон – 0,98 нг/мл, через 60 минут – 1,67 нг/мл, через 120 минут – 2,10 нг/мл.
По результатам дополнительного обследования, с учетом дебюта заболевания, больших симптомов, наличия повышенного уровня антител к антигенам клеток поджелудочной железы, недостаточного повышения уровня стимулированного С-пептида сложилось представление о развитии у пациента LADA-диабета.
В рамках госпитализации была подобрана сахароснижающая терапия в базис-болюсном режиме. Кроме того, с учетом наличия ожирения 1-й степени инициирована терапия метформином 1000 мг утром и 1000 мг вечером, даны рекомендации по модификации образа жизни с целью снижения массы тела.
Пациент был обследован на предмет хронических осложнений диабета. Данных за диабетическую нефропатию обнаружено не было.
Пациент осмотрен офтальмологом: данных за диабетическую ретинопатию не получено.
Клинически при поступлении складывалось представление о наличии у больного сенсорной формы диабетической полинейропатии нижних конечностей с учетом жалоб на периодически возникающее чувство «мурашек», редких судорог в икроножных мышцах ночью, однако убедительных данных (включая проведение ЭНМГ) за поражение периферических нервов не получено. Тем не менее при выполнении количественного температурного тестирования нельзя исключать начальные проявления диффузного поражения тонких нервных волокон С- и А-дельта-типа на ногах, что служит признаком начального проявления сенсорной полинейропатии нижних конечностей. Рекомендовано контрольное исследование в динамике через 6–12 месяцев. Пациент во время госпитализации получал курс инфузий тиоктовой кислоты, также был пройден курс ЛФК, ФТО.
При выписке пациенту даны рекомендации в полном объеме, в т.ч. по питанию и дальнейшему наблюдению специалистов, физической нагрузке, самоконтролю.
После выписки инсулинотерапия в базис-болюсном режиме: Тресиба 12 ЕД вечером в 21.00, инсулин НовоРапид перед едой с учетом ХЕ и углеводного коэффициента 1:1. Также продолжился прием метформина по 1000 мг утром и вечером.
Для оценки углеводного обмена после госпитализации в октябре 2021 г. амбулаторно был использован сенсор непрерывного мониторинга.
Заключение
В результате проведенного лечения время нахождения пациента в целевом диапазоне значимо улучшилось. Отмечено отсутствие вариабельности и постпрандиальной гипергликемии.
Таким образом, пациент достиг значимых результатов по улучшению контроля уровня гликемии в отсутствие эпизодов гипогликемии. Больной отмечает улучшение самочувствия, увеличилась работоспособность, улучшилось настроение. Своевременное назначение инсулина (изначально выставлен диагноз «СД2»), несмотря на иные возможности, представленные в Алгоритмах специализированной медицинской помощи больным сахарным диабетом, сформировало правильный путь лечения.
Можно предположить, что появление и прогрессирование хронических осложнений СД будет приостановлено на период компенсации, удерживать которую сам пациент и лечащий врач намерены максимально долго. Для них теперь время в целевом диапазоне в периоде компенсации дороже золота.


