Введение
Опухоль Вильмса, или нефробластома, – одно из наиболее распространенных сόлидных злокачественных новообразований у детей, возникающих почти исключительно в почках [1]. Примерно в 5% случаев одновременно поражаются обе почки [2]. Развитие данной опухоли вне паренхимы почек встречается редко – до 0,5–1% всех случаев. С учетом казуистичности внеорганной локализации бόльшая часть литературы ограничена описаниями отдельных случаев. Например, сообщениями, когда опухоль развивается в паховой области, влагалище, яичнике, мочевом пузыре, параспинальном поясничном отделе, копчике и забрюшинном пространстве [3–10]. Поиск мировой литературы с использованием PubMed, Medline и Google показал, что на сегодняшний день задокументировано не менее 100 случаев [11]. В статье описывается случай 10-летнего мальчика с внепочечной опухолью Вильмса, расположенной в забрюшинном пространстве.
Клинический случай
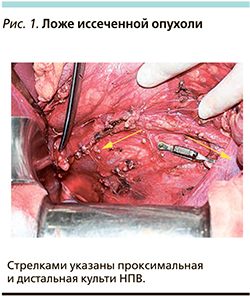 Больной М. 2010 г.р. с января 2020 г. отмечал боли в животе, увеличение живота в объеме. Родители обратились в поликлинику по месту жительства, где, по данным ультразвукового исследования (УЗИ) органов брюшной полости, выявлено образование забрюшинного пространства. Пациент обратился в поликлиническое отделение ТГФ РСНПМЦОиР, где ему была выполнена магнитно-резонансная томография органов брюшной полости с внутривенным контрастированием. В проекции правой почки выявлено образование округлой формы размером 11×11×15 см, негомогенное за счет гипотензивных участков и локальной зоны кальцинации с четкими и ровными контурами. Отмечалась вовлеченность правой почечной вены и нижней полой вены (НПВ). Почки с обеих сторон без признаков поражения. Правый надпочечник, печень и желчный пузырь оттеснены и сдавлены. При компьютерной томографии (КТ) органов грудной клетки в проекции VI, VIII, X сегментов правого легкого и II, III сегментов левого легкого отмечены единичные очаги диаметром от 0,5 до 1,5 см. Все лабораторные тесты были в пределах нормы, включая уровни α-фетопротеина, β-хорионического гонадотропина человека и катехоламинов мочи (ванилилминдальная кислота и гомованилиновая кислота). По данным гистологического заключения, после трепанбиопсии опухоли под УЗИ-навигацией опухоль была нефробластомой высокой степени злокачественности. Решением консилиума пациент был госпитализирован в хирургическое отделение детской онкологии с диагнозом «опухоль Вильмса, T4NхM1». После трех курсов предоперационной химиотерапии препаратами винкристин, актиномицин, доксорубицин наблюдался частичный эффект. Проведено хирургическое удаление забрюшинной опухоли с резекцией и эндопротезированием НПВ. При лапаротомии обнаружена большая опухоль забрюшинного пространства. При ревизии: опухоль ограниченно смещаема, сдавливает и оттесняет органы брюшной полости влево. Правая почка оттеснена вверх. Правый мочеточник сдавлен и оттеснен влево над брюшной аортой. Произвести адекватную ревизию, направленную на оценку состояния стенок НПВ и брюшной аорты, технически не представлялось возможным. Опухоль была мобилизована и иссечена острым путем с перевязкой и прошиванием патологических питающих сосудов. Брюшной отдел аорты мобилизован на всем протяжении, проксимально – до почечной артерии, дистально – до развилки подвздошных сосудов. Во время иссечения образования установлена инвазия опухоли в стенки НПВ. В связи с этим было решено произвести радикальное удаление опухоли с тотальной резекцией НПВ на протяжении 18 см, где проксимальный конец НПВ ниже печеночных вен на 2,5 см, дистальный конец – на уровне развилки брюшной аорты. Пациенту выполнено протезирование НПВ с пластикой левой почечной вены с использованием протеза Uni-Graft (Aesculap – B. Braun, Германия) по технологии двойного велюра с пропиткой рассасывающимся модифицированным желатином (рис. 1, 2).
Больной М. 2010 г.р. с января 2020 г. отмечал боли в животе, увеличение живота в объеме. Родители обратились в поликлинику по месту жительства, где, по данным ультразвукового исследования (УЗИ) органов брюшной полости, выявлено образование забрюшинного пространства. Пациент обратился в поликлиническое отделение ТГФ РСНПМЦОиР, где ему была выполнена магнитно-резонансная томография органов брюшной полости с внутривенным контрастированием. В проекции правой почки выявлено образование округлой формы размером 11×11×15 см, негомогенное за счет гипотензивных участков и локальной зоны кальцинации с четкими и ровными контурами. Отмечалась вовлеченность правой почечной вены и нижней полой вены (НПВ). Почки с обеих сторон без признаков поражения. Правый надпочечник, печень и желчный пузырь оттеснены и сдавлены. При компьютерной томографии (КТ) органов грудной клетки в проекции VI, VIII, X сегментов правого легкого и II, III сегментов левого легкого отмечены единичные очаги диаметром от 0,5 до 1,5 см. Все лабораторные тесты были в пределах нормы, включая уровни α-фетопротеина, β-хорионического гонадотропина человека и катехоламинов мочи (ванилилминдальная кислота и гомованилиновая кислота). По данным гистологического заключения, после трепанбиопсии опухоли под УЗИ-навигацией опухоль была нефробластомой высокой степени злокачественности. Решением консилиума пациент был госпитализирован в хирургическое отделение детской онкологии с диагнозом «опухоль Вильмса, T4NхM1». После трех курсов предоперационной химиотерапии препаратами винкристин, актиномицин, доксорубицин наблюдался частичный эффект. Проведено хирургическое удаление забрюшинной опухоли с резекцией и эндопротезированием НПВ. При лапаротомии обнаружена большая опухоль забрюшинного пространства. При ревизии: опухоль ограниченно смещаема, сдавливает и оттесняет органы брюшной полости влево. Правая почка оттеснена вверх. Правый мочеточник сдавлен и оттеснен влево над брюшной аортой. Произвести адекватную ревизию, направленную на оценку состояния стенок НПВ и брюшной аорты, технически не представлялось возможным. Опухоль была мобилизована и иссечена острым путем с перевязкой и прошиванием патологических питающих сосудов. Брюшной отдел аорты мобилизован на всем протяжении, проксимально – до почечной артерии, дистально – до развилки подвздошных сосудов. Во время иссечения образования установлена инвазия опухоли в стенки НПВ. В связи с этим было решено произвести радикальное удаление опухоли с тотальной резекцией НПВ на протяжении 18 см, где проксимальный конец НПВ ниже печеночных вен на 2,5 см, дистальный конец – на уровне развилки брюшной аорты. Пациенту выполнено протезирование НПВ с пластикой левой почечной вены с использованием протеза Uni-Graft (Aesculap – B. Braun, Германия) по технологии двойного велюра с пропиткой рассасывающимся модифицированным желатином (рис. 1, 2).
При патогистологическом исследовании хорошо очерченная масса составляла 940 г и имела размер 21×16×10 см с тонкой капсулой. На разрезе была плотной консистенции, напоминала саркоматозную ткань.
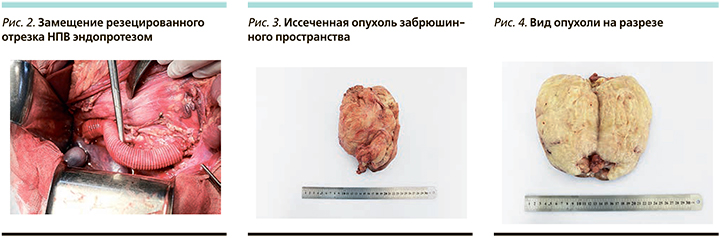
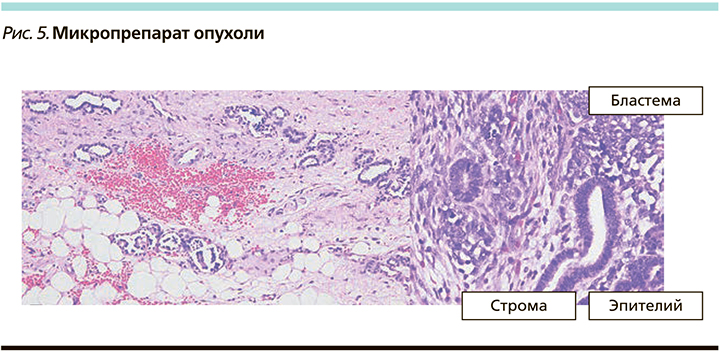
В парааортальной и паракавальной клетчатке – увеличенные лимфатические узлы до 2,5×2×3 см (рис. 3, 4). При микроскопическом исследовании опухоль имела характерный вид опухоли Вильмса с трехфазной гистологией, состоящей из почечной бластемы, эпителия и стромальных элементов. Кроме того, присутствовали метанефрические остатки, остатки эмбриональной почечной ткани (рис. 5). По данным иммуногистохимии, опухоль была отрицательной на WT-1.
В послеоперационном периоде пациент чувствовал себя хорошо и лечился в соответствии с протоколом терапии опухоли Вильмса с промежуточным риском (стадия III). После 6-го курса химиотерапии выполнена позитронно-эмиссионная томография/КТ всего тела с 18F-дезоксиглюкозой; данных за остаточную опухоль не получено. Общая продолжительность лечения составила 5 месяцев. Пациент находится под наблюдением. Продолжительность ремиссии составляет 8 месяцев.
Обсуждение
Экстраренальные опухоли Вильмса крайне редки, и их клиническая картина зависит от местоположения опухоли [12, 13]. Диагноз внепочечной опухоли Вильмса почти всегда ставится после резекции и гистологической оценки опухоли. С точки зрения эмбриогенеза опухоль Вильмса представляет собой сόлидную злокачественную опухоль, состоящую из производных нефрогенной ткани на разных степенях дифференцировки. Данные опухоли могут содержать не только разнообразные элементы тканей, присутствующих в нормальной почке, но и скелетные мышцы, хрящи, слизистый и многослойный плоский эпителий [14, 15]. Согласно Национальному исследованию опухолей Вильмса, диагноз «внепочечная опухоль Вильмса» (ВПОВ) должен соответствовать трем критериям. Во-первых, следует исключить первичную опухоль в почке, провести тщательную оценку как рентгенологически, так и во время операции, чтобы исключить первичную внутрипочечную опухоль с вторичными внепочечными метастазами или добавочную почку. Во-вторых, при гистологической оценке должен присутствовать трехфазный гистологический паттерн бластемы, эпителия и примитивной стромы, характерных для опухоли Вильмса, и наконец, при тщательном исследовании всей опухоли не должно быть никаких признаков тератомы или почечной карциномы [16].
Считается, что интраренальные опухоли Вильмса происходят из стойкой метанефрической бластемы, но гистогенез ВПОВ менее ясен. Согласно данным P.E. Andrews, ВПОВ возникает из гетеротопической метанефрической бластемы [16]. Также считается, что ВПОВ может происходить из стойких остатков мезонефрального протока [17]. Другое возможное происхождение, обсуждаемое в мировой литературе, связано с теорией покоя клеток Конхеймса, согласно которой клетки со стойким эмбриональным потенциалом подвергаются злокачественной трансформации [18].
У нашего пациента была классическая опухоль Вильмса (в резецированной массе были обнаружены бластемальные, эпителиальные и эмбриональные клетки). Гистологически опухоль Вильмса классифицируется как группа низкого, среднего и высокого рисков. Значимость данной гистологической классификации опухоли Вильмса, основанной на стратификации риска, признана обществом детской онкологии (SIOP) в Европе. Согласно протоколу SIOP, опухоли Вильмса могут относиться к опухолям низкого риска, если они полностью некротизировались после химиотерапии, могут относиться к опухолям промежуточного риска, если они трехфазные (бластемные, эпителиальные и эмбриональные клетки), что может иметь благоприятный исход. Сюда также входит очаговая анаплазия; что может быть опухолью высокого риска, если обнаружены только бластемальные клетки или имеется диффузная анаплазия, или присутствуют другие опухоли, такие как светлоклеточная саркома или рабдоидная опухоль почки [19]. Что касается генетических нарушений, в отличие от почечной опухоли Вильмса, обнаружено, что только несколько случаев ВПОВ экспрессируют ген – супрессор опухоли Вильмса WT1 [20].
Лечение опухоли Вильмса проводят в соответствии с протоколом стратифицированного риска, установленным Национальной исследовательской группой по изучению опухолей Вильмса (NWTS – National Wilms Tumor Study Group) в Северной Америке и SIOP в Европе. NWTS предпочитает на первом этапе хирургический подход с последующей адъювантной химио- и лучевой терапией на основании стадии заболевания.
И наоборот, подход SIOP заключается в назначении предоперационной химиотерапии с последующей хирургической резекцией и последующим адъювантным лечением. Обе группы продемонстрировали отличные результаты выживаемости.
Нашему пациенту после хирургического лечения проведена адъювантная химиотерапия. В послеоперационном периоде опухоль была классифицирована как стадия III промежуточного риска (инвазия за пределы капсулы опухоли с положительным парааортальным лимфатическим узлом) на основе системы стадирования SIOP. Согласно данным P.E. Andrews et al., прогноз ВПОВ сопоставим с тковым внутрипочечной опухоли Вильмса [16]. В настоящее время двухлетняя выживаемость пациентов с внутрипочечной опухолью Вильмса в целом превышает 90% [1, 2].
Выводы
Хотя ВПОВ бывает трудно диагностировать до операции, уместно предпологать это заболевание при оценке пациентов с бессимптомным вздутием живота, поскольку задержка с установлением диагноза может вызывать задержку соответствующей терапии.
Вклад авторов. Г.Г. Хакимова, Ш.Г. Хакимова – сбор и обработка материала, написание текста статьи. Х.Х. Саидов, Х.И. Джуманиезов, Г.А. Хакимов – лечение больного, редактирование текста.


