Введение
Первое описание язвенного колита (ЯК) было представлено Сэмюэлем Вилксом в 1859 г. в «Medical Times and Gazette» под названием «Патологические проявления в кишечнике мисс Бэнкс».
В 1925 г. B.Crohn и H. Rosenberg впервые описали случай колоректального рака (КРР) у больного ЯК. На сегодняшний день накоплены опыт и знания о распространенности, группах риска, тактике ведения этих пациентов. Известно, что существует ряд ключевых фенотипических признаков, которые отличают ВЗК-ассоциированный КРР от спорадического КРР: ВЗК-ассоциированный КРР встречается у людей более молодого возраста, чаще это синхроннные новообразования в толстой кишке. При ЯК КРР встречается чаще, чем при болезни Крона (БК). Отмечается высокая частота КРР при сочетании ЯК с первичным склерозирующим холангитом (ПСХ), который, как правило, ассоциирован с ВЗК.
Патофизиология ВЗК-ассоциированного КРР и генетическая предрасположенность
Еще в 1863 г. стало известно, что воспаление – предрасполагающее условие развития опухоли [1]. В настоящее время доказано, что не менее 20% всех видов злокачественных новообразований – это прямое следствие хронического воспалительного процесса [2]. Патофизиология КРР, ассоциированного с ВЗК, также сводится к канцерогенному эффекту воспаления. При этом тяжесть и протяженность воспаления служат существенным фактором риска развития колоректальной неоплазии при ВЗК, причем как на эндоскопическом, так и на гистологическом уровнях [3]. Этапы формирования КРР у больных ВЗК: хроническое воспаление, дисплазия низкой степени, дисплазия высокой степени, ВЗК-ассоциированный КРР (рис. 1). В то время как при спорадическом КРР основные этапы канцерогенеза – это аденома, карцинома. Ключевой отличительной особенностью ВЗК-ассоциированного КРР при сравнении со спорадическим КРР является воспаление, которое приводит к геномной модификации с последующим более быстрым и мультифокальным по своей природе развитием КРР [4].
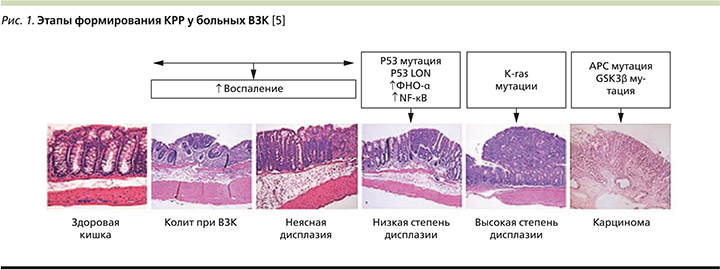
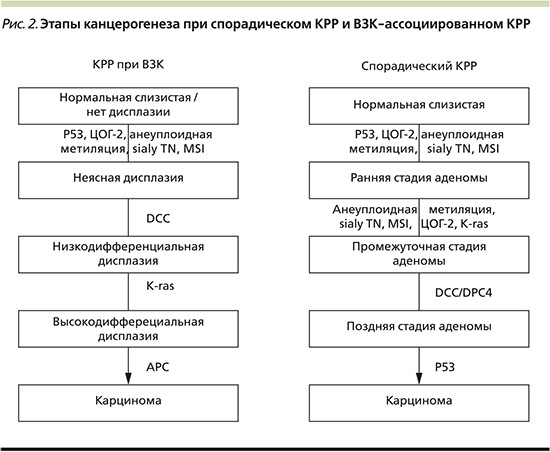
Практически все генные мутации, участвующие в патогенезе спорадического КРР, обнаружены и при раке толстой кишки, сформировавшемся на фоне ЯК. Хромосомная нестабильность характеризуется накоплением мутаций в специфических онкогенах (BRAF, KRAS, PI3K), генах, оказывающих супрессорное действие на опухоль (APC, DCC), и генах – регуляторах апоптоза (TP53). В исследовании, проведенном в 2018 г. в Великобритании, продемонстрировано, что, несмотря на отличительные гистологические особенности формирования КРР у больных ВЗК, у большинства пациентов существует высокая частота мутаций гена TP53, хотя мутации APC и KRAS также встречаются, но более редко [6]. Более того, хронология развития молекулярных нарушений при колит-ассоциированной неоплазии иная. Так, мутации АРС-гена при спорадическом КРР считаются ключевыми и наиболее ранними. А при ЯК они обнаруживаются на поздних стадиях дисплазии или при наличии злокачественного роста (рис. 2). Напротив, мутации гена ТР53 возникают значительно раньше, чем при спорадическом КРР [7]. Раннее выявление мутаций может стать мишенью для химиопрофилактики КРР. Как в зарубежной, так и в отечественной литературе предлагается внедрение в практику иммуногистохимических методов для выявления качественного и количественного определения р53-содержащих клеток в биоптатах. Однако этот метод выявления экспрессии протеина в качестве прогностического маркера ВЗК-ассоциированного КРР возможно использовать лишь в специализированных лабораториях и, к сожалению, он не может широко применяться как инструментальный скрининг [8].
Свою лепту в процесс канцерогенеза, безусловно, вносят молекулярные механизмы, связанные с непосредственным длительным повреждением ткани вследствие хронического воспаления и окислительного стресса [9–12]. При хроническом нерегулируемом воспалении через toll-подобные рецепторы (TLR) и фактор некроза опухоли α (ФНО-α) происходит активация ядерного фактора kB (NF-kB), что в конечном итоге индуцирует транскрипцию генов канцерогенеза, включая циклооксигеназу-2 (ЦОГ-2) [13, 14]. Образование псевдополипов, которое указывает на предшествующее тяжелое воспаление, связано с повышенным риском развития неоплазии [15].
Изменение кишечной микробиоты, по-видимому, также играет важную роль в развитии ВЗК-КРР [16]. Escherichia coli (E. сoli), по мнению ученых, индуцирует хроническое воспаление и способствует прогрессированию ВЗК в КРР. Липополисахариды грамотрицательной бактерии повышают экспрессию TLR-4 и NF-kB, что способствует канцерогенезу [17]. Такие микроорганизмы, как Streptococcus bovis и Fusobacterium nucleatum, также могут выступать в качестве провоспалительных факторов и способствовать канцерогенезу при ВЗК [18]. Традиционные культуральные методы анализа микробиоты позволяют идентифицировать не более 10–25% составляющих ее видов микроорганизмов, остальная часть, представленная анаэробами, ранее практически не была доступна идентификации из-за невозможности их культивирования.
Эпидемиология ВЗК-ассоциированного КРР
Мета-анализ 116 исследований с включением 54 478 больных ЯК выявил, что общая распространенность КРР среди всех больных ЯК составляет 3,7%, а у больных с тотальным ЯК увеличивается до 5,4%, причем вероятность развития рака возрастала с каждым десятилетием продолжительности ЯК [19]. Мета-анализ 34 исследований с включением 60 122 пациентов с БК выявил повышенный риск развития рака с локализацией в тонкой кишке, толстой кишке, а также внекишечной локализации рака и лимфомы. Исследования показали, что относительный риск развития КРР при БК в 2,5–4,5 раза выше, чем у здоровых людей [20], риск развития колоректальной неоплазии у пациентов с ВЗК увеличивается в 2–5 раз по сравнению с контрольной группой аналогичного возраста [21]. В исследовании J. Samadder продемонстрировано, что средний возраст на момент установления диагноза КРР был выше у пациентов без ВЗК, чем у больных с ВЗК (67,1 против 52,8 года, р<0,001). Почти у 20% больных КРР, ассоциированным с ВЗК, диагностируется ПСХ. Риск летального исхода после диагностирования КРР был в 1,7 раза выше у пациентов с ВЗК, чем у пациентов без ВЗК [22]. При этом 10–15% всех летальных исходов больных ВЗК обусловлены КРР [23].
Повышенный риск развития онкологических заболеваний у больных ВЗК выходит за пределы КРР. Внекишечная локализация рака у больных ВЗК (холангиокарцинома, лимфома, меланома и немеланомный рак кожи) встречается чаще, чем в общей популяции [15], и, как правило, служит следствием иммуносупрессивной терапии [24]. Злокачественные новообразования, ассоциированные с ВЗК, подразделяются на две группы: связанные с канцерогенным эффектом воспаления и связанные с иммуносупрессивной терапией. Первичная лимфома кишечника, ассоциированная с вирусом Эпштейна–Барр, вызвана как воздействием тиопуринов, так и канцерогенным эффектом воспаления.
Группы риска формирования ВЗК-ассоциированного КРР
Статистические данные представляют собой основу проведения и разработки мер профилактики КРР у больных ВЗК. Наиболее понятная и правильная стратегия ведения больных ВЗК с целью выявления дисплазии заключается в стратификации пациентов по группам риска формирования КРР.
Вероятность формирования КРР увеличивается у пациентов в сочетании ЯК с ПСХ; выявленной дисплазией при эндоскопическом и гистологическом исследованиях; высокой степенью активности заболевания; длительным анамнезом ВЗК; тотальным колитом; стриктурами или множественными воспалительными полипами при колоноскопии; семейным анамнезом КРР у родственников первой степени родства. Указанные факторы риска делают больного ВЗК в 1,5–2 раза более уязвимым к КРР, чем здоровую популяцию [25]. Семейный анамнез увеличивает риск развития КРР у пациентов с ВЗК примерно в 2–3 раза [26].
Согласно рекомендациям Рос-сийской гастроэнтерологической ассоциации и ассоциации колопроктологов России по диагностике и лечению ЯК [27], скрининг КРР у больных ЯК следует начинать после 6–8 лет от дебюта заболевания. Пациентам, страдающим ПСХ, регулярное контрольное обследование следует начинать раньше. Пациенты с поражением, ограниченным прямой кишкой, могут наблюдаться с той же периодичностью, что и здоровые люди, при условии, что прошедшее или активное воспаление проксимальнее прямой кишки исключено при эндоскопическом исследовании и биопсии остальных отделов кишки. Частота рутинных эндоскопических исследований диктуется степенью риска, оцениваемой при колоноскопии через 6–8 лет после начала ЯК (табл. 1).

Современные рекомендации Европейской организации по изучению ЯК и БК (European Crohn’s and Colitis Organization – ECCO), Американской гастроэнтерологической ассоциации (AGA), Британского общества гастроэнтерологии (BSG) сходятся во мнении, согласно которому скрининговую колоноскопию необходимо проводить больным ЯК через 8 лет после диагностирования тотального поражения толстой кишки или в момент постановки диагноза ПСХ, либо через 12–15 лет с момента установления диагноза левосторонних ЯК или БК с локализацией процесса в толстой кишке. Далее рекомендовано проводить колоноскопию каждые 1–5 лет [28]. Однако существуют расхождения в руководящих рекомендациях в этой области относительно временного интервала скринингового эндоскопического исследования (табл. 2) [29, 30].

Скрининговое эндоскопическое исследование следует проводить в период ремиссии ВЗК, когда эндоскописту и морфологу легче дифференцировать воспалительные изменения с неопластическими. Но в отсутствие ответа на терапию не стоит долго откладывать проведение обследования, поскольку активный воспалительный процесс повышает риск развития КРР [35]. Эффективность скрининговой колоноскопии зависит от ряда факторов: подготовки кишки к эндоскопическому исследованию; продолжительности осмотра; уровня подготовки врача-эндоскописта; адекватного выполнения биопсии слизистой оболочки толстой кишки для гистологического исследования; использования современных эндоскопических методик. Современные достижения в области эндоскопии (эндоскопия высокой четкости – HD, узкоспектральная эндоскопия – NBI, хромоэндоскопия) позволяют выявлять участки дисплазии [33]. Достижения в области скрининга КРР, а также появившиеся современные методы лечения ВЗК привели к снижению частоты КРР у пациентов с ЯК и БК.
Для скрининга неопластических изменений слизистой оболочки используются два подхода. Первый подход – традиционный скрининг КРР и наблюдение за пациентами с повышенным риском его развития включает четырехквадрантные биопсии (т.е. из 4 точек) каждые 10 см на всем протяжении ободочной и прямой кишки (при эндоскопии в белом свете), а также биопсию всех образований, подозрительных в отношении дисплазии или раннего рака.
Второй подход – проводят тотальную хромоколоноскопию с прицельной биопсией участков, подозрительных на неоплазию; это высокоэффективно в выявлении дисплазии и раннего КРР и позволяет сокращать число биопсий. Ряд исследований продемонстрировал, что динамическое эндоскопическое наблюдение увеличивает выживаемость пациентов с ВЗК-ассоциированным КРР [6]. Но, с другой стороны, эндоскопическое наблюдение для раннего выявления ВЗК-ассоциированного КРР сопряжено с трудностями и частота интервальных раковых заболеваний остается очень высокой [36], достигая 30%, несмотря на то что пациенты придерживаются протоколов наблюдения.
Профилактика ВЗК-ассоциированного КРР
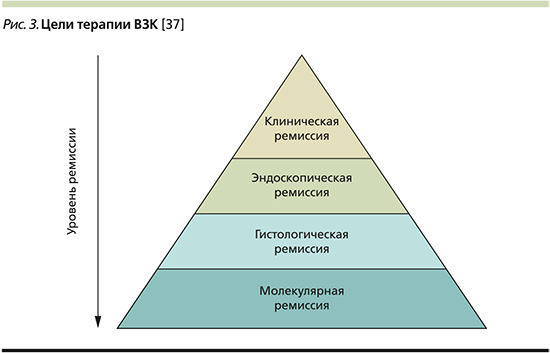
Отсутствие ремиссии и прогрессирующее течение заболевания создают угрозу необратимых изменений толстой кишки и развития осложнений у больных ВЗК. В 2015 г. Комитет по выбору терапевтических мишеней при ВЗК (Selecting Therapeutic Targets in IBD committee – STRIDE) определил основополагающий принцип терапии ВЗК – контроль над воспалением, основную цель лечения – восстановление качества жизни больного ВЗК, задачу лечения – достижение ремиссии и профилактика осложнений, а основной подход терапии – концепция treat-to-target (Т2Т) в контексте индивидуальных потребностей пациента. Поскольку микроскопические признаки активности заболевания могут сохраняться при макроскопически негативной картине, врач стремится и к эндоскопической, и к гистологической ремиссии. Ориентир в управлении ВЗК лишь на контроль симптомов не приводит к достижению цели терапии. Цель лечения ВЗК у пациентов и врачей одна – восстановление качества жизни, отсутствие клинических проявлений заболевания, и осуществляется она совместными усилиями: пациент контролирует клинические проявления, врач – биохимические, эндоскопические и гистологические маркеры заболевания. А в недалеком будущем цель терапии сместится в направлении молекулярной ремиссии (рис. 3). Формируются персонализированные схемы лечения, нацеленные на разрешение абдоминальной боли, нормализацию частоты стула, прекращение кровотечения, отсутствие изъязвлений при БК и заживление слизистой оболочки у больных ЯК (оценка по шкале Мейо 0 – оптимальная цель) с учетом тяжести заболевания, протяженности поражения, переносимости медикаментов, изменения образа жизни и диеты. Новая парадигма лечения ВЗК смещается от традиционного «step-up»-подхода к стратегии раннего вмешательства. Недавние исследования показывают, что использование биологических агентов, в частности тех, которые нацелены на ФНО-α, на ранних стадиях улучшает исходы лечения и может предотвратить прогрессирование необратимого повреждения кишечника [37]. Несмотря на то что стратегия раннего вмешательства имеет накопленные доказательства при БК, существует меньше доказательств, подтверждающих ее влияние при ЯК.
Обнаружено, что медиаторы воспаления играют ключевую роль в развитии ВЗК-ассоциированного КРР. Известно, что ежедневный прием аспирина значимо снижает риск КРР. Предполагается, что аналогичным образом аспирин профилактирует ВЗК-ассоциированный КРР [38]. В настоящее время нет убедительных данных об оптимальной дозе и времени приема аспирина для профилактики КРР. Предположительно нестероидные противовоспалительные препараты (НПВП) следует с этой целью принимать в течение длительного времени и в больших дозах, однако, с другой стороны, это приводит к появлению известных побочных эффектов и даже новой атаке ВЗК. Известно, что НПВП применяют с осторожностью в отношении больных ЯК, поскольку при подобной терапии существует большой риск рецидива ВЗК [39]. Например, индометацин применяется у животных с целью инициации и моделирования ВЗК [40]. Ученым необходимо будет провести дополнительные исследования, чтобы найти самую низкую и эффективную дозу НПВП с минимальным количеством побочных эффектов. Антиканцерогенное действие аспирина осуществляется за счет ингибирования ЦОГ-2 и не-ЦОГ-2-путей, таких как сигнальные пути β-катенин, NF-kB, p53, TLR-4.
Данные о снижении риска КРР рака у пациентов с ВЗК под действием статинов противоречивы. В систематическом обзоре M. Dobrzycka et al. (2018) продемонстрировано улучшение общей и онкоспецифической выживаемости пациентов с КРР, получающих статины как до, так и во время лечения новообразования [41]. Результаты ряда экспериментальных и клинических исследований позволяют предполагать хемопревентивные эффекты статинов, которые среди прочего могут реализоваться в группах пациентов высокого риска по развитию КРР, в т.ч. у пациентов с ВЗК [42]. С другой стороны, прием статинов может быть и «индикатором» повышенного внимания пациента к своему здоровью [43]. Существует масса исследований, направленных на изучение этого интересного и важного вопроса, все детали которого подробно обсуждаются в публикации 2020 г. в Российском журнале гастроэнтерологии, гепатологии, колопроктологии [44].
Тем не менее характер опубликованных исследований и качество полученных данных по использованию статинов и НПВП у больных с ВЗК с целью профилактики КРР пока не позволяют переносить полученные результаты в повседневную клиническую практику.
Использование препаратов группы 5-аминосалициловой кислоты (5-АСК) в лечении больных ЯК связано с более низкой вероятностью формирования КРР [45, 46]. Несколько крупных исследований [47, 48] демонстрируют снижение риска КРР у больных ЯК, получавших препараты 5-АСК на регулярной основе длительное время. В связи с чем показана профилактика ВЗК-ассоциированного КРР препаратами месалазина.
Заключение
Анализируя последние публикации о профилактике КРР у больных ВЗК, можно сделать следующие выводы:
- При ВЗК увеличивается риск развития КРР, что обусловлено хроническим воспалительным процессом. Этапы формирования КРР у больных ВЗК: хроническое воспаление, дисплазия, ВЗК-ассоциированный КРР.
- Выявление пациентов с повышенным риском развития КРР является важным фактором ведения больных ВЗК с длительным анамнезом.
- Своевременное выполнение скрининговой колоноскопии и последующее эндоскопическое наблюдение – важнейшие элементы канцерпревенции у таких пациентов.
- Скрининговая колоноскопия должна проводиться в условиях хорошей подготовки кишки и желательно в период ремиссии, поскольку активное воспаление затрудняет выявление дисплазии.
- Основная задача лечения больных ВЗК – достижение ремиссии и профилактика осложнений, основной подход терапии – treat-to-target (Т2Т) с формированием персонализированных схем лечения с учетом тяжести заболевания, протяженности поражения, переносимости медикаментов, изменения образа жизни и диеты.
- Использование препаратов группы 5-АСК в лечении больных ЯК ассоциируется с более низкой вероятностью формирования КРР.
Несмотря на проделанную работу ученых во всем мире, требуются дальнейшие исследования в этой области для предотвращения развития КРР у больных ВЗК и сохранения качества жизни этих пациентов.
Источник финансирования. Грант Президента РФ для государственной поддержки ведущих научных школ РФ 2020–2021 «Разработка технологии здоровьесбережения коморбидного больного гастроэнтерологического профиля на основе контроля приверженности» № НШ-2558.2020.7.


