Обоснование
Основным инструментом социальной ассимиляции человека и способом общения, необходимым для адаптации в окружающей среде и профессиональной реализации, является голос. Голос и речь представляют собой сочетание звуков, образуемых голосовым аппаратом человека, которые отражают различные составляющие его жизни: возраст, состояние здоровья, эмоции, социальный статус. Одной из важнейших функций, непосредственно связанной с голосом, является определение и узнавание конкретного индивидуума. Именно поэтому нарушение голосовых функций имеет колоссальные негативные последствия не только для социальной и профессиональной сфер жизнедеятельности человека, но и для здоровья – физического и ментального [1]. Существенное клиническое значение среди незлокачественных заболеваний гортани, приводящих к стойкой потере голоса, имеют рубцовые поражения и атрофия голосовых складок (ГС) [2, 3]. Причины их формирования чрезвычайно многообразны: острое и хроническое воспаление, избыточные голосовые нагрузки; травма любой этиологии, в т.ч. при хирургических вмешательствах; эндотрахеальная интубация, пресбифония и т.д. [4, 5]. Являясь по своей структуре утолщенными, плотными пучками коллагена с нарушенной пространственной упорядоченностью, рубцы ГС приводят к увеличению ригидности и плотности ткани, выражающейся потерей уникальных реологических характеристик, необходимых для звукообразования [6]. Лечение пациентов с рубцовыми повреждениями ГС остается одной из самых сложных проблем в ларингологии [4]. Разработана масса методик, позволяющих частично восстанавливать голосовую функцию, однако в настоящее время их функциональный результат в большинстве своем не оптимален и не приводит к существенному улучшению качества голоса [3, 7]. По заключению консенсуса Европейского общества ларингологов (G. Friedrich et al., 2013), эта проблема в первую очередь обусловлена тем, что существующие способы лечения, позволяя добиваться смыкания ГС и улучшения их локальной геометрии, не обеспечивают восстановления гистологической структуры органа, в т.ч. ультраструктуры слоев ГС, преимущественно отвечающей за нормальную вибрацию и в конечном итоге – за звуковые характеристики голоса [8].
В последнее время в мировой оториноларингологии возрос интерес к достижениям регенеративной медицины, в т.ч. к возможности применения клеточных технологий для восстановления таких дефектов [9, 10]. Идея, заложенная в подобные экспериментальные исследования, заключается в стимуляции восстановления нормальной структуры ГС путем имплантации клеточного продукта в область модельного дефекта [11, 12]. Под клеточным продуктом при этом следует понимать культуру аутологичных, аллогенных или ксеногенных клеток из различных источников, а под модельным дефектом – рубцовое поражение ГС лабораторного животного либо ее раневую поверхность. В ряде опубликованных экспериментальных работ для этой цели применялись фибробласты ГС, стволовые клетки, выделенные из слизистой оболочки надгортанника, индуцированные, эмбриональные стволовые клетки и др. [13–16]. Однако наибольшим потенциалом для широкого использования в клинической практике в ближайшем будущем обладают мезенхимные стромальные клетки (МСК) костного мозга или жировой ткани [17].
Целью данной работы стало исследование аутологичных МСК в качестве возможного источника клеточной терапии рубцовых повреждений ГС, а именно изучение потенциала аутологичных МСК в восстановлении морфологических характеристик поврежденных ГС на экспериментальной модели in vivo.
Методы
Данная работа представляет собой контролируемое экспериментальное исследование с параллельными группами. Всего в исследовании мы использовали 10 лабораторных кроликов породы шиншилла массой 3,0–3,5 кг.
Животные были разделены на 2 равные группы по 5 кроликов. В 1-й опытной группе рубцевание слизистой оболочки ГС происходило без инъекций МСК. Во 2-й – в нанесенный дефект ГС вводили аутологичные МСК из костно-мозгового резерва. Дополнительно были задействованы пять гортаней кроликов из биобанка, ГС которых использовались в качестве группы нормального контроля.
В качестве экспериментальной модели мы использовали зрелый рубец ГС. Выбор данной модели был обусловлен тем, что это наиболее распространенная и трудноизлечимая патология, хорошо воспроизводимая в эксперименте. Хирургические вмешательства проводили в условиях операционной виварного комплекса. Для обезболивания животным внутримышечно вводили раствор тилетамина и золазепама из расчета 10–15 мг/кг препарата и раствор ксилазина 1–2 мг/кг. Для визуализации гортани использовали ригидный эндоскоп KarlStorz–Hopkins 0 4,0 мм.
На первом этапе создавался анатомический дефект ГС с помощью 2 мм чашеобразных щипцов длиной 18 cм (RZ Medizintechnic GmbH), которыми выкусывали слизистую оболочку средней трети правой ГС (рис. 1 а, б). После операции животных помещали в отдельный бокс, где проводили динамическое наблюдение за их состоянием до следующего этапа исследования. В послеоперационном периоде проводилась антибактериальная терапия (цефотаксим 75 мг/кг 1 раз в сутки 5 дней). Из всех прооперированных животных ни одно из животных не погибло в результате развития каких-либо осложнений.
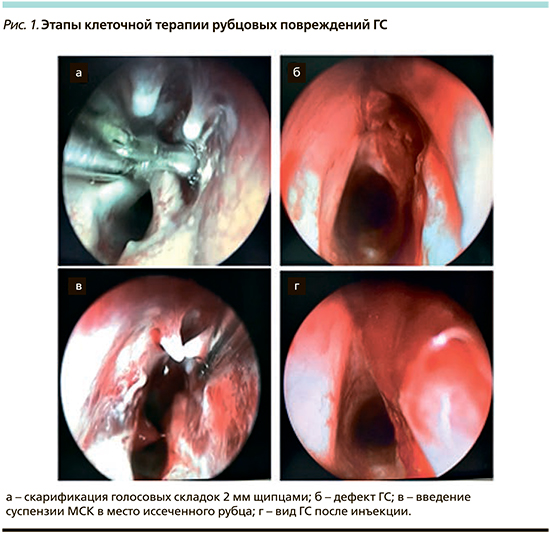
Срок созревания рубцов ГС составил 3 месяца. Параметры наносимого дефекта и сроки формирования рубцов нам представились наиболее оптимальными, т.к., по данным литературы, глубина дефекта должна превышать фактическую толщину поверхностных слоев собственной пластинки слизистой оболочки ГС. Травма глубоких слоев неминуемо приводит к рубцовым изменениям с последующим нарушением вибрационных характеристик; трех месяцев достаточно для завершения активных процессов организации коллагена в рубцовой ткани [10].
На втором этапе проводили хирургическое вмешательство для эксцизии рубцов ГС с одномоментной имплантацией в полученный дефект аутологичных МСК (опытная группа 2) либо физиологического раствора (опытная группа 1). Методика удаления рубцовой ткани аналогична скарификации, границы рубца определяли визуально и тактильно. Суспензия МСК доставлялась из лаборатории в операционную в инсулиновом шприце непосредственно перед проведением вмешательства. Объем суспензии 100–150 мкл (около 1×105 клеток) инъецировали в дефект ГС, т.е. в собственную пластинку и/или поверхностные слои щиточерпаловидной мышцы с помощью ларингеального инъектора (RZ Medizintechnic GmbH). Правильность глубины и места инъекции оценивали по характерному образованию инфильтрата, размер которого коррелировал с объемом вводимой суспензии (рис. 1 в, г). По завершении контрольных сроков регенерации (через 3 месяца) животные выводились из эксперимента методом избыточного внутримышечного введения раствора тилетамина и золазепама для последующего морфологического исследования.
Для всех животных 2-й опытной группы были получены и накоплены МСК. Источником аутологичных МСК в исследовании служил костномозговой резерв бедренной кости животных. Ее выбор обусловлен большим количеством нативного клеточного материала и лучшим его качеством по сравнению с другими костями скелета [18]. Обезболивание осуществляли аналогичным способом, указанным в описании скарификации голосовых складок. Пункции проксимальных эпифизов обеих бедренных костей проводились стернальной иглой (14G) на глубину 3–4 см по направлению диафиза. Правильное положение иглы контролировали с помощью характерных тактильных ощущений. Костный мозг аспирировали с помощью шприцев (20 мл) с предварительно набранным 1 мл раствора гепарина (5000 ЕД/мл) (рис. 2 а).
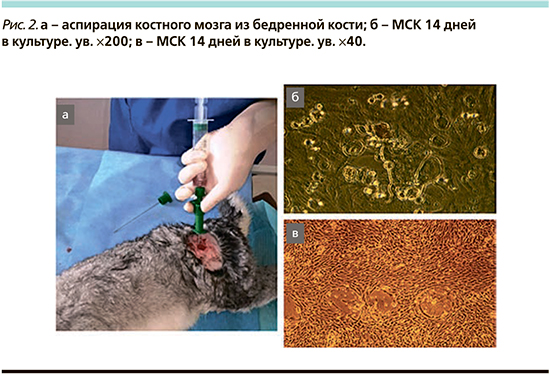
Полученный аспират в объеме 2–3 мл транспортировался в лабораторию костного мозга. Суспензию клеток центрифугировали при 1500 об/мин (350 g) 5 минут, осадок клеток ресуспендировали в растворе для лизиса эритроцитов (114 мМ NH4Cl; 7,5 мМ КНСОз; 100 мкМ EDTA) в течение 3–5 минут и повторно центрифугировали. Гемолизированный супернатант отсасывали, а клеточный осадок ресуспендировали в среде DMEM/Ham F-12 (ПанЭко, Россия), содержащей 10%-ную телячью эмбриональную сыворотку («HyClonegold», USA), инсулин 0,4 мкМ, 20 нг/мл фибробластоидного фактора роста основного (FGFb) и 0,25 мг/л гентамицина. Выделенные клетки представляли собой первичную культуру преимущественно мононуклеарных клеток костного мозга, которые затем высевали в количестве 2,0–2,5 млн кл/мл в культуральных флаконах. Затем культуральные флаконы помещали в СО2-инкубатор с 5%-ной концентрацией СО2 и 95%-ным содержанием атмосферного воздуха с повышенной влажностью. Через 2–3 суток после выделения первичной культуры неприкрепившуюся клеточную взвесь удаляли, оставшиеся клетки с фибробластоподобной морфологией продолжали культивировать. Замену культуральной среды на свежую осуществляли каждые 3–4 суток. После образования субконфлюэнтного монослоя клетки однократно отмывали раствором Версена или Хэнкса, затем снимали раствором Версена с 0,25%-ного раствора трипсина, ресуспендировали в ростовой среде и засевали в новую культуральную посуду в соотношении 1:3. При заморозке в криобанке, так же как и при пересеве, клетки снимали с культуральной поверхности, осаждали центрифугированием и ресуспендировали в среде для замораживания: 30% DMEM/Ham F-12, 10%-ный диметилсульфоксид (ДМСО), 60%-ная телячья эмбриональная сыворотка. Клетки в концентрации не более 5 млн клеток/мл разливали по криопробиркам и замораживали до температуры – 70°С со скоростью 1 град/мин, после чего ампулы переносили в дьюар с жидким азотом для длительного хранения. Для каждого из животных 2-й опытной группы получено от 8 до 15×106 клеток.
Морфологическое исследование голосовых складок в группе чистого контроля проводилось без нанесения дефекта, а при создании рубца – через 6 месяцев после начала эксперимента и через 3 месяца после рубцевания вторичной раны. Всего было исследовано 5 голосовых складок с рубцовыми дефектами без инъекции МСК (экспериментальная группа 1), 5 голосовых складок с введенной во вторичную рану суспензией МСК (экспериментальная группа 2) и 5 интактных ГС, взятых из биобанка. Голосовая складка иссекалась, фиксировалась в 10%-ном нейтральном формалине и заливалась в парафин. Микротомные срезы толщиной 4–5 мкм после депарафинизации окрашивались гематоксилином/эозином, пикросириусом красным на коллагеновые волокна. Препараты изучались в универсальном микроскопе Leica DM 4000 B LED и фотографировались с помощью камеры DFC 7000 T. Кроме стандартной световой микроскопии препараты изучались при поляризационной микроскопии в том же микроскопе.
Результаты
Гистологическое изучение интактной голосовой складки в группе чистого контроля показало, что ее центральная часть выстлана неороговевающим многослойным плоским эпителием (НМПЭ). Собственный слой слизистой оболочки граничит с мышечной либо хрящевой тканью и представлен соединительной тканью, внутри которой рыхло располагаются коллагеновые волокна, а снаружи видны более плотные продольные пучки коллагеновых волокон (рис. 3Н). Отмечается слабая лимфогистиоцитарная инфильтрация слизистой оболочки с хорошей васкуляризацией, очень редко видны небольшие лимфоидные фолликулы. Показательно, что у кроликов кроме щитовидного и черпаловидного хрящей в складке ближе к собственной пластинке голосовой складки располагаются дополнительные микрохрящи со структурой, указывающей на незрелость хрящевой ткани (меньше матрикса, более крупные хондроциты). Периферическая часть складки выстлана мерцательным цилиндрическим эпителием; слизистая оболочка более рыхлая, чем в центральной части, однако и в ней видны продольные пучки коллагеновых волокон; нечетко разделяется на слои и содержит многочисленные железы и сосуды.
В обеих опытных группах гистологическое изучение выявило рубцы слизистой оболочки, развившиеся на месте операционного дефекта в центральной части голосовой складки. Через 3 месяца рубцы выстланы зрелым НМПЭ и состоят из плотной фиброзной соединительной ткани, представленной пучками коллагеновых волокон (рис. 3. Гр. 1. Гр. 2). В рубцах отсутствуют признаки воспалительного процесса. Васкуляризация рубцовой ткани обеих групп выражена слабее, чем в интактной слизистой, при этом во второй группе она несколько выше, чем в первой. Важным показателем является плотность рубцовой ткани и архитектоника коллагеновых волокон. В 1-й опытной группе ткань рубца сформирована беспорядочно переплетающимися пучками коллагеновых волокон (рис. 3. Гр. 1). Во 2-й опытной группе рубцовая ткань содержит большее количество клеточных элементов (рис. 3. Гр. 2). Кроме того, рубец во второй группе в отличие от первой чаще имеет взаимнопараллельную архитектонику коллагеновых волокон, т.е. по структуре он приближается к нормальному строению слизистой оболочки. (рис. 3. Гр. 2). Количество эластических волокон в рубцовой ткани без клеточной терапии животных уменьшается по сравнению с нормой, а в рубцах с введенными МСК эластических волокон больше, чем в 1-й опытной группе. Следует отметить, что при формировании рубца в обеих опытных группах происходит фиброзирование мышечной ткани в тех ее слоях, которые близки к рубцу, причем во второй группе фиброзирование несколько слабее (рис. 3. Гр. 2). Между экспериментальными группами отсутствуют существенные различия по критериям, характеризующим эпителий, – гипертрофия, атрофия, дистрофические изменения.
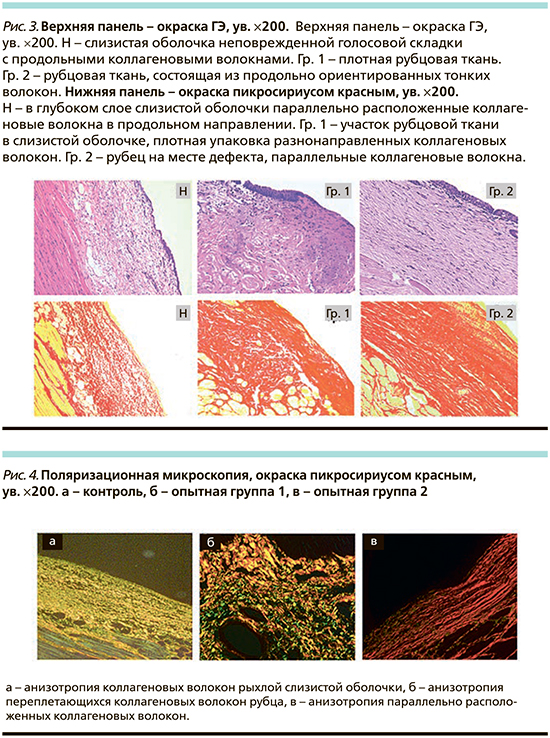
Изучение срезов ткани предварительно окрашенных пикросириусом в режиме поляризационной микроскопии выявило, что во всех случаях имеется анизотропия коллагеновых волокон. Интенсивность анизотропии в рубцовой ткани выше, чем в нормальной слизистой оболочке (рис. 4, а–в). При этом отмечается различная окрашиваемость объектов поляризации (желтый, зеленый и красный цвета). Это объясняется прежде всего углом отражения поляризованного света, цвет разный в зависимости от преобладания в срезе продольных либо поперечных волокон.
Обсуждение
Новые технологии, относящиеся к регенеративной медицине, призваны решать задачу восстановления нормальной функции поврежденной ткани путем применения биомедицинских продуктов, компонентами которых являются клетки из различных источников, несущие их матриксы (скаффолды) и сигнальные молекулы [19, 20]. За последние несколько лет в ряде экспериментальных исследований продемонстрирована эффективность подобных подходов к восстановлению структуры и свойств голосовых складок при рубцовых повреждениях. Так, в работах B. Svensson показано значимое уменьшение общего уровня рубцовых изменений и толщины слизистой оболочки голосовых складок кролика с имплантированными в свежую рану ксеногенными МСК костного мозга человека; в исследовании V. Angelou в рубцах голосовых складок выявлены увеличение депозитов коллагена, дезорагнизация его волокон, а также частичное восстановление этих показателей после терапии аутологичными МСК из жировой ткани [21–23]. По данным работы R. Hu et al. (2014) показано лучшее восстановление морфологии голосовых складок при терапии повреждений МСК по сравнению с фибробластами [24]. Возможно, одним из объяснений эффектов аутологичных МСК на регенерацию слизистой оболочки скарифицированных голосовых складок может быть паракринное воздействие продуктов их стромальной секреции, обладающих иммуномодулирующими и противовоспалительными свойствами. По данным обзора Francisco J. Vizoso et al. (2017), секретируемый широкий спектр противовоспалительных медиаторов и цитокинов, а также различных факторов роста имеет большее значение в заживлении ран, чем непосредственная пролиферация стволовых клеток в месте имплантации [25].
В работе N. Hiwatashi et al. (2017) in vitro продемонстрировано ингибирующее влияние культуральной среды костно-мозговых МСК на секрецию трансформирующего фактора роста β1 фибробластами голосовых складок человека [26]. В экспериментах in vivo показано, что через месяц после имплантации подавляющее большинство имплантированных в голосовые складки МСК не выживает, что также указывает на реализацию регенеративного потенциала стволовых клеток через паракринные механизмы [22, 27]. Результаты данной работы также показали значительный регенераторный потенциал МСК при введении их во вторичную рану голосовой складки. Следует отметить, что в исследовании использовались аутологичные МСК, что исключило необходимость применения иммуносупрессивной терапии, которая могла повлиять на результаты регенерации. Наиболее интересны изменения, наблюдаемые в коллагеновых структурах. Рубцы после клеточной терапии по сравнению с рубцами без введения МСК имеют меньшую толщину коллагеновых волокон и их пучков. Не менее важным отличием является то, что в рубцах без клеточного влияния рубцовая ткань представлена в основном переплетающимися элементами; особенно переплетаются коллагеновые волокна, состоящие из фибрилл, и пучки коллагеновых волокон, что отчетливо видно на световой микроскопии. В то же время в рубце, созревающем под влиянием МСК, переплетение волокнистых структур на разном уровне выражено значительно меньше, в большей степени имеется однонаправленность волокон в пучках и самих коллагеновых пучков между собой. Это в значительной степени приближает архитектонику коллагеновых волокон, микроструктуру слизистой оболочки голосовой складки при клеточной терапии к морфологической структуре интактных складок. На этом основании можно говорить, что МСК обладают свойствами увеличивать степень полной регенерации слизистой оболочки.
Заключение
Данная работа показала, что аутологичные МСК костного мозга, введенные в рану голосовой складки сразу после иссечения зрелого рубца, способствуют заживлению слизистой оболочки. Дефект не регенерирует полностью, однако в замещенной ткани рубцовые процессы выражены слабее и морфологически она стоит ближе к нативной структуре голосовой складки по сравнению с дефектами, репарация которых проходила без введения клеток. На сегодняшний день остаются открытыми многие вопросы как в изучении механизмов регенерации голосовых складок, выбора наиболее эффективного источника клеток для терапии, подбора скаффолдов и тканеинженерных комплексов, так и в подходах к проведению доклинических исследований, которые позволят более активно внедрять разрабатываемые технологии в клиническую практику. Однако перспективность продолжения экспериментов в данном направлении очевидна.
Выражение признательности
Данная работа выполнена при поддержке грантом РФФИ № 18-02-00658.


