Введение
Атопический дерматит (АтД) – аллергическое заболевание кожи, возникающее в раннем детском возрасте при наследственном предрасположении к атопическим заболеваниям, имеющее хроническое рецидивирующее течение, возрастные особенности локализации и морфологических проявлений очагов воспаления, характеризующееся кожным зудом и обусловленное гиперчувствительностью к аллергенам и неспецифическим триггерным факторам. Для АтД характерно разнообразие клинических форм поражения кожи, стадийное развитие и частое вовлечение в аллергический процесс органов дыхания, пищеварительного тракта и других органов [1–3]. По данным эпидемиологических исследований, АтД страдают до 20% детей и от 5 до 10% взрослых [1, 4, 5]. В связи с этим выяснение механизмов развития и повышение эффективности терапии АтД считаются одними из важнейших задач в современной аллергологии и педиатрии.
Особенности патогенеза АтД у детей
Современное понимание патогенеза АтД указывает на сложную взаимосвязь между генетическими факторами и факторами окружающей среды. Патогенез АтД может начинаться во многих случаях с генетически предопределенного дефекта кожного барьера, который проявляется в виде сухой кожи. Этот врожденный дефицит кожного барьера приводит к повышенной экспрессии провоспалительных цитокинов, следовательно, к активации врожденных лимфоидных клеток (ILC – innate lymphoid cells) и антиген-презентирующих клеток (T-хелперы – Th–Th2 и Th22). В частности, интерлейкин-4 (ИЛ-4) и ИЛ-13 стимулируют рекрутирование эозинофилов и тучных клеток, секрецию ИЛ-31 – ключевого цитокина, участвующего в ощущении зуда [6]. Чрескожная сенсибилизация к аллергенам окружающей среды и бактериальным инфекциям, в частности Staphylococcus aureus, в дальнейшем способствует нарушению эпидермального барьера и экзематозному воспалению кожи.
Развитие АтД у детей в значительной мере определяется семейным предрасположением к атопическим заболеваниям. В настоящее время атопия рассматривается как врожденная склонность к гиперпродукции специфических иммуноглобулинов Е (IgE) к аллергенам и ассоциируется с развитием аллергических реакций по немедленному типу [7]. У 70% родителей детей с АтД и у 17% ближайших их родственников выявляется АтД [8]. При наличии аллергических заболеваний у матери и отца АтД чаще развивался уже в первые месяцы жизни ребенка. Для атопических болезней, в т.ч. АтД, характерно наличие признаков полигенного наследования. Гены, способствующие их возникновению, содержат полиморфизмы (варианты), обусловленные нарушением последовательности структурных компонентов генов, являющиеся причиной нарушения их функций. В развитии АтД существенное значение придается полиморфизмам генов сенсоров врожденного иммунитета (TLR2, TLR4, TLR9, NOD и др.), транскрипционного фактора, способствующего дифференцировке наивных Т-клеток в Th2-лимфоциты (STAT6), цитокинов (ИЛ-4, -13, -31, RANTES, TSLP1 и др.), их рецепторов (ИЛ-4Rα, -7R, -12RB, TSLPR), белков плотных контактов [8, 10]. Важным геном предрасположенности к возникновению АтД считается ген, кодирующий β-цепь высокоаффинного рецептора к IgE (FcεR1), расположенный в хромосоме 11q12–13 [8]. Мутации гена филаггрина, приводящие к дефициту белка филаггрина, служат основной причиной нарушения барьерной функции кожи, потери влаги и развития ксероза при АтД. Недостаточность белка филаггрина нарушает дифференцировку кератиноцитов, снижает их интеграцию, приводит к дефекту плотных контактов между клетками эпидермиса, к потере влаги, повышению рН, восприимчивости к бактериальным инфекциям и формированию гиперчувствительности к экзогенным аллергенам [11, 12]. Мутации гена филаггрина связаны с развитием IgE-опосредуемого АтД, последующим возникновением бронхиальной астмы и аллергического ринита [13–16]. Нарушению гидратации кожи и развитию сухости кожи при АтД способствуют также генетически детерминированные нарушения синтеза липидов вследствие дисбаланса подклассов церамидов с преобладанием короткоцепочечных вариантов их и короткоцепочечных жирных кислот [17].
Развитие АтД у детей чаще всего происходит вследствие ранней (на 1–2-м годах жизни) сенсибилизации к пищевым и клещевым аллергенам. Проникновение аллергенов во внутренние среды, поглощение и процессинг их дендритными клетками и клетками Лангерганса, презентация образовавшихся антигенов к наивным Т-лимфоцитам приводят к поляризации и пролиферации Th2-лимфоцитов. Наиболее часто причинно значимыми в развитии АтД у детей являются аллергены белков коровьего молока, куриных яиц, пшеницы (глютен), сои, рыбы, морепродуктов, аллергены микроклещей домашней пыли Dermatophagoides pteronyssinus и Dermatophagoides farinae, Staphylococcus aureus, стрептококков, грибов Pityrosporum (P. orbitale, Trichophyton, Candida). Обострение АтД может быть вызвано сенсибилизацией к лекарственным препаратам (чаще всего к антибиотикам), а также сенсибилизацией к пыльце растений в период обострения поллинозов [1].
Активация врожденных ILC (type 2 innate lymphoid cells) и Th2-лимфоцитов сопровождается повышением экскреции ИЛ-4, -5, -6, -10, -13, увеличением продукции IgE, вовлечением в аллергический процесс тучных клеток и базофилов (экскреция гистамина, протеаз, протеогликанов, лейкотриенов, тромбоксанов), эозинофилов (возникновение эозинофилии с высоким уровнем в периферической крови эозинофильного катионного протеина, обладающего цитотоксическим действием).
Открытие семейства врожденных лимфоидных клеток (ILC) значительно расширило наши знания в последние годы. ILC представляют собой особый класс зрелых лимфоцитов, которые не экспрессируют антигенные рецепторы, но транскрипционно и функционально схожи с Th-лимфоцитами. ILC разделены на три группы – ILC1, ILC2 и ILC3, на основании их различного характера продукции цитокинов и факторов транскрипции. ILC2 могут вызывать воспалительный ответ 2-го типа. ILC2 обладают многими функциональными сходствами с лимфоцитами Th2, поскольку они продуцируют цитокины типа 2 (ИЛ-4, -5, -9 и -13). Ряд исследований подтверждают роль ILC2 в воспалении кожи при АтД [18, 19].
Эозинофилы участвуют в развитии как IgE-опосредуемого, так и не-IgE-опосредуемого АтД.
В патогенезе АтД существенная роль принадлежит активации клеток Лангерганса и кератиноцитов. Взаимодействие на поверхности клеток Лангерганса аллергенспецифических IgE с причинно значимыми аллергенами повышает продукцию ими провоспалительных цитокинов (ИЛ-1, -6, -8, фактор некроза опухоли α – ФНО-α). Повышение активности кератиноцитов и эндотелиальных клеток проявляется повышением продукции цитокинов и хемокинов, осуществляющих рекрутирование воспалительных клеток в дерму. Обострение АтД сопровождается увеличением уровня Е-селектина и ICAM-1 в сыворотке крови. Активация Т-лимфоцитов, обусловленная воздействием экзогенных аллергенов, вызывает увеличение в дерме числа лимфоцитов, несущих кожный лимфоцитарный антиген (CLA) и повышающих уровень сывороточных Е-селектинов. Развитие острого аллергического воспаления в коже и зуда кожи при АтД опосредуется воздействием провоспалительных медиаторов, цитокинов и хемокинов [20–22].
Выделяемые Th2-лимфоцитами и ILC2 провоспалительные цитокины ИЛ-4 и -13 снижают резистентность организма к микробной инвазии за счет ингибирования синтеза антимикробных пептидов и усугубления нарушения эпидермального барьера [20, 21]. Недавно выявлена потенциальная роль кишечной микробиоты как модулятора иммунной системы, в частности, в первые месяцы жизни детей, страдающих АтД, были обнаружены предсимптомные различия в составе и разнообразии кишечной микробиоты. [23, 24]. Изменение состава микробиома и уменьшение видового разнообразия приводят к дефициту Treg и дисбалансу Th1/Th2.
Хроническое персистирующее воспаление в коже при АтД происходит с участием Th1-лимфоцитов и экскретируемого ими интерферона γ (ИФН-γ) при значимом вкладе Th2-опосредуемых аллергических реакций [25]. Провоспалительным и усиливающим зуд кожи действием обладает экскретируемый Th2-лимфоцитами у больных АтД ИЛ-31 [26].
Экскретируемый при этом заболевании дендритными клетками ИЛ-25 поддерживает дифференцировку Th2-лимфоцитов и ингибирует экспрессию филаггрина [27, 28]. Установлено, что энтеротоксины (суперантигены) вызывают IgE-опосредуемую сенсибилизацию и более тяжелое течение АтД у детей [21, 29].
IgE-опосредуемый АтД характеризуется наличием выраженных проявлений атопии с увеличением продукции ИЛ-4 и повышением уровня общего и специфических IgE-антител [30]. Возможно возникновение клинико-патогенетического варианта АтД, обусловленного продукцией специфических IgE при нормальном уровне общего IgE [1]. Для IgE-опосредованного АтД характерно более раннее (в первые 3 месяца жизни) возникновение, преобладание экссудативной и лихеноидной форм болезни, частое выявление пищевой аллергии и сенсибилизации к аэроаллергенам. Развитие не-IgE-опосредуемого АтД ассоциируется с Th1-иммунным ответом, повышением уровня ИФН-γ и ФНО-α в сыворотке периферической крови, при этом у таких больных отмечается нормальный уровень общего IgE и не выявляются аллергенспецифические IgE [30]. При не-IgE-опосредуемом АтД отмечается более поздний (после 1-го года жизни) дебют заболевания, более легкое по сравнению с IgE-опосредуемым АтД течение, преобладает эритематозная форма заболевания и отсутствует сезонность в обострении дерматита [30].
Возможно вовлечение аутоиммунных реакций в развитие АтД, при этом продукция IgE против аутоантигенов может вызывать развитие I типа аллергических реакций или моноциты могут индуцировать пролиферацию аутореактивных Т-лимфоцитов с развитием гиперчувствительности замедленного типа [31–33]. Помимо аллергенных воздействий обострение АтД может быть вызвано бактериальной, вирусной инфекциями, стрессом, воздействием химических поллютантов.
Подходы к терапии АтД у детей
Проводимая при АтД терапия носит патогенетический и комплексный характер. Она включает элиминацию специфических и неспецифических факторов, вызывающих его обострение, уход за кожей, устранение сухости кожных покровов, проведение противовоспалительной фармакотерапии.
В то же время проводимая терапия должна быть персонифицированной, учитывать особенности развития и клинических проявлений АтД в каждом конкретном случае болезни. Целью проводимой терапии считается снятие обострения АтД и достижение устойчивой клинической ремиссии.
Элиминация триггерных факторов. В отношении детей, страдающих АтД, лечение включает элиминацию причиннозначимых в его развитии пищевых продуктов. Находящимся на искусственном вскармливании детям первого года жизни в случаях выявления сенсибилизации к белкам коровьего молока в виде выраженных проявлений АтД осуществляется его элиминация с введением в питание смеси на основе высокогидролизованной сывороточной фракции белков коровьего молока (Алфаре, Нутрилон Пепти Аллергия, Фрисопеп) или на основе казеина (Нутрамиген, Фрисопеп АС). Большинство детей, страдающих аллергией к белкам коровьего молока, хорошо переносят смеси на основе глубокого гидролиза молочных белков. На фоне вскармливания детей первого года жизни указанными смесями отмечается уменьшение симптомов аллергии к белкам коровьего молока, в т.ч. симптомов АтД.
У детей первого года жизни с аллергией к белкам коровьего молока с проявлениями лактазной недостаточности назначаются безлактозные гидролизаты, содержащие растительные жиры, в случаях комбинированных нарушений усвоения жира (стеатореи) и лактозы осуществляется применение безлактозных гидролизатов, содержащих растительные жиры и среднецепочечные триглицериды.
Аминокислотные смеси применяются в диетотерапии детей первого года жизни с тяжелыми проявлениями АтД, гастроинтестинальной пищевой аллергией и поливалентной пищевой аллергией, реагирующих на смеси на основе высокогидролизованного белка. Терапевтический эффект аминокислотных смесей связан с вхождением в их состав свободных аминокислот, не способных инициировать развитие аллергических реакций. Аминокислотные смеси хорошо переносятся детьми с пищевой аллергией, у них отсутствует горьковатый привкус, свойственный смесям с высокой степенью гидролиза белка. Так например, аминокислотная смесь Неокейт способствует более быстрому уменьшению симптомов у детей с тяжелым АтД и гастроинтестинальной аллергией [34].
Назначение смесей на основе изолята соевого белка детям детей первого года жизни с аллергией к белкам коровьего молока отмечается сравнительно редко за последние годы в связи с возможным возникновением обострения АтД при их применении.
Детям старше года и подросткам с АтД назначают гипоаллергенную диету с исключением причиннозначимых пищевых аллергенов, а также продуктов с высоким сенсибилизирующим потенциалом и продуктов, содержащих пищевые добавки (красители, консерванты).
По достижении устойчивой ремиссии АтД, снижении уровня специфических IgE антител в сыворотке к причиннозначимым пищевым аллергенам диета может быть расширена, но высокоаллергенные продукты (рыба, орехи, яйца, арахис, шоколад, морепродукты) подлежат исключению в течение более продолжительного периода времени. Следует иметь в виду, что продукты, на которые в анамнезе отмечалось возникновение системных аллергических реакций в виде анафилактического шока, исключаются пожизненно.
При установлении связи обострений АтД с сенсибилизацией к аэроаллергенам проводится комплекс мер, направленных на снижение концентрации аэроаллергенов (клещевых, грибковых, эпидермальных и др.) в жилых помещениях. К ним относятся регулярная уборка квартир с применением пылесоса, устранение контакта с домашними животными, устранение избыточной влажности воздуха и очагов плесени из жилых помещений.
Наружная терапия АтД у детей. Наружная терапия – важное направление проводимого при АтД комплексного лечения детей, она осуществляется с учетом характера и тяжести течения развившегося воспаления кожи. Характер проводимых при нем терапевтических мероприятий определяется выраженностью воспаления кожи и его распространенности, при этом осуществляется дифференцированный подход к назначению топических лекарственных средств с учетом механизма их терапевтического действия (см. рисунок).
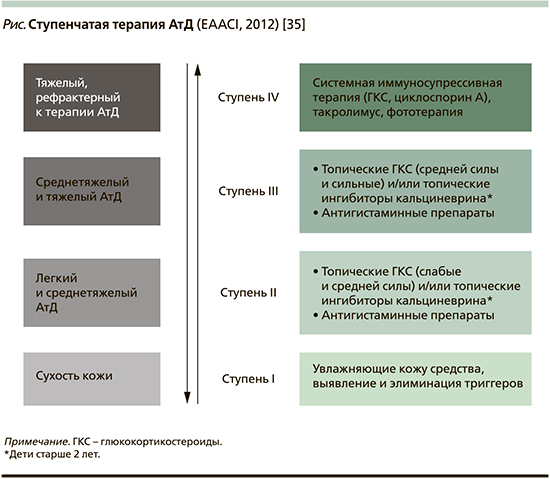
Проведение наружной терапии при АтД ставит целью добиться устранения воспаления, зуда, сухости кожных покровов при применении противовоспалительных, питательных, увлажняющих кожу средств и осуществление правильного ежедневного ухода за кожей. Перед непосредственным проведением наружной терапии участки пораженной воспалительным процессом кожи очищаются от корок, чешуек, что обеспечивает контакт лекарственных соединений с пораженной кожей и способствует достижению терапевтического эффекта.
Топические глюкокортикостероиды (ГКС) служат препаратом 1-й линии для лечения АтД и составляют основу проводимой при АтД противовоспалительной терапии. Они обладают выраженной противовоспалительной активностью за счет супрессивного действия на гены, контролирующие синтез провоспалительных цитокинов и хемокинов. Топические ГКС угнетают синтез ИЛ-1, -4, -5, -6, -13, ФНО-α, ИФН-γ, снижают активность фосфолипазы А2 и продукцию эйкозаноидов и экспрессию молекул клеточной адгезии, тормозят миграцию эозинофилов и пролиферацию Т-лимфоцитов, снижают проницаемость сосудов [35]. Топические ГКС при АтД снижают активность тучных клеток, базофилов, эозинофилов, клеток Лангерганса и кератиноцитов в коже, способствуют снижению обсемененности кожи Staphylococcus aureus. Основным показанием к применению топических ГКС является обострение среднетяжелого и тяжелого АтД. Показано назначение их и в случаях выраженного обострения АтД легкой степени тяжести. При лечении топическими ГКС следует учитывать, что максимально возможная для терапии площадь кожного покрова не должна превышать 20% общей поверхности тела. Целесообразно проводить лечение короткими курсами (в течение 5–7 дней), в случае необходимости оно может быть продолжено до 10–14 дней. При большой площади поражения кожного покрова топические ГКС можно наносить поочередно на различные участки пораженной воспалением кожи. Наиболее эффективно при АтД наружное применение метилпреднизолона ацепоната (Адвантан), гидрокортизона бутирата (Локоид), мометазон (Элоком) и алклометазона (Афлодерм).
При лечении метилпреднизолоном ацепонатом детей с АтД положительная динамика имеет место уже на 2–3-й день: уменьшаются гиперемия, отечность кожи, зуд. Выраженный лечебный эффект возникает на 5–6-й день: исчезают воспалительные изменения и зуд кожи [36].
Частое и продолжительное применение топических ГКС у детей с АтД может быть причиной развития побочных эффектов в виде акнеиформной сыпи, фолликулита, розовых угрей, атрофии эпидермиса и дермы, телеангиоэктазий и эритемы, периорбитального дерматита, гипопигментации, гипертрихоза, наслоения вторичной инфекции.
При длительном использовании топических ГКС и особенно применения галогенизированных форм на обширных участках кожи увеличивается риск возникновения системных побочных эффектов, связанных с угнетением гипофизарно-надпочечниковой системы из-за повышенного всасывания ГКС через пораженную кожу. Известны редкие случаи развития синдрома Иценко–Кушинга, задержки роста, артериальной гипертензии, глаукомы у пациентов, длительно леченных топическими ГКС.
Как альтернатива топическим ГКС при АтД для проведения противовоспалительной терапии в настоящее время рассматриваются топические ингибиторы кальциневрина (пимекролимус, такролимус). Эти препараты тормозят активацию лимфоцитов, ингибируют процесс образования и высвобождения цитокинов воспаления, особенно Th1- (ИЛ-2, ИФН-γ) и Th2-типов иммунного ответа (ИЛ-4, -10). Эти препараты ингибируют синтез и высвобождение из тучных клеток гистамина, триптазы, серотонина. Ингибиторы кальциневрина снижают экспрессию высокоаффинного рецептора для IgE на клетках Лангерганса. Наличие у ингибиторов кальциневрина иммуносупрессивной и противовоспалительной активности способствует уменьшению воспаления в эпителии и дерме и обратному развитию клинических проявлений АтД. Терапия такролимусом не вызывает атрофии кожи и способствует улучшению функции эпидермиса за счет повышения продукции липидов и антимикробных пептидов.
Пимекролимус крем 1% (Элидел) применяют в терапии АтД у детей с 3-месячного возраста, назначают его 2 раза в день и начатое лечение продолжают до полного исчезновения эритемы и зуда. Пимекролимус 1% чаще всего используется в отношении детей с АтД легкой и средней степенями тяжести.
Наиболее эффективно лечение 1%-ным кремом пимекролимус при эритемато-сквамозной и эритемато-сквамозной с лихенификацией формами АтД легкого и среднетяжелого течения, что проявляется достижением ремиссии болезни или уменьшением воспаления и зуда кожи. У 81,8% детей с тяжелым АтД терапевтическое действие пимекролимуса проявляется уменьшением воспаления кожи, до начала лечения индекс SCORAD (Scoring of Atopic Dermatitis) у них составлял 48,1, после окончания лечения им в течение 1 месяца индекс SCORAD снизился до 27,1. Переносимость пимекролимуса в большинстве случаев является хорошей, у отдельных больных в месте аппликации препарата имели место усиление гиперемии, жжение и зуд кожи [37]. Применение 1%-ного крема пимекролимуса особенно эффективно при локализации проявлений АтД в области лица и шеи.
Такролимус (Протопик) рассматривается как препарат первой линии при локализации АтД на лице, шее и других чувствительных участках кожи. Терапевтическая эффективность такролимуса сходна с таковой ГКС 3-го класса. Назначение 0,03%-ной мази такролимуса детям старше 2 лет со среднетяжелым и тяжелым АтД 2 раза в сутки до 6 недель приводит к быстрому и выраженному уменьшению его симптомов, достижению ремиссии болезни [38, 39]. Длительное (до 12 месяцев) лечение с нанесением мази такролимуса на пораженные участки кожи 2 раза в неделю способствует продлению ремиссии АтД за счет подавления субклинического воспаления в коже [40]. Отмечается хорошая переносимость такролимуса.
Детям в целях профилактики обострений АтД предпочтительно использование пимекролимуса как препарата, более изученного для указанного применения детьми.
Противовоспалительная терапия детей раннего возраста может осуществляться с помощью средств лечебной дерматологической косметики (Ксемоз, Сикальфат, Atopic успокаивающий крем, Атодерм Р.О. цинк, Трикзера+), обладающих противовоспалительным, асептическим, успокаивающим и увлажняющим кожу действиями.
Использование увлажняющих и смягчающих кожу лечебных средств (эмолентов), содержащих церамиды и жирные кислоты, способствует нормализации структуры и функции кожного барьера. Сухость кожного барьера значительно уменьшают лечебные косметические средства на основе термальной воды – Липикар, Гидронорм, Цералин, 5%-ная мазь и крем бепантен, препараты косметических линий (крем, молочко, бальзам линии Дардиа, крем, масло и эмульсия Мустелла СтелАтопия, крем и гель Cu-Zn, крем Нутрилоджи 1 и 2, Атодерм крем, эмульсия и мазь Локобейз Рипеа). Применение увлажняющих (смягчающих) средств лечебной косметики при АтД в отношении детей способствует достижению и поддержанию ремиссии болезни, уменьшению количества используемых топических ГКС при его обострении за счет восстановления гидролипидной мантии рогового слоя эпидермиса и уменьшения сухости кожи и снижения зуда [1, 41].
Наслоение бактериальной, грибковой и вирусной инфекций отягчает течение АтД у детей. Чаще она вызывается Staphylococcus aureus, грибами Candida и Malassezia furfur и вирусами герпеса 1-го и 2-го типов.
Для детей с бактериальной инфекцией с развитием экссудации и мокнутия кожи эффективными могут быть антисептики (жидкость Кастеллани, фукорцин, раствор бриллиантовой зелени и метиленовой сини), наложение антибактериальной мази (фузидиновая, эритромициновая, гентамициновая, бактробан), возможно применение аэрозоля гидрокортизон+окситетрациклин (Оксикорт). При осложнении АтД с повышением температуры тела, интоксикацией, воспалительными изменениями крови в случае неэффективности топической антибиотикотерапии проводится лечение антибиотиками широкого спектра действия (цефалоспорины I–III, макролиды, аминогликозиды).
При возникновении у больных АтД детей вторичной инфекции бактериального и грибкового происхождения эффективно применение комбинированных препаратов (пимафукорт, тридерм, травокорт). При осложненном инфекцией АтД эффективно наружное применение пиритиона цинка (крем, аэрозоль Скин-кап) [42].
Детям с АтД, осложненным герпесвирусной инфекцией, герпетиформной экземой Капоши, должно проводиться лечение противовирусными препаратами: ацикловиром (Зовиракс), инозин пранобексом (Изопринозин).
В случаях рецидивирующей бактериальной инфекции при АтД эффективным может быть применение иммуномодулятора ликопида [30].
Системная фармакотерапия при АтД у детей
Антигистаминные препараты широко применяются в лечении АтД. Взаимодействуя с рецепторами гистамина, они способствуют обратному развитию воспаления кожи и уменьшению зуда. Антигистаминные препараты нового поколения обладают высоким сродством к Н1-рецепторам, низкой проходимостью через гематоэнцефалический барьер, высокой безопасностью и не оказывают седативного действия. Они тормозят высвобождение провоспалительных цитокинов (ИЛ-8, GM-CSF, ИЛ-5, ФНО-α) и обладают противовоспалительным действием. Удобно и их применение (1 раз в сутки). Наиболее эффективно применение цетиризина (Зиртек, Зодак), дезлоратадина (Эриус), фексофенадина (Телфаст), левоцетиризина (Ксизал) [1].
Антигистаминные препараты старого поколения в связи с наличием у них седативного действия за последние годы стали назначать реже. Эффективным может быть применение клемастина (Тавегил), хлоропирамина (Супрастин), хифенадина (Фенкарол), диметиндена (Фенистил), ципрогептадина (Перитол*). Их назначение способствует уменьшению гиперемии, отечности и зуда кожи. В случаях тяжелого обострения АтД эффективно парентеральное введение клемастина или хлоропирамина 2 раза в сутки (утром и вечером).
Системные ГКС сравнительно редко используются при обострении АтД у детей в связи с внедрением в практику топических ГКС. Непродолжительное их применение возможно при тяжелом обострении АтД, резистентном к фармакотерапии. Проведение короткого (в течение 4–7 дней) курса лечения преднизолоном внутрь из расчета 1–2 мг/кг/сут либо введением его внутримышечно из расчета 1 мг/кг 2 раза в сутки в течение 2–3 дней способствует купированию возникшего тяжелого обострения АтД.
Иммуносупрессивная терапия циклоспорином А (Сандиммун неорал) может проводиться детям с тяжелым, непрерывно рецидивирующим течением АтД, торпидным к общепринятой терапии. Иммуносупрессивное действие циклоспорина А связано с индуцируемым им снижением активности Th-лимфоцитов и подавлением секреции провоспалительных цитокинов (ИЛ-2, -3, -4, ИФН-γ, ФНО-α), уменьшением выработки тучными клетками медиаторов воспаления и ИЛ-6 моноцитами. Циклоспорин А назначают внутрь в начальной дозе 5 мг/кг/сут в 2 приема, с улучшением состояния дозу его постепенно уменьшают до 2,5 мг/кг/сут, продолжительность курса лечения составляет 1,5 месяца. Под воздействием лечения циклоспорином А отмечается уменьшение воспаления и зуда кожи, достижение ремиссии к концу месяца от начала лечения [43, 44]. Лечение циклоспорином А осуществляется под контролем уровня креатинина в сыворотке крови.
Анти-IgE-терапия. Большие надежды возлагаются на применение анти-IgE-антител (препарата омализумаба) при IgE-опосредуемом АтД, применение которого весьма эффективно для достижения контроля тяжелой атопической бронхиальной астмы (БА) у детей. При наблюдении за пациентами с сочетанными проявлениями БА и АтД, получавшими лечение омализумабом, отмечено уменьшение воспаления кожи и зуда кожных покровов и благоприятное влияние его на течение БА у этих больных [45]. Лечение омализумабом детей с изолированными проявлениями тяжелого рефрактерного к терапии АтД способствовало уменьшению воспаления кожи, количества используемых топических ГКС и повышению качества их жизни.
Аллергенная иммунотерапия (АИТ) детей с АтД проводится при полученных четких диагностических доказательствах причинной значимости определенных аллергенов в развитии обострений этого заболевания. Для АИТ чаще всего используются аллергены Dermatophagoides pteronyssinus, Dermatophagoides farinae, пыльцевые, реже пищевые и бактериальные аллергены. Позитивное влияние подкожной иммунотерапии аллергенами Dermatophagoides pteronyssinus на течение АтД отмечено у 16 (69,7%) из 23 леченых детей с сочетанными проявлениями БА и АтД [1], при этом достижение устойчивой ремиссии АтД и БА было достигнуто 4 больными, уменьшение воспаления кожи и урежение приступов БА и более легкое их течение 12. Под влиянием АИТ отмечены повышение уровня IgG и снижение уровня общего IgE в сыворотке крови. Перспективно применение эпикутанной АИТ при АтД, ассоциированном с пищевой аллергией. По своей эффективности и безопасности этот метод иммунотерапии сопоставим с сублингвальной АИТ [46].
Другие подходы к терапии
Повышению эффективности лечения АтД способствует применение витаминов В5, В6, А, D, терапия коморбидных заболеваний (сопутствующих аллергических болезней и заболеваний пищеварительного тракта), проведение физиотерапии (магнитотерапия, узкополосная фототерапия). Прием матерью во время беременности и рожденным ребенком комбинации пробиотических бактерий (Bifidobacterium bifidum, Bifidobacterium lactis и Lactococcus) оказывает превентивное действие на распространенность экземы у детей, причем начало превентивного действия их было отмечено с 3-го месяца жизни [47]. Позитивное влияние на течение АтД у детей и подростков может оказать лечение в санаториях южного берега Крыма и Северного Кавказа.


