Обоснование
Платиносодержащие комбинации препаратов для проведения химиотерапии (ХТ) служат выбором лечения больных раком яичников (РЯ) как в 1-й линии, так и платиночувствительных рецидивов РЯ. Платиносвободным считается интервал между последней датой проведения платиносодержащей ХТ и документально подтвержденным прогрессированием заболевания, является важным предиктором ответа на последующую терапию и общей выживаемости больных (ОВ) [1]. Другие факторы, которые следует рассматривать в планировании лечения больных, – это количество предыдущих линий терапии, морфологическая структура опухоли, BRCA-мутационный статус, наличие симптомов, цели лечения, а также возможность проведения повторных оперативных вмешательств.
Тем не менее даже в лечении платиночувствительных рецидивов существуют определенные ситуации, когда платиновая реиндукция является не самым лучшим подходом:
- пациенты с рецидивом, развившимся в интервале без лечения менее 1 года;
- пациенты, которым не подходит терапия препаратами платины из-за остаточной токсичности, аллергических реакций на платиновую терапию или получившие уже несколько линий платиновой терапии ранее.
В таких ситуациях ХТ комбинацией неплатиновых агентов, таких как трабектедин с пегилированным липосомальным доксорубицином (ПЛД), служит альтернативой платиновой реиндукции [2]. Ряд исследований иллюстрирует преимущества, которые могут быть достигнуты за счет стратегии правильного применения трабектедина с ПЛД в отобранной группе пациенток с рецидивирующим РЯ, чувствительных к платине.
Исследования морфологических и молекулярных особенностей РЯ и более детальное изучения механизма действия трабектедина послужили основанием появления новой гипотезы, предполагающая следующее: трабектедин с ПЛД помимо своего прямого противоопухолевого эффекта увеличивает ответ опухоли к последующему лечению платиновыми производными. И in vitro, и in vivo эти доказательства были подтверждены в ряде исследований [3, 4]. Эффект последующей платиновой терапии был впервые продемонстрирован на трабектедин-резистентных клеточных линиях РЯ. Трабектедин-устойчивые клеточные линии не экспрессировали XPG, белок, участвовавший в системе репарации NER (восстановление за счет иссечения нуклеотидов), и в этих линиях отмечалась устойчивость к трабектедину, но при этом высокая чувствительность к ультрафиолету и платиновой терапии. Полученные результаты согласуются с рядом предыдущих наблюдений, в которых дефицит в системе репарации NER был связан с пониженной чувствительностью к трабектедину, но при этом высокой чувствительностью к цисплатину. Данная гипотеза была исследована Colmegna et al., где к опухолевым ксеногорафным клеткам, устойчивым к трабектедину, применяли цисплатин 5 мг/кг через каждые 7 дней в течение 3 циклов. Рост опухоли в группе с последующей платиновой терапией составил 18% по сравнению с 64,2% в контрольной группе. Данные результаты дали мощное обоснование изучения в клинической практике последовательного применения платиновой терапии после прогрессирования на трабектедине [5, 6].
Клинические преимущества применения трабектедина с ПЛД в качестве опции для пациенток с платиночувствительным рецидивом РЯ с бесплатиновым интервалом менее 1 года были подтверждены в исследовании OVA-301. Первоначальный анализ данных при платиночувствительном рецидиве, где платиносвободный интервал был >6 месяцев, показал, что медиана выживаемости без прогрессирования заболевания (ВБП) (9,2 против 7,5 месяцев) и медиана ОВ (27,0 против 24,1 месяца) были пролонгированы в отношении больных, получавших трабектедин с ПЛД по сравнению только с ПЛД. Далее был проведен еще один анализ лечения пациенток с платиновосвободным промежутком между 6 и 12 меяцами, и он продемонстрировал еще большие преимущества комбинации трабектедина с ПЛД в отдаленных результатах лечения над монотерапией ПЛД (ОВ – 22,4 против 16,4 месяца) [7–9].
Для исследования влияния платиновой реиндукции исследователи ретроспективно проанализировали подгруппу пациенток с платиновосвободным интервалом 6–12 месяцев, получавших лечение препаратами платины при следующем рецидиве (п=94). Медиана ОВ в группе трабектедина с ПЛД составила 27,7 месяца по сравнению с 18,7 в группе, получавшей только монотерапию ПЛД (отношение рисков [ОР]=0,58; р=0,0153). Это первые клинические доказательства гипотезы последовательного лечения платиновой реиндукцией после применения комбинации двух неплатиновых агентов, в частности трабектедина с ПЛД. С точки зрения безопасности, нейротоксичности, которая отрицательно сказывается на качестве жизни пациентов, все соединения платины имеют ограниченное применение для группы больных с рецидивом от 6 до 12 месяцев. При ретроспективном анализе лечения пациенток в исследовании MITO-4, которые находились в стадии клинической ремиссии после первой линии ХТ карбоплатин+паклитаксел (n=120), явления остаточной нейротоксичности были отмечены у 15% больных при рецидиве от 6 до 12 месяцев, у 14% при рецидиве, возникшем более чем через 12 и у 11% при рецидиве от 12 до 24 месяцев после окончания ХТ [10, 11]. Карбоплатин может приводить к кумулятивным идозоограничивающим видам гематологической токсичности, таким как нейтропения, тромбоцитопения (часто тяжелые формы) и анемия. Точно так же цисплатин связан с несколькими кумулятивными и необратимыми видами токсичности, такими как нефротоксичность [12, 13].
Принимая во внимание возникновение на этапе болезни больных РЯ многочисленных ремиссий и рецидивов, онкологи должны заранее правильно планировать лечение больных, не ухудшая их качество жизни и одновременно увеличивая их выживаемость. Побочные действия препаратов платины могут служить барьером на пути их долгосрочного использования. В силу того что комбинация трабектедина с ПЛД не вызывает кумулятивной токсичности, как при применении препаратов платины, его использование вместо платины дает пациенткам время оправиться от предыдущей токсичности. Практический пример иллюстрирует эффективность и безопасность комбинации трабектедина с ПЛД, которые могут быть достигнуты за счет увеличения бесплатинового интервала и достижения повторной платиновой чувствительности.
По данным многочисленных исследований, 15–22% больных серозной аденокарциномой яичников могут быть носительницами герминальной BRCA-1- или BRCA2-мутации, кроме того, у 7% пациенток выявляется соматическая мутация [14]. Полимерная поли-ADP-рибоза (PARP) играет неотъемлемую роль в восстановлении одноцепочечных разрывов ДНК через базовый эксцизионный путь. PARP-ингибиторы были разработаны как новый класс таргетных препаратов, приводящих к блокированию белка PARP на поврежденной цепочке ДНК, следовательно, к блокированию восстановительного иссечения и как следствие – приводящих к коллапсу репликационных вилок ДНК, накоплению двухцепочечных разрывов ДНК [15]. При применении олапариба наблюдается индуцированная синтетическая летальность в опухолях с недостатком в пути восстановления гомологичной рекомбинации, например при мутациях в генах BRCA [16].
На основании данных, полученных в результате II фазы исследования-19, для пациенток с платиночувствительным рецидивом РЯ в качестве поддерживающей терапии при ответе на платиновую терапию олапариб (торговое наименование – Линпарза) был первым одобренным ингибитором PARP. Исследование-19 было международным многоцентровым рандомизированным двойным слепым плацебо-контролируемым исследованием эффективности олапариба по сравнению с плацебо для пациенток с платиночувствительным рецидивом РЯ [17]. В этом исследовании 265 пациенток были рандомизированы в группу, получавшую олапариб в качестве поддерживающей терапии (n=136) или плацебо (n=129). Первичной конечной точкой была ВБП, основанная на оценке исследователя по критериям RECIST 1.0. Ключевые критерии включения: наличие хотя бы двух проведенных ранее линий ХТ на основе препаратов платины до рандомизации и достижение полного или частичного ответа после завершения последней ХТ на основе платиновой терапии по поводу платиночувствительного рецидива. Данное исследование достигло первичной цели: было доказано статистически значимое увеличение ВБП у пациенток, находившихся на монотерапии олапарибом, по сравнению с плацебо в общей популяции больных. Медиана ВБП в группе олапариба была на 3,6 месяца больше, чем в группе плацебо (ВБП – 8,4 против 4,8 месяца для пациенток, получавших олапариб и плацебо соответственно, ОР – 0,35, 95%доверительный интервал [ДИ] – 0,25–0,49; р<0,001). Кроме того, запланированный подгрупповой анализ показал, что пациенты с мутацией BRCA (n=136) получили наибольшее клиническое преимущество от поддерживающей монотерапии олапарибом [17]. В группе пациенток с BRCA-мутацией наблюдалось статистически значимое увеличение ВБП на 6,9 месяца на терапии олапарибом по сравнению с плацебо (ОР=0,18; 95% ДИ – 0,10–0,31; р<0,0001, медиана ВБП – 11,2 против 4,3 месяца). Также было отмечено значительное увеличение времени до 1-й последующей терапии или смерти и времени до 2-й последующей терапии или смерти в группе с поддерживающим олапарибом по сравнению с плацебо. В цели данного исследования не входило проведение оценки ОВ, но анализ с 38- и 58%-ной зрелостью не показал значительных преимуществ ОВ с применением олапариба. Третий обновленный анализ ОВ (77% зрелости на 30.09.2015) представляет собой дополнительные последующие наблюдения за 3 года после предыдущих анализов [18]. Была отмечена тенденция к улучшению ОВ у пациенток, получавших поддерживающую терапию олапарибом, по сравнению с плацебо (ОР=0,73, 95% ДИ – 0,55–0,96), причем наибольшие преимущества наблюдались в подгруппе больных с BRCA-мутацией (ОР=0,62, 95% ДИ – 0,41–0,94). Однако критерий статистической значимости (р<0,0095) не был достигнут. Из пациенток, получавших плацебо, 23% после прогрессирования переключились на лечение ингибиторами PARP. Экспериментальный постаналитический анализ, исключивший всех пациенток, получавших постпрогрессирующую терапию ингибитором PARP, привел к тому, что OВ для 97 пациенток с BRCA-мутацией была достоверно выше при применении олапариба, чем плацебо (ОР=0,52 ,95% ДИ – 0,28–0,97; р=0,039). Оценка качества жизни (HRQoL) в данном исследовании показала, что поддерживающее лечение олапарибом не оказало негативного влияния на качество жизни больных по сравнению с плацебо как для всей группы больных, так и для пациенток с мутацией BRCA.
В общей популяции пациенток к наиболее распространенным побочным эффектам отнесены 3-я и более степени токсичности. В группах получавших терапию олапарибом имели место астения (8% [11 из 136 пациентов] по сравнению с 3% [4 из 128 пациентов] в группе плацебо) и анемия (6% [8 из 136 пациентов] против одного 1% [1 из 128] соответственно). В целом 43% (59 из 136 пациентов) группы олапариба и 23% (29 из 128 пациентов) группы плацебо была снижена доза. Снижение дозы из-за неблагоприятных явлений было зарегистрировано у 25% (34 из 136 пациентов) в группе олапариба и у 4% (5 из 128 пациентов) в группе плацебо. Неблагоприятные явления, приведшие к прекращению лечения, зарегистрированы у 6% (8 из 136 пациентов) группы олапариба и 2% (2 из 128 пациентов) группы плацебо. Все эти побочные эффекты считались связанными с лечением. Для группы олапариба в дополнение к неблагоприятным явлениям, приведшим к позднему прекращению лечения после двух лет терапии, другими неблагоприятными событиями, способствовавшими прекращению лечения, были сердцебиение и миалгия (два неблагоприятных события у одного пациента) и опоясывающий герпес, тошнота, эритематозная сыпь, геморрагический инсульт. В группе плацебо неблагоприятные события, приведшие к прекращению лечения, были зудящая сыпь и тошнота (по одному нежелательному явлению у одного пациента); 22% (30 из 136 пациентов) в группе олапариба и 9% (11 из 128 пациентов) в группе плацебо сообщили о серьезных неблагоприятных явлениях. Не было получено никаких дополнительных сообщений о неблагоприятных явлениях, приведших к смерти на момент обработки данных 2015 г. по сравнению с данными в 2012 г., при котором один пациент умер исключительно от побочных эффектов (геморрагический инсульт и тромбоцитопения, считающиеся связанными с лечением). В целом 202 пациента скончались на момент обработки данных 2015 г. (группа олапариб [n=94] против группы плацебо [n=108]).
В группе олапариба 83 пациента умерли от прогрессирования заболевания; у 1 пациента проявились побочные явления, приведшие к смерти (геморрагический инсульт и тромбоцитопения); 1 пациент умер от комбинации своего основного заболевания и развившегося нежелательного явления (миелодиспластический синдром); 9 пациентов умерли от других причин (сердечная недостаточность [n=1], эвтаназия [n=1], септический шок [n=1], цереброваскулярное расстройство [n=1], кровоизлияние в мозг [n=1] или от неопределенной причины [n=4]). В группе плацебо 99 пациентов умерли от прогрессирования основного заболевания, 9 умерли от других причин (острая почечная недостаточность и пневмония [n=1], легочная эмболия [n=1], сердечно-легочная недостаточность [n=1], септический шок из-за фекаломы [n=1], РЯ [n=1] или неопределенной причины [n=4]). Сообщалось о трех случаях миелодиспластических синдромов или острого миелоидного лейкоза (два в группе олапариба и один в группе плацебо). Все три пациентки, сообщившие о миелодиспластических синдромах или острой миелоидной лейкемии, получили ранее по две линии ХТ. Двое из этих пациенток получали поддерживающую монотерапию олапарибом в течение 57 и 10 месяцев соответственно и одна – плацебо в течение 44 месяцев.
Клинический пример
Пациентка Н. 1953 г.р. обратилась в РОНЦ им. Н.Н. Блохина в январе 2011 г. с жалобами на увеличение живота в объеме, слабость, одышку при физической нагрузке. Уровень маркер СА-125 составил 1260 МЕ/мл. При дообследовании выявлены кистозно-солидно-измененные оба яичника, метастазы по брюшине, образовавшие сливную диссеминацию по брюшине малого таза, перешедшие на большой сальник. Результаты цитологического исследования (материал для исследования – асцитическая жидкость) – аденокарцинома. Клинически значимой сопутствующей патологии выявлено не было. Семейный анамнез: мать пациентки умерла от рака молочной железы. Диагноз: Т3СN0М0, III степень.
В связи с распространенностью заболевания и средней тяжестью состояния больной было решено начать с неоадъювантной ХТ. С 06.02 по 21.03.2011 было проведено три курса неоадъювантной ХТ по схеме: паклитаксел 175 мг/м2+карбоплатин-AUC 1 раз в 3 недели с частичным эффектом по данным УЗИ и снижением маркера СА-125 до 320 МЕ/мл. 09.04.2011 проведена операция в объеме экстирпации матки с придатками, удаление большого сальника в неоптимальном объеме. Остаточная опухоль составила около 30 мм в виде участка опухолевой инфильтрации малого таза. Результаты гистологического исследования: папиллярная серозная цистаденокарцинома. В большом сальнике и в биоптатах метастазы аналогичного строения.
С 26.04 по 04.07.2011 проведено 4 курса ХТ в прежнем режиме с полным клиническим эффектом по данным УЗИ и маркера СА-125 (32 МЕ/мл).
Далее было продолжено динамическое наблюдение. С марта 2012 г. начал отмечаться рост маркера СА-125 до 400 МЕ/мл без клинических признаков прогрессирования. В мае 2012 г. (через 10 месяцев после окончания 1-й линии ХТ) отмечено прогрессирование (метастазы по брюшине и появление асцита), уровень СА-125 составил 1115 МЕ/мл.
При выборе дальнейшей стратегии терапии были рассмотрены следующие варианты лечения, рекомендованные NCCN, ESMO, RUSSCO:
- платиновые комбинации (паклитаксел или ПЛД, или гемцитабин) с возможным добавлением бевацизумаба;
- неплатиновые комбинации (трабектедин+ПЛД).
С 25.05 по 17.10.2012 проведено 6 курсов 2-й линии по схеме: гемцитабин 1000 мг/м2 в 1-й и 8-й дни +карбоплатин-AUC 1 раз в 3 недели с полным эффектом по объективным методам обследования и маркеру СА-125 (28 МЕ/мл). При обследовании в июле 2013 г. выявлено прогрессирование процесса в виде появления метастазов по брюшине и асцита, уровень маркера СА-125 составил 120 МЕ/мл. У пациентки были выявлены явления остаточной токсичности после перенесенной терапии: полинейропатия 1-й ст., алопеция 1-й ст. Выявлена мутация в гене BRCA – 5382ins C.
На выбор дальнейшего лечения оказали влияние следующие факторы: остаточная полинейропатия 1-й ст., наличие мутации BRCA1, желание пациентки использовать препараты, не вызывающие алопецию. Было рассмотрено несколько вариантов комбинаций ХТ: платиновые комбинации (паклитаксел или ПЛД, или гемцитабин), неплатиновые комбинации (трабектедин+ПЛД). Обзор данных свидетельствует об ограниченной чувствительности платиновых производных (бесплатиновый интервал=7 месяцев). Рекомендации ESMO: комбинация неплатиновых производных с безплатиновым интервалом 6–12 месяцев. Применение комбинации трабектедина с ПЛД связано со снижением риска смерти по сравнению с одним ПЛД на 42%; ОР=0,58; р=0,013. In vitro и in vivo доказано повышение чувствительности к платине после терапии трабектедином. Данные исследования фазы II позволили предположить, что полученные результаты эффективности трабектедина с ПЛД во 2-й линии могут быть экстраполированы на последующие линии лечения. Ретроспективный анализ 34 предварительно интенсивно предлеченных больных (среднее количество предыдущих линий – 3, диапазон – 2–10) продемонстрировал результаты лечения в трех и более линиях, как во второй линии лечения. Активность комбинации трабектедина с ПЛД, по-видимому, не связана с числом предыдущих линий ХТ.
Трабектедин оказывается более эффективным в опухолевых клетках с отсутствием функционирования механизмов гомологичной рекомбинации, с мутацией BRCA гена. В группе пациенток с мутацией BRCA1, имевших бесплатиновый интервал от 6 до 12 месяцев, у больных, получавших трабектедин+ПЛД, была достоверно лучше медиана ВБП (13,5 против 5,5 месяцев; р=0,0002) и медиана ОВ (23,8 против 12,5 месяцев; р=0,0086), чем у пациенток, получавших только ПЛД. В отличие от комбинации препаратов платины с таксанами комбинация трабектедина с ПЛД ассоциируется с гораздо более низкой частотой нейропатии и алопеции и не имеет кумулятивной токсичности. Использование этой комбинации может дать время пациентке оправиться от предыдущей платиновой токсичности.
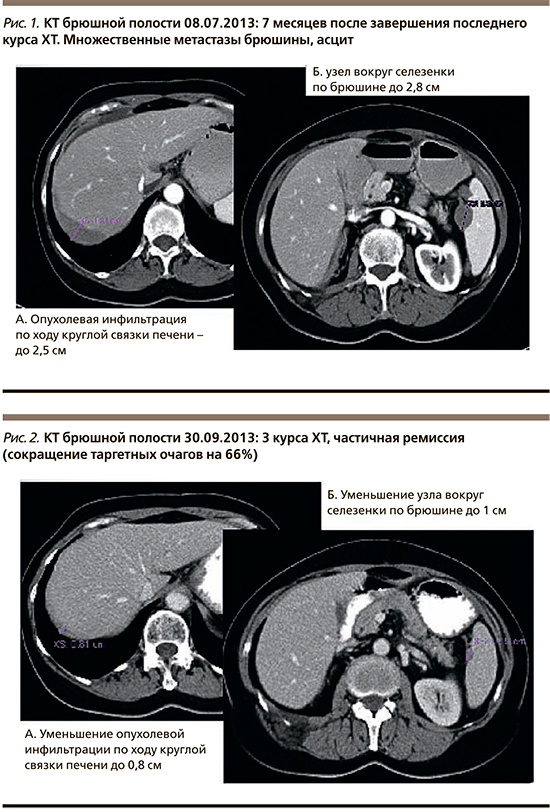
С 31.07.2013 по 02.07.2014 проведено 15 курсов ХТ 3-й линии: трабектедин 1,1 мг/м2+Келикс 30 мг/м2. На фоне лечения отмечены следующие нежелательные явления: нейтропения III ст., длительная нейтропения IV ст. после 3-го курса, что потребовало редукции обоих препаратов на 1 ступень (трабектедин 0,9 мг/м2+Келикс 35 мг/м2), после 5-го курса – тромбоцитопения II ст., анемия II ст., явления острой респираторной вирусной инфекции, в связи с чем 6-й курс был отложен на неделю. Результаты компьютерной томографии после трех курсов ХТ: частичная ремиссия, сокращение таргетных очагов на 66% (рис. 2).
После 6 курсов ХТ сохранялась частичная ремиссия, отмечалась нормализация маркера СА-125 до 15 МЕ/мл (рис. 3).
Проведено еще 9 курсов ХТ (всего 15 курсов). Отмечены нейтропения III ст., повышение АЛТ и АСТ I cт., ладонно-подошвенный синдром I ст., но к сроку проведения ХТ показатели крови восстановились и степень ладонно-подошвенного синдрома не усиливалась. После каждых трех курсов ХТ проводилась компьютерная томография, на которой отмечалось сохранение частичного эффекта.

По желанию пациентки лечение было прекращено, и больная находилась под динамическим наблюдением с контрольным обследованием каждые 12 недель. В марте 2015 г. отмечено прогрессирование заболевания в виде появления метастазов по брюшине, асцит, уровень маркера СА-125 составил 93 МЕ/мл. С марта 2015 по август 2015 г. проведена 4-я линия ХТ (паклитаксел+карбоплатин) с частичным эффектом, уровень СА-125 составил 43 МЕ/мл (рис. 4).
С августа 2015 г. начат прием олапариба 400 мг 2 раза в сутки (т.к. у пациентки выявлена мутация BRCA1) в поддерживающем режиме. При контрольном обследовании через 3 месяца подтвердился частичный эффект. При первом месяце приема имела место тошнота II ст. в течение 2 недель. Пациентка принимала зофран 8 мг 2 раза в сутки (в течение недели). Отмечена месячная анемия I ст. Прием препарата продолжен без снижения дозы. Через 2 месяца прием олапариба переносила удовлетворительно без побочных реакций.
Тошнота и рвота при применении олапариба – распространенные побочные эффекты. В исследовании-19 71% и 34% пациентов сообщили о тошноте и рвоте соответственно. Большинство из этих эффектов были умеренными, 3-й степенью и более страдали только 2% пациентов для каждого симптома. Процентный анализ этих событий показал, что тошнота и рвота обычно отмечались в начале лечения с наиболее частыми явлениями в первый месяц лечения [17]. Первая степень переносилась без применения лечения. При 2-й степени токсичности уже требовалось применение симптоматического лечения в виде пероральных противорвотных средств.
В клинической практике рекомендовано профилактическое применение противорвотных пероральных препаратов (например, метоклопрамид) при начале приема олапариба для предотвращения тошноты и рвоты хотя бы в течение первого месяца приема. Такой подход должен сводить к минимуму необходимость корректировки или прекращения дозы олапариба, позволив пациентам получать непрерывное лечение препаратом. Хотя потребность в апрепитанте крайне маловероятна, при возникновении тяжелой формы тошноты или рвоты этот препарат не следует назначать, т.к. это ингибитор CYP3A и может влиять на концентрацию олапариба в плазме крови [19].
В случаях когда стандартной противорвотной терапии недостаточно, можно временно прекратить прием олапариба и повторно возобновить в той же или в редуцированной дозе после нормализации состояния. Гематологическая токсичность, встреченная у пациенток, получавших олапариб, включала анемии, нейтропении, тромбоцитопении и лимфопении. Несмотря на то что большинство случаев анемии в исследовании-19 в целом были умеренными, 3-я и более степени анемии (основанные на лабораторных значениях уровней гемоглобина) имели место у 7,4% пациенток [17]. Перед началом лечения пациентки должны быть осведомлены о гематологических побочных эффектах и возможности переливания крови. Пациентки не должны начинать лечение олапарибом раньше их восстановления от гематологической токсичности, вызванной предыдущей противоопухолевой терапией (уровни гемоглобина, тромбоцитов и нейтрофилов должны быть в пределах нормы или CTCAE). Для мониторинга клинически значимых изменений любого параметра во время лечения рекомендуется проводить начальный анализ крови с последующей ежемесячной оценкой показателей крови (в течение первых 12 месяцев лечения олапарибом), а затем периодически (если данные остаются в нормальном диапазоне) каждые 3 месяца. При возникновении 3-й степени токсичности и более лечение олапарибом следует прекратить максимум на 4 недели.
В случае анемии может потребоваться переливание крови. Если 3-я или 4-я степень гематологической токсичности уменьшилась хотя бы до 1-й степени в течение максимум 28 дней после прерывания терапии, пациенты должны возобновить лечение при более низкой дозе (уменьшение дозы до 200 мг 2 раза в день до общей суточной дозы 400 мг). В случае развития 3-й или 4-й степени гематологической токсичности, которые не разрешились в течение 28 дней, и ранее у пациентаки уже была редуцирована доза препарата на 2-й ступени (как минимум 100 мг 2 раза в день до общей суточной дозы 200 мг), лечение следует прекратить. Если у пациентки развивается тяжелая гематологическая токсичность или ей по-прежнему требуется переливание крови после снижения дозы, лечение олапарибом следует прерывать и проводить соответствующие гематологические исследования. Следует также обратиться к гематологу. Необходимо исключить дефицит витамина B12, фолиевой кислоты и железа. Если параметры крови остаются клинически аномальными после 4 недель прерывания дозы олапариба, рекомендуются биопсия костного мозга и цитогенетический анализ.
При контрольном обследовании пациентки каждые 3 месяца нарастала положительная динамика в рамках частичной ремиссии (рис. 5).
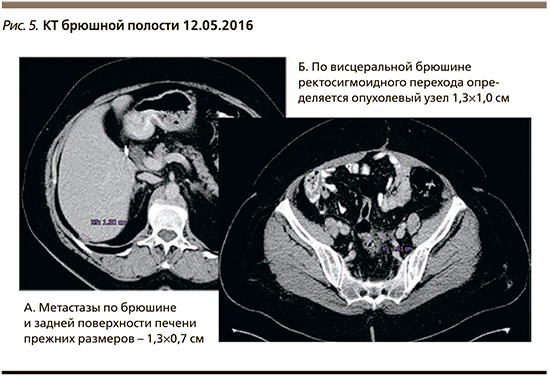
При обследовании в августе 2016 г. отмечено небольшое увеличение асцита и повышение маркера СА-125 до 87 МЕ/мл. Пациентке рекомендовано продолжение приема олапариба. Через еще 6 месяцев (январь 2017 г.) прогрессировал процесс в виде появления метастазов в печени и по брюшине, уровень СА-125 – 398 МЕ/мл. Прием олапариба в поддерживающем режиме после 4-й линии ХТ составил 16 месяцев. Далее до апреля 2018 г. пациентка получила две линии ХТ паклитакселом и карбоплатином со стабилизацией процесса и иринотеканом с бевацизумабом с частичным эффектом. В апреле 2018 г. отмечено прогрессирование процесса в виде увеличения метастазов по брюшине, в печени и появление метастазов в головном мозге.
С момента постановки диагноза прошло 87 месяцев (более 7 лет).
Обсуждение
Эффект комбинации трабектедина с ПЛД для пациентки был частичным и длительным. В процессе терапии удалось увеличить время до третьей ХТ на 20 месяцев, что позволило пациентке восстановиться после предыдущей платино-таксановой терапии. Явления токсичности, наблюдавшиеся при лечении ПЛД с трабектедином, отмечены на первых курсах лечения и после редукции дозы, в дальнейшем пациентка хорошо переносила лечение. Последующая платиновая реиндукция привела к частичному регрессу, позволившему пациентке получить в поддерживающем режиме олапариб. Результаты лечения данной больной согласуются с гипотезой, будто после прогрессирования на терапии трабектедином увеличивается эффективность последующей платиновой терапии и эффективность трабектедина увеличивается для пациенток с BRCA-мутацией. В 2015 г. появилась новая группа препаратов (PARP-ингибиторы) по результатам исследования-19, первый PARP-ингибитор олапариб продемонстрировал достоверное увеличение ВБП при использовании его в поддерживающем режиме. Пациентка получала олапариб в поддерживающем режиме 16 месяцев.
Заключение
Описанный случай свидетельствует о важном значении грамотного последовательного чередования лечения больных РЯ, позволяющего достигать существенной стабилизации состояния пациентов, регресса онкологического процесса без ухудшения качества их жизни.


