Введение
Заболеваемость и смертность, ассоциированные с меланомой кожи, в России, как и в мире в целом, ежегодно растут. Так, по данным МНИОИ им. П.А. Герцена, с 2007 по 2017 г. заболеваемость меланомой выросла на 40,26% [1].
В настоящее время наблюдается высокий показатель запущенности меланомы кожи – 19% всех случаев меланомы выявляются на поздних (III–IV) стадиях. Одногодичная летальность при меланоме всех стадий в 2017 г. составила в России 9,8%, что несколько ниже данного показателя 2016 г. (10,5%), в т.ч. за счет появления современных методов терапии, постепенно внедряемых в клиническую практику взамен малоэффективной при данной нозологии химиотерапии [1, 2].
Известно, что среди всех онкологических заболеваний именно метастатическая форма меланомы имеет наибольший риск распространения в центральную нервную систему [3, 4]. Частота метастазирования в головной мозг (ГМ) для данной нозологии достигает 43% по объединенным данным клинических исследований, а по данным аутопсий этот процент еще выше – до 75% [4, 5].
Наличие метастазов в ГМ традиционно связывают с крайне неблагоприятным прогнозом (медиана общей выживаемости [ОВ] для таких пациентов составляет 4–5 месяцев), причем наиболее тяжелыми являются ситуации с наличием у больных неврологической симптоматики и вовлечением в метастатический процесс мозговых оболочек [6, 7]. В настоящее время доступны различные варианты терапии метастатической меланомы, включая таргетную терапию (ТТ) ингибиторами BRAF и MEK в случае BRAF-положительного статуса пациента, а также иммунотерапию анти-CTLA-4 и анти-PD-1-препаратами.
Появление новых возможностей в клинической практике позволило существенно улучшить прогноз при метастатической форме заболевания, однако пациенты с метастазами в ГМ часто исключаются из крупных клинических исследований, что ограничивает доказательную базу эффективности современных методов терапии данной категории больных [8–12].
Данные многоцентрового открытого исследования II фазы COMBI-MB (NCT02039947) продемонстрировали значительную эффективность комбинации таргетных препаратов у BRAF-позитивных пациентов с меланомой и метастазами в ГМ, указывая на эффективность ТТ у данной когорты больных [13].
В статье представлен опыт СПбГБУЗ ГКОД в лечении пациентов с метастатической меланомой, имеющих активирующую мутацию BRAF, в т.ч. с метастатическим поражением ГМ.
Целью настоящей работы явилась оценка клинических результатов применения таргетной терапии у пациентов с диссеминированной меланомой, получивших лечение на базе СПбГБУЗ ГКОД. Также особое внимание было уделено эффективности таргетной терапии и комбинированных подходов у пациентов с наличием метастатического поражения головного мозга.
Методы
Под нашим наблюдением находились 44 пациента с диагнозом диссеминированной меланомы кожи с активирующей мутацией в гене BRAF, получавших лечение в СПбГБУЗ «Городской клинический онкологический диспансер» с 2002 г. по настоящее время. Среди обследованных были 25 (56,8%) женщин и 19 (43,2%) мужчин. Возраст пациентов варьировался от 26 лет до 81 года. Медиана возраста составила 54 года (95% доверительный интервал [ДИ] – 49,00–59,00), средний возраст пациентов – 52,48±1,883 (95% ДИ – 48,58–56,27). При первичной постановке диагноза меланомы у 7 больных стадия процесса была расценена как I (15,9%), у 20 (45,5%) – как II, у 12 (27,3%) – как III,и у 5 пациентов (11,3%) изначально имела место IV стадия.
На этапе исходной оценки (на момент начала ТТ) всем пациентам (100%) проведено молекулярно-генетическое исследование и выявлена активирующая мутация в гене BRAF. Также были выполнены стандартные клинико-диагностические процедуры. К началу ТТ у 7 (15,9%) пациентов имелось метастатическое поражение только 1 органа, у 12 (27,3%) – 2, у 24 больных (54,5%) метастазы локализовались в ≥3 органах. Метастатическое поражение ГМ было выявлено у 8 (18,2%) пациентов. Общее состояние больных, оцененное по шкале ECOG, составило «0» у 8 человек (18,2%), «1» – у 29 (65,9%), «2» – у 4 (9,1%) и «3» – у 2 (4,5%).
В рамках терапии диссеминированной меланомы до назначения ТТ пациенты получили от 1 до 5 линий лечения цитостатиками и/или иммуноонкологическими препаратами (например, дакарбазин, паклитаксел+карбоплатин, ипилимумаб, ниволумаб). На момент назначения ТТ 7 (15,9%) пациентов уже получили 1 линию лечения, 8 (18,2%) – 2, 3 (6,9%) ≥3. Следует особо отметить, что более половины, а именно 26 (59%) пациентов, получали ТТ в рамках 1-й линии (т.е. ранее не получали лекарственного лечения по поводу метастатического процесса). Также следует подчеркнуть, что 4 пациента из 44 (9%) в рамках предшествовавшего лечения уже получали иммуноонкологическую терапию (anti-CTLA4 – 3, анти-PD1 – 1). Время от момента регистрации IV стадии заболевания до начала ТТ варьировалось от 0 до 43 месяцев. Среднее значение данного показателя составило 5,40±1,23 месяца (95% ДИ – 2,91–7,88). Медиана времени до начала ТТ составила 2 месяца (95% ДИ – 2,00–4,39). Столь быстрое начало ТТ обусловлено, по-видимому, тем, что больше половины пациентов получали ТТ в рамках 1-й линии терапии, поэтому в большинстве случаев от регистрации IV стадии заболевания до назначения терапии проходило ≤2 месяцев (у 20 из 26 пациентов, что составило 76,9%).
В анализ вошли пациенты, получавшие как BRAF-ингибитор в монорежиме, так и комбинацию ингибиторов BRAF и MEK. Тридцать один пациент, подвергнутый нашему анализу, получил комбинацию ингибиторов BRAF и MEK (большинство, а именно 22 пациента, получало дабрафениб и траметиниб, вемурафениб+кобиметиниб получили 9 человек). Число пациентов, получавших монотерапию BRAF-ингибитором, составило 13 (11 пациентов получали вемурафениб и 2 – дабрафениб).
В анализ вошли в т.ч. 8 пациентов, получавших ТТ по поводу метастатического поражения ГМ. Все они перед назначением ТТ подверглись лучевой терапии: 6 пациентов получили как минимум 1 сеанс стереотаксической радиохирургии, 2 пациента перенесли облучение всего ГМ. Два пациента из 8 перенесли хирургическое лечение метастазов меланомы в ГМ. На момент назначения ТТ неврологическая симптоматика присутствовала у 4 пациентов из 8. В дальнейшем всем пациентам было начато лечение таргетными препаратами: 6 пациентов получили комбинацию ингибиторов BRAF и MEK (дабрафениб траметиниб) и 2 – монотерапию BRAF-ингибитором (вемурафениб).
Результаты
При анализе всей популяции пациентов (т.е. получавших как моно-, так и комбинированную ТТ) к настоящему моменту времени (апрель, 2019) прогрессирование процесса зарегистрировано у 29 (66%) больных из 44. Время наблюдения за пациентами от начала ТТ составило от 6 до 48 месяцев. Медиана выживаемости без прогрессирования (ВБП) для пациентов всех подгрупп составила 12 месяцев (95% ДИ – 7,00–22,00). ВБП на отметке 6 месяцев составило 86,36% – 38 пациентов из 44, ВБП на отметке 1 год – 44,74% (17 пациентов из 38).
Анализ группы пациентов, получавших ТТ по поводу метастатического поражения ГМ, принес достаточно обнадеживающие результаты. Время наблюдения за пациентами от начала лечения ТТ составило от 9 до 26 месяцев. К настоящему моменту времени (апрель, 2019) прогрессирование процесса зарегистрировано у 3 из 8 пациентов (2 больных группы комбинации дабрафениб+траметиниб и 1 пациент на монотерапии вемурафенибом).
При анализе ВБП в подгруппе пациентов без поражения головного мозга медиана ВБП составила 10 месяцев (95% ДИ – 6,00–15,00). Средняя ВБП на этапе данного анализа составила 16,90±3,19 месяца (95% ДИ – 10,64–23,16).
Медиана ВБП в подгруппе пациентов с метастазами в ГМ не достигнута. Средняя ВБП в этой группе – 17,86±3,3 месяца (95% ДИ – 11,42–24,33). Шесть месяцев без прогрессирования получали ТТ 7 пациентов из 8. Данные о ВБП в обеих подгруппах в виде графиков представлены на рис. 1.
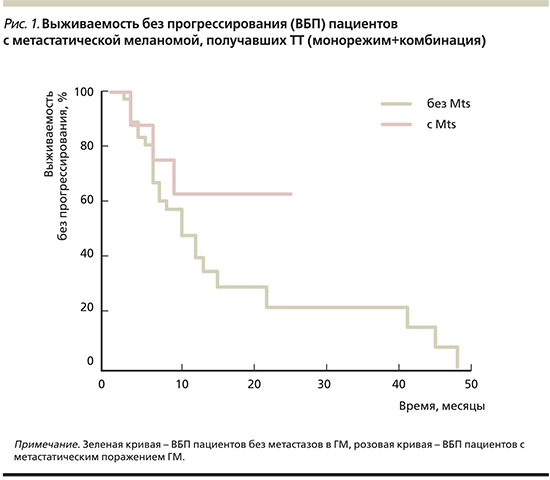
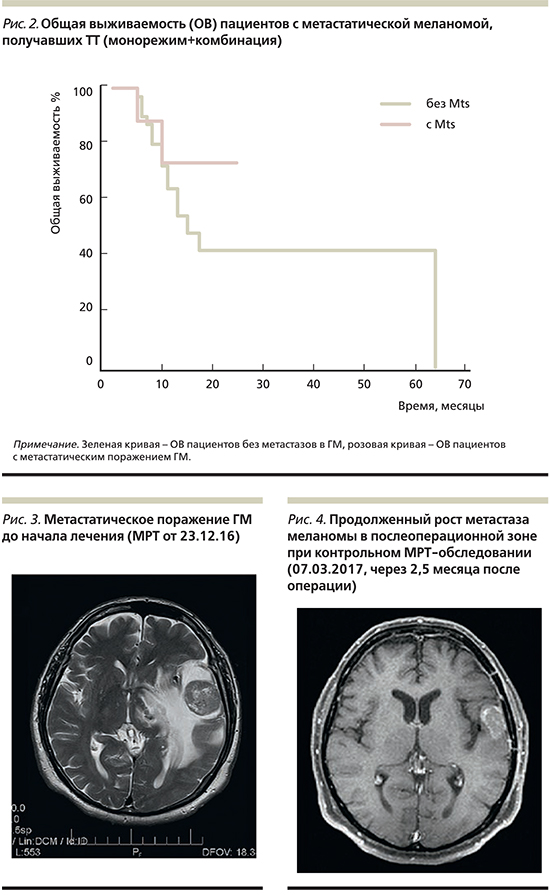
При анализе всей популяции пациентов медиана ОВ в общей группе составила 17 месяцев (95% ДИ – 11,00–64,00). Живы 23 (52,27%) из 44 пациентов.
При анализе ОВ в подгруппе пациентов без поражения ГМ медиана ОВ составила 15 месяцев (95% ДИ – 11,00–64,00). Средняя ОВ на этапе данного анализа составила 33,16±5,89 месяца (95% ДИ – 21,62–44,70).
Медиана ОВ в подгруппе пациентов с метастазами в ГМ не достигнута. Средняя ОВ в этой группе составила 20,31±2,86 месяца (95% ДИ – 14,71–25,92).
Данные по ОВ в обеих подгруппах в виде графиков представлены на рис. 2.
Наш клинический опыт демонстрирует сопоставимую эффективность ТТ по показателям ВБП и ОВ у пациентов с меланомой вне зависимости от наличия метастатического поражения ГМ. В терапии данной категории больных очень важным представляется комплексный подход, включающий как применение ТТ, так и проведение хирургического лечения и лучевой терапии. Не менее важным фактором является быстрое начало лечения.
Клинический пример ведения пациента с метастазами меланомы в ГМ
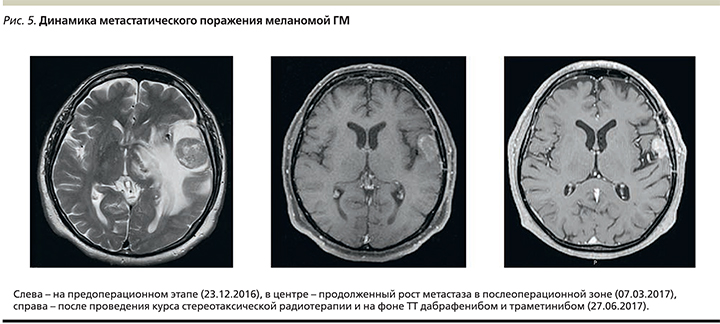
Пациент Б. 1957 г. рождения. В анамнезе: папиллярная карцинома левой почки pT3N0M0, по поводу которой в феврале 2013 г. выполнена левосторонняя нефрэктомия. В дальнейшем при дообследовании по результатам компьютерной томографии данных за прогрессирование рака левой почки не получено. В октябре 2016 г. остро отмечено появление очаговой и общей неврологической симптоматики. Пациенту проведено дообследование. По результатам магнитно-резонансной томографии (МРТ) ГМ с контрастом от 23.12.2016: объемное образование левой височной доли 3,8×3,3×3,6 см с выраженной зоной отека, компримирует прилежащие отделы мозга, базальные структуры слева, образование смещает структуры вправо до 0,7 см (рис. 3).
29.12.2016 выполнена операция – костно-пластическая трепанация черепа слева, удаление новообразования в левой височно-теменной области. Иммуногистохимическое (ИГХ) исследование удаленного опухолевого материала: положительная экспрессия маркера мелан-А, отрицательная – p63, CK5/6; отмечается очаговое слабое неспецифическое фоновое окрашивание PAX-8 единичных опухолевых клеток и ядерная экспрессия данного маркера в клетках лимфоидного ряда. Новообразование метастатическое. ИГХ-картина наиболее соответствует метастазу беспигментной меланомы.
После получения результатов ИГХ-исследования пациент был дополнительно направлен на консультацию дерматолога. При осмотре кожных покровов выявлен очаг атипичной пигментации на коже спины. Проведена биопсия с последующей операцией: иссечение меланомы кожи спины (20.02.2017). Гистологическое заключение: поверхностно распространяющаяся меланома с началом вертикального роста, 3-й уровень инвазии по Кларку, толщина опухоли по Бреслоу 1 мм. Во всем препарате два митоза, под опухолью очаги выраженной лимфоидной инфильтрации. МГ-исследование: выявлена активирующая мутация BRAF-V600E.
При контрольном МРТ-иссле-довании ГМ 07.03.2017 (рис. 4) в послеоперационной зоне определяется продолженный рост метастатического образования – 3,1×1,8×3,0 см в верхнелатеральных отделах послеоперационной зоны без признаков компрессии и отека.
Тактика лечения в отношении данного пациента была обсуждена на консилиуме. Рекомендовано выполнение курса лучевой терапии (стереотаксической радиотерапии) и ТТ-комбинацией ингибиторов BRAF и MEK (дабрафениб+траметиниб) с оценкой эффекта по МРТ в динамике.
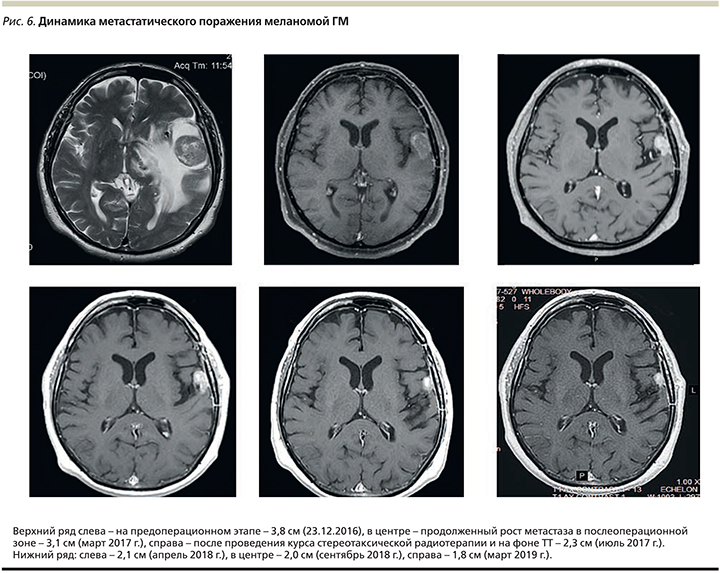
ТТ была начата с марта 2017 г. в режиме дабрафениб 150 мг внутрь 2 раза в день с параллельным приемом траметиниба 2 мг внутрь 1 раз в день. С 18.05.2017 по 24.05.2017 проведен курс стереотаксической радиотерапии в режиме гипофракционирования на линейном ускорителе к мишени – рецидив метастаза меланомы в левой височной доле. Проведено 5 фракций по 6 Гр в среднем до СОД 30 Гр.
При контрольном МРТ-исследовании в июне 2017 г. зарегистрирована стабилизация опухолевого процесса: уменьшение опухолевого очага на 26% по RECIST версии 1.1 (рис. 5).
По данным динамического МРТ-обследования, интракраниально с апреля 2018 г. достигнут объективный ответ – частичный регресс опухолевого процесса на 32% согласно RECIST 1.1 (рис. 6). По экстракраниальным очагам данных за прогрессирование не получено. Пациент продолжает получать комбинацию дабрафениба и траметиниба. Проводится динамическое обследование метастатического поражения ГМ, по результатам которого отмечено продолжение углубления ответа до уменьшения на 42% по RECIST 1.1 к марту 2019 г.
К настоящему времени (апрель 2019 г.) пациент получает комбинированную ТТ в течение 26 месяцев. Общее состояние больного остается удовлетворительным (ECOG 1). Отмечена удовлетворительная переносимость комбинации таргетных препаратов. Нежелательные явления в период лечения – гипотензия 1–2-й степеней. Не потребовалось прерывать или редуцировать дозу ни дабрафениба, ни траметиниба.
Продолжительность жизни пациента с момента диагностирования метастатической стадии заболевания с поражением меланомой ГМ составила 2,5 года, из них 26 месяцев – на фоне комплексного лечения (хирургическое лечение+стереотаксическая радиотерапия+ТТ). Наблюдение за пациентом продолжается. Применение современных комплексных методов лечения с индивидуальным подходом к больному в реальной клинической практике без сомнения дает надежду пациентам с диагнозом меланомы с метастазами в ГМ, еще до недавнего времени считавшегося некурабельным заболеванием.
Обсуждение
Несмотря на появление в клинической практике множества новых возможностей, лечение пациентов с метастатической меланомой и метастазами в центральную нервную систему остается важной проблемой современной клинической онкологии. В связи с высокой смертностью, крайне низкой эффективностью химиотерапии и особенно неблагоприятным прогнозом у данной когорты больных, выбор оптимальной схемы лечения при метастатическом поражении ГМ остается непростой задачей, требующей проведения дальнейших клинических исследований с широким привлечением данной группы пациентов.
Заключение
Наш клинический опыт, один из примеров которого приведен в данной статье, наглядно демонстрирует, что применение комплексного подхода в сочетании с ТТ в реальной клинической практике для лечения больных меланомой и метастатическим поражением ГМ позволяет увеличивать ВБП и ОВ таких пациентов, делая ее сопоставимой с таковой в отсутствие поражения ГМ и приводя к значительному регрессу метастатических очагов и улучшению качества жизни пациентов.


