Введение
Линейный иммуноглобулин A (IgA)-зависимый дерматоз, также известный как линейный IgA-дерматоз (ЛАД), является редким хроническим приобретенным иммунопосредованным заболеванием, которое поражает кожу и слизистые оболочки, характеризуется появлением субэпидермальных пузырей, индуцированных аутоантителами IgA, направленными против нескольких аутоантигенов с разной молекулярной массой, расположенных в зоне базальной мембраны кожи и слизистых оболочек многослойного плоского эпителия. Заболевание встречается достаточно редко, характеризуется схожестью клинических и морфологических проявлений с другими буллезными дерматозами, в силу чего нередко возникают диагностические ошибки.
В данной статье приводим описание клинического случая линейного IgA-зависимого дерматоза, который по своей клинической картине и результатам гистологических исследований биоптатов кожи имитировал герпетиформный дерматит Дюринга (ГД).
Клинический случай
Больная Б. 1986 г. рождения поступила в отделение дерматовенерологии и дерматоонкологии ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского» (МОНИКИ) с жалобами на высыпания на коже туловища, верхних и нижних конечностей, которые сопровождались зудом и болезненностью.
Пациентка больна в течение 4 месяцев. На коже предплечий, ладоней и подошв заметила появление отечных бляшек красного цвета округлой формы, которые сопровождались умеренным зудом. Одновременно отметила подъем температуры тела до 37,4°С. В течение двух-трех дней центральная часть бляшек уплостилась, а по периферии сохранялся отечный венчик. Пациентка обратилась к дерматологу и с диагнозом «контактный дерматит» получала лечение антигистаминными препаратами, десенсибилизирующими средствами, наружными противовоспалительными средствами. Кожный процесс продолжал прогрессировать. Высыпания распространились на кожу верхних конечностей, туловища, бедер и голеней. На фоне отечных бляшек стали появляться пузырьки. Пациентка отмечала цикличность развития высыпаний: в течение суток появлялись уртикарные бляшки, которые постепенно увеличивались в диаметре, на следующие сутки преимущественно по периферии бляшек появлялись пузырьки с плотной покрышкой. Центральная часть бляшек регрессировала в течение 3–4 дней, элементы приобретали кольцевидный характер. Через несколько дней они регрессировали с формированием на их месте гиперпигментации. Появление новых высыпаний носило волнообразный характер каждые 5–6 дней.
Для уточнения диагноза пациентка была госпитализирована в клинику. Из анамнеза жизни: имела в течение последних трех лет контакт с хлорсодержащими соединениями по месту работы, курит в течение 14 лет, аллергоанамнез без особенностей. Сопутствующие заболевания: эрозия шейки матки, порок митрального клапана, недостаточность кровообращения 2-й степени, функциональный класс – 2, диффузный токсический зоб 2-й степени, миопия обоих глаз, хронический пиелонефрит, ремиссия, железодефицитная анемия средней степени тяжести, хронический гайморит, ремиссия. Ишемическая болезнь сердца: острый инфаркт миокарда нижней стенки левого желудочка с подъемом сегмента ST (07.03.2017). Перенесенные операции: протезирование митрального клапана механическим протезом Карбоникс 30, пластика трикуспидального клапана по de Vega (25.01.2017, тромбоэкстрация из огибающей артерии (07.03.2017). Препараты, принимаемые в связи с сопутствующими заболеваниями: ацетилсалициловая кислота+магния гидроксид 75+15,2 мг, 1 таблетка 1 раз в день, Варфарин 2,5 мг, 2 таблетки 1 раз в день.
Объективно: больная правильного телосложения, гипостеник. Периферические лимфатические узлы не увеличены, при пальпации безболезненны. Границы легких в пределах нормы, перкуторно – ясный легочный звук, дыхание везикулярное, хрипов нет. Частота дыхательных движений – 15 в минуту. Границы сердца несколько увеличены влево, тоны сердца звучные, ритмичные. Пульс – 78 ударов в минуту, артериальное давление – 112/60 мм рт.ст. Печень по краю реберной дуги, край ровный. Симптом Пастернацкого отрицательный с обеих сторон. Физиологические отправления в норме.
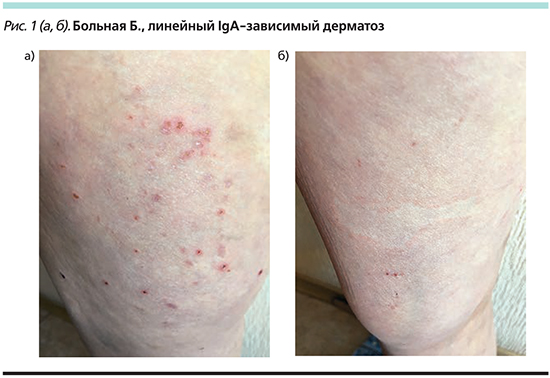
Локальный статус: кожный процесс подостро-воспалительного характера, распространенный, симметричный, полиморфный. Локализуется на коже верхних и нижних конечностей, туловища. Определяются бляшки округлой или неправильной формы диаметром от 1 до 10 см бледно-розового цвета, по периферии которых имеется прерывистый уртикарный венчик синюшно-красного цвета шириной до 1 см, несколько возвышающийся над уровнем окружающей кожи (рис. 1а). На фоне отдельных бляшек имеются сгруппированные пузырьки с серозным содержимым и плотной покрышкой диаметром до 2 мм. На тыльной поверхности правой стопы с медиальной стороны локализуется пузырь диаметром 1,6 см с серозным содержимым и вялой покрышкой, симптом Асбо–Хансена отрицательный, симптом Никольского отрицательный. На фоне высыпаний множественные линейные экскориации и геморрагические корки (рис. 1б). На местах разрешившихся бляшек пятна синюшно-красного и бледно-коричневого цвета с приподнятым периферическим валиком. Слизистые оболочки интактны. Ногтевые пластины V пальцев стоп утолщены, желтого цвета, крошатся. Остальные ногтевые пластины и волосы не изменены. Субъективно: умеренный зуд.
На основании анамнеза и клинических данных больной был выставлен предварительный диагноз «герпетиформный дерматит Дюринга, уртикарная форма». Для подтверждения диагноза рекомендовано проведение гистологического и иммуноморфологического исследований. При гистологическом исследовании в эпидермисе определены фокусы спонгиоза с экзоцитозом нейтрофилов, вакуолизация цитоплазмы отдельных клеток эпидермиса. В дермальных сосочках наблюдались скопления нейтрофилов в виде микроабсцессов и цепочек вдоль базального слоя эпидермиса (рис. 2). В более глубоких отделах дермы периваскулярные лимфогистиоцитарные инфильтраты. Гистологические изменения более всего соответствовали герпетиформному дерматиту. Результаты прямой иммунофлуоресценции: IgG – накоплений в сосочковом слое дермы, в базальной мембране и эпидермисе не выявлено. IgM – незначительно в сосочковом слое дермы. IgA – незначительно в дерме, четкая линейная фиксация вдоль базальной мембраны эпидермиса (рис. 3). С3-компонент комплемента – определяется в незначительном количестве в сосочковом слое дермы. Иммуногистохимические признаки соответствовали линейному IgA-зависимому дерматозу.

Из обследования: клинический анализ крови: гемоглобин 91,2 г/л, эритроциты 3,94 1012/л, гематокрит 0,28 l/l, средний объем эритроцита 71 fl, среднее содержание гемоглобина 23 пг, тромбоциты 351,0–109/л, лейкоциты 5,13–109/л, лимфоциты 38,0 %, моноциты 14,0 %, эозинофилы 3,0 %, палочкоядерные 1,0%, сегментоядерные 44,0%, анизоцитоз+, пойкилоцитоз+, СОЭ 23 мм/ч. Общий анализ мочи без патологии. Биохимический анализ крови: билирубин общий 17,9 мкмоль/л, билирубин прямой 4,0 мкмоль/л, билирубин непрямой 13,9 мкмоль, холестерин общий 3,1 ммоль/л, общий белок 67 г/л, глюкоза 4,4 ммоль/л, АЛТ 18 ЕД/л, АСТ 20 ЕД/л, креатинин 37 мкмоль/л, щелочная фосфатаза 86 ЕД/л. Коагулограмма крови: АЧТВ-SS 46,7 с, протромбиновое время 58,4 с, протромбиновое отношение 4,8, протромбиновая активность по Квику 13%, МНО 4,64 единицы, фибриноген 4,74 г/л. Флюорография без патологии. Консультация гинеколога: киста правого яичника(?), эктопия шейки матки(?), рекомендовано ультразвуковое исследование (УЗИ) органов малого таза. УЗИ органов малого таза (7-й день менструального цикла): тело матки длина 44 мм, толщина 33 мм, ширина 42 мм, расположено в anteflexio, контуры ровные, четкие, обычной формы. Миометрий средней эхогенности, однородной структуры. Очаговые образования не определяются. М-эхо толщиной 5 мм.
М-эхо полностью представлено эндометрием, эхогенность и структура эндометрия соответствуют дню менструального цикла. Граница смыкания листков эндометрия передней и задней стенок ровная и четкая. Граница миометрия с эндометрием четкая, ровная. Полость матки не расширена, не деформирована, дополнительных структур и образований в полости не определяется. Шейка матки без особенностей, средней эхогенности соответствует эхогенности миометрия. Эндоцервикс не утолщен, однородной структуры. Цервикальный канал не расширен, с четкой ровной линией смыкания. Определяются мелкие кисты. Правый яичник размером 33×21×24 мм, с четкими ровными контурами, строма однородной структуры. Фолликулярный аппарат выражен, фолликулы максимальным диаметром 14 мм, в одном срезе не более 4–5 штук. Левый яичник размером 23×18×17 мм, с четкими ровными контурами, строма однородной структуры. Фолликулярный аппарат выражен, фолликулы максимальным диаметром до 10 мм, в одном срезе не более 3–4 штук. Патологические образования в полости малого таза не определяются. Свободной жидкости в малом тазу нет. Вены малого таза расширены до 7 мм. Лимфатические узлы малого таза не визуализируются. Электрокардиограмма: ритм синусовый, правильный. Частота сердечных сокращений – 84 удара в минуту. Нормальное направление электрической оси сердца. Гипертрофия миокарда левого желудочка. Консультация эндокринолога: диффузный токсический зоб 2-й степени. Тиреотоксикоз, рецидив(?), рекомендовано: УЗИ щитовидной железы, кровь на гормоны: тиреотропный гормон, свободный Т4, антитела к рецепторам ТТГ3.
На основании данных иммуноморфологического исследования больной был поставлен диагноз «линейный IgA-зависимый дерматоз». Рекомендовано лечение дапсоном 1 г в сутки.
Обсуждение
Первое описание ЛАД в 1901 г. принадлежит J.T. Bowen, который в течение 4 лет описал 15 детей с пузырными высыпаниями на коже и слизистых оболочках, сопровождавшихся незначительным зудом. Данное заболевание автор рассматривал как герпетиформный дерматит Дьюринга (ГД), хотя отмечаено, что клиника несколько отличается от классических проявлений ГД [1, 2]. Через несколько лет, основываясь на анализе медицинской документации, R. Kim и R.K. Winkelmann выделили 22 случая предполагаемого ГД у детей, которые также имели некоторые клинические отличия. Из 22 пациентов 18 имели клинические признаки, больше указывающие на буллезный пемфигоид (БП), нежели на ГД, в связи с чем была выделена новая отдельная форма БП, которую назвали «буллезный пемфигоид детского возраста» [3]. В дальнейшем был предложен термин «хроническая буллезная болезнь детского возраста» (ХББДВ) [4]. В последующие годы были описаны пациенты, которые имели перекрестную для БП и ГД клиническую и гистологическую картину [5, 6]. Только в 1988 г., когда было установлено, что при ХББДВ отмечается наличие непрерывных линейных отложений IgA и C3-комплемента вдоль зоны базальной мембраны, после чего ХББДВ стали называть ЛАД [7]. В настоящее время признается, что ЛАД имеет два возрастных пика развития во взрослом возрасте и в детском. В последнем случае некоторые авторы продолжают использовать термин ХББДВ [8].
ЛАД является одним из самых редких субэпидермальных буллезных заболеваний с частотой встречаемости от 0,2 до 2,3 случая на 1 млн населения в год. Заболевание манифестирует либо в детском, либо в зрелом возрасте. У детей первые высыпания появляются в 6-месячном возрасте и периодически обостряются до младшего школьного возраста. Взрослая форма поражает преимущественно лиц зрелого возраста [9]. Выявлена связь ЛАД у детей и взрослых с человеческими лейкоцитарными антигенами (HLA): в Англии у больных часто встречался антиген HLA B8 [10], тогда как в Полинезии, Японии и Китае этот гаплотип не регистрировался [8]. У детей с ХББДВ отмечали значительное увеличение частоты HLA Cw7 (р=0,01), HLA B8 (р=0,03) и HLA DR3 (р=0,007). Высокая частота встречаемости была также обнаружена для HLA DR2 и HLA DR3 (р=0,005) и менее высокая для HLA DR1 или HLA DR4 (р=0,05). У взрослых статистически значимым было увеличение частоты HLA Cw7 (р=0,02) [11].
Точный патофизиологический механизм аутоиммунного ответа при ЛАД остается предметом непрерывного исследования. Известно, что в нем задействованы как гуморальный, так и клеточный иммунные ответы, которые приводят к активации комплемента, увеличению количества воспалительных клеток и высвобождению протеолитических ферментов. Было также установлено, что IgA-антитела, участвующие в ЛАД, относятся к подклассу A1 [12]. Мишенью для этих антител являются компоненты комплекса адгезии дермоэпидермального соединения, чаще всего антиген 97 кДа (LABD-97) и антиген 120 кДа (LAD-1), которые локализуются в lamina lucida. Эти антигены являются фрагментом BP180/коллаген XVII – трансмембранного белка II типа полудесмосом, который является ключевым структурным компонентом, участвующим в эпидермально-дермальной адгезии [8]. Лимфоциты, нейтрофилы и эозинофилы также вовлечены в иммунный ответ при ЛАД. Пузыри формируются из-за повреждения тканей, вторичного по отношению к локализованному воспалительному ответу, который развивается с привлечением нейтрофилов, дегрануляцией тучных клеток и высвобождением протеолитических ферментов [9]. Плазминоген, продуцируемый печенью проэнзим, расщепляется до своей активной формы – плазмина – активатором плазминогена урокиназного или тканевого типа. Активатор плазминогена урокиназного типа обильно встречается в нормальной человеческой коже и вырабатывается кератиноцитами, тогда как тканевый тип обнаруживается в коже людей с различными заболеваниями, поражающими кожу и слизистые [13]. Плазмин затем способен продуцировать антиген 97 кДа, участвующий в ЛАД, путем расщепления коллагена XVII типа [14]. Под действием плазмина прометаллопротеиназа 9 (про-MMP-9) превращается в MMP-9/желатиназу B, которая затем расщепляет и инактивирует ингибитор альфа-протеиназы (al-PI), роль которого заключается в ингибировании эластазы нейтрофилов. Следовательно, свободная нейтрофильная эластаза вносит вклад в эпидермально-дермальную отслойку [15].
Кожные проявления пациентов с ЛАД очень часто напоминают картину БП и ГД. Эти поражения проявляются пузырьками или пузырями с серозным содержимым, которые формируются на видимо не измененной коже, иногда на эритематозном или уртикарном фоне [8]. Пузыри или пузырьки обычно бывают напряженными, варьируются по размеру и часто имеют тенденцию образовывать кольцевидные или полициклические бляшки из-за слияния [3]. Помимо возраста начала существуют еще различия между взрослой и детской формами ЛАД в виде некоторых клинических особенностей и локализации высыпаний. Поражения у детей обычно локализуются в нижней части живота и в области промежности с поражением аногенитальной области. Пузыри обычно имеют вид «россыпи драгоценных камней», в которой новые очаги возникают на периферии более старых. Лицо, руки и ноги вовлекаются реже [9, 12]. У взрослых ЛАД в основном локализуется на разгибательных поверхностях конечностей, теле, ягодицах и лице (чаще в периоральной области). Иногда пузыри или пузырьки могут вскрываться в результате интенсивного зуда с формированием экскориаций с последующим образованием покрытых коркой узелков [12, 16].
Характер кожных проявлений крайне полиморфен: они также могут проявляться округлыми шелушащимися узелками или узлами, напоминающими узловатую почесуху, или уртикарными папулами. Могут быть вовлечены слизистые оболочки любой локализации; наиболее часто поражаются глаза и полость рта. Поражения слизистой оболочки полости рта обычно представлены болезненными эрозиями и изъязвлениями, образующимися после вскрытия пузырей. Иногда изменения на слизистой полости рта выглядят как десквамативный гингивит или эрозивный хейлит. Наиболее частая локализация в полости рта: твердое и мягкое небо, небные дуги и слизистая оболочка щек. Вовлечения языка, десен, преддверья рта и губ (хейлит) встречаются реже. Крайне редко поражения слизистой оболочки могут быть единственными клиническими признаками ЛАД, а также могут предшествовать кожным проявлениям [9]. ЛАД с вовлечением слизистой глаза может представлять собой одно- или двусторонний хронический конъюнктивит, способный приводить к рубцующемуся конъюнктивиту, с возможным формированием субконъюнктивального фиброза и симблефарона. Без оперативного лечения эти рубцовые поражения могут приводить к слепоте. Помимо глаз и полости рта могут поражаться слизистые оболочки других органов, таких как гортань, глотка, трахея, пищевод, бронхи, влагалище[9]. В большинстве случаев причину развития заболевания выявить не удается. Однако его развитие могут провоцировать инфекционные заболевания, злокачественные опухоли, системные заболевания, прием лекарственных средств, интенсивная инсоляция, термические ожоги [9].
Лекарственно-индуцированный ЛАД обычно имеет локализованный характер и тенденцию к быстрому спонтанному разрешению при отмене провоцирующего препарата [17]. Линейные отложения IgA в зоне базальной мембраны при лекарственно-индуцированном ЛАД, как правило, исчезают после разрешения высыпаний на коже и слизистых оболочках. Все эти характеристики наряду с временной взаимосвязью, с приемом лекарственного средства, более старшим возрастом больных, очень редким наличием циркулирующих антител IgA против зоны базальной мембраны, более редким вовлечением слизистых и в одной трети случаев обнаружением дополнительного линейного отложения C3-комплемента в зоне базальной мембраны могут быть полезными для дифференцировки лекарственно-индуцированной формы от идиопатической [18]. Появление кожных проявлений после использования провоцирующего препарата варьируется от 1 дня до 2 лет [19]. Наиболее частая взаимосвязь с ЛАД наблюдается для ванкомицина и реже для других препаратов [9].
Отмечена связь ЛАД с некоторыми заболеваниями. Чаще всего наблюдается ассоциация со злокачественными новообразованиями (неходжкинская лимфома с последующим хроническим лимфоцитарным лейкозом, почечно-клеточная карцинома и рак мочевого пузыря). К наиболее частым непролиферативным заболеваниям относятся язвенный колит, болезнь Крона и системная красная волчанка [9]. Гистологическое исследование пораженной кожи пациентов с ЛАД и ХББДВ выявляет субэпидермальный пузырь с нейтрофильным инфильтратом в верхних слоях дермы (микроабсцессы сосочкового слоя), также возможно присутствие мононуклеаров и эозинофилов [9, 12]. Однако бывает трудно отличить ЛАД от других аутоиммунных субэпидермальных буллезных дерматозов только по клиническим и гистологическим признакам. В связи с этим рекомендуется проводить прямую (ПИФ) и непрямую иммунофлюоресценции (РНИФ) необработанной и/или расщепленной солевым раствором кожи или иммуноэлектронную микроскопию (ИЭМ). Как минимум одно из этих исследований следует считать обязательным при постановке диагноза ЛАД [9]. При ПИФ необработанной или расщепленной солевым раствором неизмененной кожи обычно наблюдается линейное отложение IgA вдоль зоны базальной мембраны. Реже при ПИФ выявляют сочетанное присутствие также IgG, IgM или C3-комплемента [20]. Таким образом, выделяют классические случаи с преобладанием фиксации IgA (линейный IgA-дерматоз), а также смешанные формы аутоиммунных буллезных заболеваний (линейный IgG/IgA-дерматоз или линейный IgA/IgG-дерматоз) [21]. РНИФ используется для обнаружения циркулирующих IgA-аутоантител и обычно показывает положительный результат у 30–50% пациентов с взрослой формой ЛАД [16, 22, 23]. ИЭМ позволяет определить точное расположение иммунных депозитов: в lamina lucida или в lamina/sublamina densa [22].
Дифференциальный диагноз обычно проводят с ГД и БП. ГД проявляется сгруппированными («герпетиформными») пузырьками обычно меньшего размера, чем при ЛАД, локализующимися на коже волосистой части головы, разгибательных поверхностей конечностей или туловища [22]. Вовлечение слизистых оболочек не характерно. ГД в 70% случаев развивается на фоне целиакии [24]. Гистологическая картина представлена нейтрофильными микроабсцессами в дермальных сосочках. Однако гистологическую картину ЛАД часто бывает трудно дифференцировать от таковой при ГД [22]. Одни авторы наблюдали, что ЛАД по сравнению с ГД характеризуется меньшим количеством микроабсцессов в сосочковом слое и более диффузным нейтрофильным инфильтратом в зоне базальной мембраны [25]. Других существенных различий в гистологических признаках этих заболеваний не обнаружено [26]. ПИФ при ГД демонстрируют гранулярные отложения IgA в верхушках дермальных сосочков, а не линейные отложения вдоль базальной мембраны, как характерно для ЛАД. БП проявляется клинически эритематозными пятнами, сопровождающимися зудом, на фоне которых формируются пузыри, нередко в процесс вовлекаются слизистые оболочки. При гистологическом исследовании выявляют субэпидермальные пузыри с повышенным содержанием эозинофилов. ПИФ обнаруживает линейные отложения IgG и C3-комплемента вдоль зоны базальной мембраны [22]. Приобретенный буллезный эпидермолиз в отличие от ЛАД характеризуется наличием рубцов, при ПИФ имеются отложения IgG в зоне базальной мембраны. Редко ЛАД может также напоминать узловатую почесуху, кореподобную лекарственную сыпь, многоформную эритему, токсический эпидермальный некролиз, себорейный дерматит и крапивницу [27, 28].
Лечение ЛАД проводят в зависимости от тяжести заболевания. При легкой форме эффективно применение топических кортикостероидов в качестве монотерапии [8]. Системным препаратом терапии 1-й линии при более тяжелом течении является дапсон [8, 9, 22]. При наличии противопоказаний к его применению используют сульфаниламиды [8]. Если данное лечение не дает результатов, возможно назначение системных кортикостероидов. Терапией резерва является плазмаферез и системное введение иммуноглобулинов [9]. Лечение проводят до достижения клинической ремиссии, в случае же рецидива она возобновляется [22].
Заключение
Описание клинического случая представляет интерес, поскольку данная патология встречается достаточно редко. Клиническая картина заболевания (наличие уртикароподобных бляшек с напряженными пузырьками на их поверхности, сгруппированность везикулезных элементов и корочек, наличие зуда и экскориаций) соответствовала ГП. При гистологическом исследовании в сосочках дермы определялись нейтрофильные микроабсцессы, на основании чего морфолог диагностировал ГД. Наши данные подтверждают мнение большинства исследователей о сложности дифференциальной диагностики ЛАД и ГД без использования иммуноморфологического исследования. Только ПИФ позволила достоверно диагностировать линейный IgA-зависимый дерматоз.


