Введение
В последние годы в мире наблюдается увеличение распространенности цереброваскулярных заболеваний, в т.ч. хронических форм нарушений мозгового кровообращения (НМК), существенно снижающих качество жизни и нередко приводящих к инвалидизации [1]. Этим объясняется пристальное внимание, которое уделяется в настоящее время изучению различных аспектов данной проблемы, особенно вопросам лечения, предупреждения или замедления прогрессирования сосудисто-мозговой недостаточности [2, 3]. Одним из приоритетных и весьма активно развивающихся направлений исследований патогенеза НМК стало изучение гемореологических и гемостатических показателей [1].
В результате была создана концепция дизрегуляции систем гемореологии и гемостаза как универсального фактора патогенеза ишемических НМК, представленная гемостатической активацией, гемореологическими нарушениями и эндотелиальной дисфункцией [4]. Определен гемореологический и гемостатический профиль у больных малыми глубинными инфарктами головного мозга [5]. Установлено, что гипертонические малые глубинные инфаркты возникают на фоне значительного ухудшения гемореологических параметров и проагрегантной направленности тромбоцитарно-сосудистых взаимодействий. Отмечено увеличение вязкости крови, повышение гематокрита, агрегации эритроцитов и тромбоцитов, снижение уровня простациклина и соотношения между антиагрегантными и проагрегантными простаноидами, что является отражением дисфункции эндотелия у этих больных [5–8].
Антиагрегантная терапия представляет ведущее направление во вторичной профилактике ишемического инсульта [1]. Назначение антиагрегантов больным, перенесшим транзиторную ишемическую атаку или ишемический инсульт, снижает у них риск развития повторного инсульта на 20–25%. По данным ряда авторов, в среднем профилактика ацетилсалициловой кислотой позволяет предотвращать 36 повторных нарушений мозгового кровообращения на 1000 больных [9]. Ацетилсалициловая кислота является наиболее известным и широко применяемым из антиагрегантных средств, в настоящее время рекомендуется для вторичной профилактики ишемического инсульта в дозе от 75 до 325 мг в сут [10]. Малые дозы ацетилсалициловой кислоты столь же эффективны, сколь и высоки (более 150 мг/cут), но вызывают меньше побочных эффектов [1, 3].
Выбор оптимальной дозировки ацетилсалициловой кислоты базируется на представлениях о том, что антиагрегационный эффект препарата связан с необратимой блокадой фермента циклооксигеназы-1 тромбоцитов и почти полным подавлением продукции тромбоксана А2. Особенностью данного фермента является его чрезвычайно высокая чувствительность к действию ацетилсалициловой кислоты, которая в десятки раз превышает таковую у циклооксигеназы-2, ответственной за продукцию простациклина в эндотелии сосудов. В связи с этим в малых дозах ацетилсалициловая кислота, блокируя только циклооксигеназу-1 и оставляя интактным другой фермент, преимущественно вызывает снижение продукции тромбоксана А2, в то время как уровень простациклина, мощного вазодилататора и антиагреганта, сохраняется достаточно высоким. В более же высоких дозах ацетилсалициловая кислота вызывает подавление обоих изоферментов, что, естественно, приводит к одновременному снижению продукции простациклина и устранению его благоприятных эффектов на кровяные пластинки и сосудистую стенку.
Первый в мировой клинической практике опыт использования малых доз ацетилсалициловой кислоты (1 мг на кг массы в сутки) больными цереброваскулярной патологией на фоне артериальной гипертонии, осуществленный в Научном центре неврологии (Москва), показал быстрое и стойкое устранение гиперагрегабельности тромбоцитов вследствие почти 3-кратного снижения изначальной концентрации тромбоксана А2 в крови. В исследование были включены пациенты с транзиторной ишемической атакой и перенесшие ишемический инсульт [11].
Ацетилсалициловая кислота должна применяться неограниченно долго всеми больными, не имеющими противопоказаний (аллергия, обострение язвенной болезни желудка и 12-перстной кишки, геморрагический диатез). Желудочно-кишечные кровотечения приводят к отказу от этой терапии примерно 1% больных [12]. Для снижения риска побочного действия ацетилсалициловой кислоты на слизистую желудка применяются лекарственные формы с кишечнорастворимой оболочкой (например, Тромбо АСС®).

Настоящее исследование было проведено с целью изучения лечебного воздействия препарата Тромбо АСС® на больных гипертоническими малыми глубинными (лакунарными) инфарктами головного мозга.
Соответственно поставленной цели предполагалось оценить:
- клиническую эффективность препарата в отношении основных проявлений заболевания;
- влияние Тромбо АСС® на реологические характеристики крови (агрегацию тромбоцитов [АТ]).
В исследование были включены пациенты со следующими критериями: возраст 40–75 лет, гипертонические малые глубинные (лакунарные) инфаркты головного мозга на фоне мягкой или умеренной артериальной гипертонии (уровень АД менее 200/115 мм рт.ст.), повышение агрегационной активности тромбоцитов. Критерии исключения в исследование: уровень АД более 200/115 мм рт.ст., инсульт в течение последнего месяца, другие (не сосудистые) заболевания центральной нервной системы, эпилепсия, хронический алкоголизм, лекарственная аллергия, тяжелые соматические заболевания (тяжелые формы ишемической болезни сердца, онкологические заболевания, сердечная недостаточность II степени и выше, хроническая легочная, почечная и печеночная недостаточность и др.), терапия антиагрегантами и антикоагулянтами.
Пациент мог быть исключен из программы исследования в любой из следующих ситуаций: возникновение любого из состояний, входящих в критерии исключения, нарушение протокола исследования, при индивидуальной непереносимости препарата, по просьбе больного или его родственников, при возникновении явления, вынуждающего прекратить лечение.
Материал и методы
Под наблюдением находились 52 больных гипертоническими малыми глубинными (лакунарными) инфарктами головного мозга. Среди обследованных больных были 28 мужчин и 24 женщины. Возраст пациентов колебался от 40 до 60 лет и в среднем по группе составил 56+3 года. Основным заболеванием у больных была артериальная гипертония I и II степеней. Среднее систолическое АД составило 146,0±3,7; диастолическое АД 87,8±12,5 мм рт.ст. Длительность артериальной гипертонии составила 15,0±10,5 лет.
Состояние магистральных артерий головы было изучено с помощью дуплексного сканирования. Как правило, обнаруживался атеростеноз одной (n=17) или нескольких экстракраниальных артерий, степень которого не превышала 50%. Частой ультразвуковой находкой являлась патологическая извитость сонных (n=18) или позвоночных (n=12) артерий. По данным магнитно-резонансной томографии, инфаркты локализовались в белом веществе полушарий большого мозга, внутренней капсуле, чечевицеобразном и хвостатом ядрах, таламусе, мосту мозга. Величина малых глубинных инфарктов на горизонтальных срезах мозга составляла 10–15 мм. Малые глубинные инфаркты были многочисленными (3 и более).
АТ определялась по методу G. Born (1962), усовершенствованному O. Brien J. (1964), при воздействии аденозиндифосфата (АДФ) в концентрации 1,2×10-6 мМ (АДФ-АТ) и адреналина в концентрации 6,2×10-6 мМ (Адр-АТ). Следует подчеркнуть, что основным критерием включения больных в проводимое исследование было повышение у них на фоне проводимой гипотензивной терапии агрегационной активности тромбоцитов, которую сравнивали с таковой у 30 практически здоровых людей соответствующего возраста.
Пациенты получали Тромбо АСС® в дозе 100 мг 1 раз в день утром за 30 минут до завтрака. Наряду с этим больные продолжали получать гипотензивную терапию, в отдельных случаях – малые транквилизаторы.
В первый день лечения функциональные свойства тромбоцитов (агрегацию под влиянием АДФ и адреналина) определяли дважды: непосредственно перед назначением препарата и через 2 часа после его приема. Дальнейшие исследования осуществлены через 2 недели и через 3 месяца от начала лечения. Cтатистическая обработка полученных данных проведена с применением программ Microsoft Exel, а также пакета компьютерных прикладных программ Statistica, версия 6,0 (StatSoft, 2003).
Результаты
Субъективные симптомы были ведущими в клинической картине заболевания, в неврологическом статусе у пациентов выявлена лишь рассеянная микросимптоматика. Наиболее частыми субъективными симптомами были головная боль, головокружение несистемного характера, шум в ушах, нарушение памяти, утомляемость, нарушение сна, расстройства эмоционально-волевой сферы. Объективные симптомы заболевания были представлены чаще всего вестибуломозжечковыми, а также умеренно выраженными подкорковыми и псевдобульбарными симптомами.
У 26 больных имели место церебральные гипертонические кризы, которые у 16 из них были представлены только общемозговыми нарушениями и у 10 больных – общемозговыми и легкими локальными неврологическими симптомами в виде парестезий в конечностях по моно- и гемитипам, кратковременной слабости в них, легких координаторных нарушений, рефлекторной асимметрии.
Исходный уровень АТ под действием АДФ в среднем составил 71,2+6,1, а под влиянием адреналина 73,5+8,6%, что превышало те же показатели здоровых лиц соответственно на 66,3 и 82,4%.
Через 2 часа после первого приема Тромбо АСС® у больных обнаружено статистически значимое торможение агрегационной активности тромбоцитов по сравнению с исходным уровнем (табл. 1). Дальнейший динамический контроль за функцией тромбоцитов в процессе лечения показал стабильность отмеченного антиагрегационного эффекта используемой дозы препарата в течение всего периода наблюдения. Так, в конце 2-й недели лечения АДФ-АТ оставалась сниженной на 68,1% по сравнению с таковой до начала приема препарата, а степень Адр-АТ была ниже исходной на 62,2%. К концу 3-го месяца терапии как АДФ-АТ, так и Адр-АТ была меньше ее начального уровня соответственно на 62,8 и 64,6%. Таким образом, нами был подтвержден антиагрегантный эффект Тромбо АСС®. В течение всего исследования пациентами была отмечена хорошая переносимость терапии Тромбо АСС®. На протяжении всего курса лечения не было отмечено случаев непереносимости и побочных эффектов.
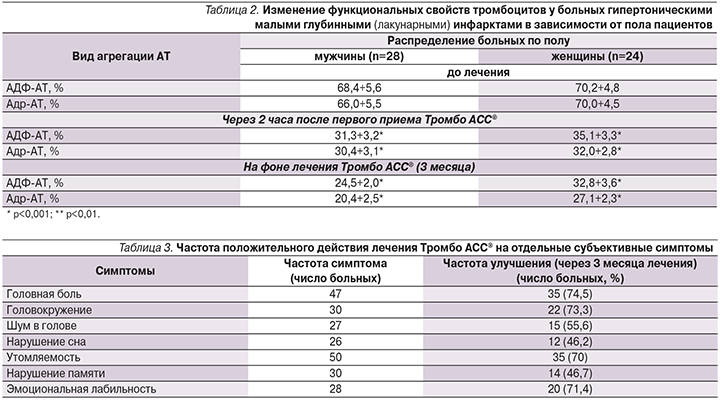
Анализ влияния Тромбо АСС® в дозе 100 мг на агрегацию тромбоцитов у мужчин и женщин не выявил какой-либо существенной зависимости от пола как в направленности, так и в величине этого эффекта. Как видно из табл. 2, уже после однократного приема Тромбо АСС® АТ закономерно снижалась по отношению к ее исходному значению у лиц обоего пола. Важно отметить, что степень подавления агрегационной активности тромбоцитов была равноценной как у мужчин, так и у женщин.
При изучении клинической эффективности лечения Тромбо АСС® установлена определенная взаимосвязь с клиническими характеристиками заболевания (табл. 3).
Улучшение после трехмесячного курса лечения касалось цефалгического, кохлеовестибулярного и астенического синдромов. Пациенты отмечали уменьшение выраженности головной боли, «мелькания мушек» перед глазами, заложенности в ушах, головокружения, шума в голове, утомляемости и общей слабости. У больных малыми глубинными (лакунарными) инфарктами головного мозга имело место уменьшение выраженности локальных неврологических нарушений в их структуре. В ряде случаев сократилась частота и длительность гипертонических церебральных кризов. Однако последнее может быть следствием проводимого гипотензивного лечения.
Заключение
Проведенное исследование показало, что Тромбо АСС® при ежедневном приеме в дозе 100 мг в сутки оказывает значительно выраженный антиагрегационный эффект, который сочетается с клиническим улучшением у больных гипертоническими малыми глубинными (лакунарными) инфарктами. Выявлено положительное терапевтическое влияние Тромбо АСС® на общее состояние больных, а также в отношении таких наиболее характерных проявлений, как цефалгический, кохлеовестибулярный и астенический синдромы. При гипертонических малых глубинных (лакунарных) инфарктах головного мозга рекомендуется длительный прием Тромбо АСС®.


