Введение
Одной из наиболее тревожных тенденций антибиотикорезистентности в последние годы является появление и стремительное распространение в стационарах грамотрицательных возбудителей с множественной резистентностью к антибактериальным препаратам (АБП). Устойчивость к цефалоспоринам за счет продукции β-лактамаз расширенного спектра действия, резистентность к аминогликозидам и фторхинолонам у микроорганизмов семейства Enterobacteriaceae и неферментирующих бактерий, таких как Acinetobacter spp. и Pseudomonas aeruginosa, уже стали привычным явлением в отделениях с интенсивным использованием АБП (ОРИТ, хирургической инфекции, урологии, лечения пациентов с острыми нарушениями мозгового кровообращения и др.). Карбапенемные антибиотики (имипенем, меропенем и дорипенем) широко использовались для терапии инфекций, вызванных этими возбудителями, и считались наиболее эффективными препаратами для лечения нозокомиальных инфекций. Однако появление и распространение в российских стационарах карбапенеморезистентных штаммов энтеробактерий (прежде всего Klebsiella pneumoniae) и неферментирующих бактерий требуют пересмотра подходов к применению различных карбапенемов в современной клинической практике. В данном обзоре мы постараемся рассмотреть возможности применения дорипенема в лечении нозокомиальных инфекций, вызванных полирезистентными грамотрицательными возбудителями.
Общая информация
Дорипенем – препарат группы карбапенемов с антисинегнойной активностью, который был зарегистрирован в РФ в 2008 г., и на данный момент – единственный карбапенем, не имеющий генериков.
Сведения о клинической фармакологии дорипенема, его исходной антибактериальной активности in vitro и данные клинических исследований, послужившие основанием для регистрации препарата, детально изложены в обзорах литературы, опубликованных в 2008 г. и находящихся в свободном доступе [1, 2]. Поэтому далее будет представлена информация об активности и эффективности дорипенема, полученная за последнее десятилетие, а также рассмотрены пути оптимизации применения дорипенема в современной клинической практике.
Активность дорипенема в отношении грамотрицательных нозокомиальных патогенов
Дорипенем обладает высокой активностью, сравнимой с таковой имипенема, в отношении грамположительных бактерий и анаэробов, а в отношении «диких» штаммов грамотрицательных микроорганизмов минимальная подавляющая концентрация (МПК) дорипенема в 2–4 раза ниже, чем меропенема и имипенема [3].
Значения МПК дорипенема в отношении энтеробактерий, продуцирующих β-лактамазы расширенного спектра действия или AmpC β-лактамазы, обычно <1 мг/л, но МПК штаммов, имеющих карбапенемазы KPC или MBL, варьируются в диапазоне от 8 до 64 мг/л [4].
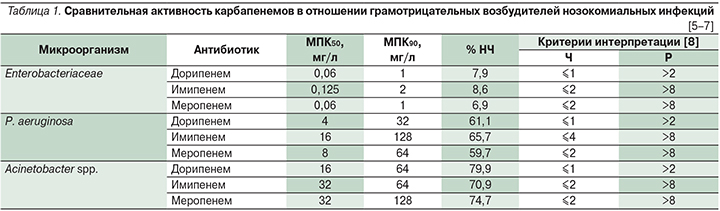
По данным многоцентрового эпидемиологического исследования «МАРАФОН», включавшего штаммы микроорганизмов, выделенных в стационарах России в 2013-14 гг., по активности в отношении нозокомиальных грамотрицательных возбудителей, в частности P. aeruginosa и Acinetobacter spp., дорипенем превосходит имипенем и меропенем (табл. 1) [5–7].
A.C. Gales и соавт. [9] продемонстрировали, что дорипенем способен сохранять активность в отношении ряда штаммов P. aeruginosa, резистентных к имипенему. В исследовании R.N. Jones и соавт. [10] доля чувствительных к дорипенему штаммов синегнойной палочки, устойчивых к другим карбапенемам (имипенему и меропенему с МПК ≥16 мг/л), составила 29,4%. Кроме того, исследование in vitro показало, что дорипенем обладает меньшим потенциалом селекции резистентных мутантов P. aeruginosa по сравнению с другими карбапенемами [4].

В отношении штаммов Acinetobacter spp. активность дорипенема по меньшей мере не уступает таковой имипенема и меропенема [11]. В упомянутом выше исследовании R.N. Jones и соавт. [10] у 12 из 24 карбапенеморезистентных изолятов Acinetobacter baumannii значения МПК дорипенема составляли ≤8 мг/л и были ниже, чем у других карбапенемов. Активность дорипенема in vitro оказалась выше, чем имипенема и меропенема, в отношении штаммов A. baumannii, имеющих карбапенемазы OXA58 (МПК50 и МПК90 дорипенема составили 4 и 8 мг/л против 16 и 64 мг/л для имипенема и меропенема соответственно) [12]. Дорипенем был активен в отношении всех изолятов A. baumannii, чувствительных к имипенему, МПК50 и МПК90 составляли 0,25 и 1 мг/л соответственно [13]. Для штаммов, резистентных к имипенему, значения МПК дорипенема были выше и варьировались в широком диапазоне – от 0,12 до 64 мг/л; МПК50 и МПК90 составили 8 и 16 мг/л соответственно. Примечательно, что 18,2% ацинетобактеров, резистентных к имипенему, были чувствительными к дорипенему [13].
Критерии интерпретации результатов определения чувствительности к дорипенему
Следует обратить внимание на то, что используемые критерии интерпретации результатов определения чувствительности микроорганизмов к дорипенему более строгие, чем к имипенему и меропенему (табл. 1) [8]. Эти критерии интерпретации были разработаны для изначально зарегистрированного режима дозирования дорипенема по 500 мг 3 раза в сутки путем внутривенной инфузии в течение 1 часа. В настоящее время при наличии риска инфицирования менее чувствительными микроорганизмами для лечения нозокомиальной пневмонии и/или других инфекций, вызванных грамотрицательными неферментирующими бактериями (например, Pseudomonas spp. или Acinetobacter spp.), рекомендуются внутривенные инфузии с дозировкой 1000 мг в течение 4 часов 3 раза в сутки [14]. Такой режим введения обеспечивает лучшие параметры эффективности дорипенема, обеспечивающие бактериостатическое или бактерицидное действие в отношении штаммов с повышенными значениями МПК (до 8 мг/л; см. раздел «Особенности фармакодинамики дорипенема») [15, 16].

При использовании критериев интерпретации результатов определения чувствительности к дорипенему, аналогичных таковым для имипенема и меропенема (например, МПК чувствительных штаммов ≤2 мг/л, умеренно-резистентных – 4–8 мг/л, а резистентных >8 мг/л), доля штаммов P. aeruginosa и A. baumannii, которые могут быть расценены как чувствительные или умеренно-резистентные к дорипенему, существенно возрастает (табл. 2 [5–7]).
Таким образом, следует понимать, что принятые на сегодняшний день критерии интерпретации чувствительности микроорганизмов к дорипенему [8] не отражают его реальную активность в отношении грамотрицательных бактерий, и при использовании высоких доз препарата методом продленной инфузии и комбинации дорипенема с другими АБП возможно добиться успешной эрадикации штаммов, расцененных микробиологической лабораторией как умеренно-резистентные или даже резистентные к препарату.
Фармакокинетика дорипенема при различных режимах введения
Профиль фармакокинетики дорипенема в целом сходен с таковыми меропенема и имипенема (табл. 3) [17].
Как следует из табл. 3, при введении дорипенема путем продленной инфузии пиковые концентрации антибиотика в сыворотке крови снижаются, однако время поддержания концентрации препарата выше 4 мг/л существенно увеличивается (рис. 1) [20]. Такой режим введения не только не приводит к снижению клинической эффективности, но, напротив, способен улучшить результаты лечения, что определяется фармакодинамикой β-лактамов [21].
Особенности фармакодинамики дорипенема
Дорипенем, как и другие β-лактамы, обладает бактерицидным действием, эффективность которого зависит от времени поддержания концентрации препарата в очаге инфекции выше МПК для конкретного возбудителя (Т >МПК). Максимальная эффективность дорипенема обеспечивается при поддержании его концентраций выше МПК в течение ≥35–40% интервала дозирования, бактериостатический эффект отмечается при Т >МПК в течение не менее 20% этого интервала [15]. Как уже было отмечено выше, время поддержания концентрации препарата выше определенных значений можно увеличить путем продленной инфузии препарата (рис. 1) [20].
По сравнению с другими карбапенемами дорипенем отличается большей стабильностью при комнатной температуре после разведения: стабильность дорипенема в стерильном физиологическом растворе – 12 часов, имипенема – 1–4, меропенема – 4–8 часов в зависимости от растворителя [21, 22]. Повышенная стабильность дорипенема в растворе позволяет вводить его путем продленной инфузии с целью увеличения параметра Т >МПК.
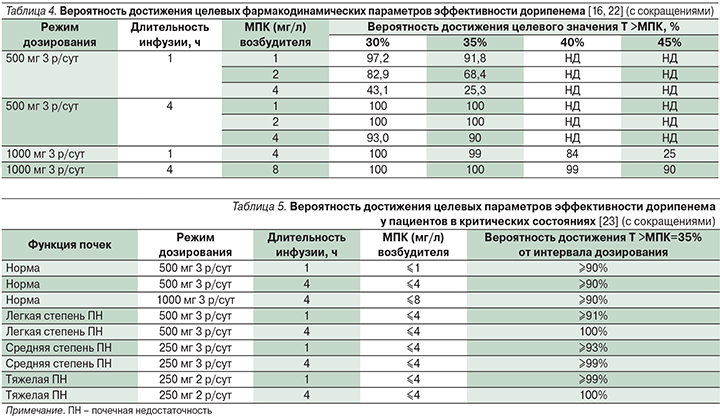
В нескольких исследованиях [16, 22] была рассчитана вероятность достижения целевых фармакодинамических параметров эффективности дорипенема при различных режимах его введения, а также в зависимости от МПК микроорганизмов (табл. 4).
На основании результатов расчетов, представленных в табл. 4, очевидно, что введение дозы дорипенема 500 мг 3 раза в сутки в виде часовой инфузии может быть эффективным только в отношении микроорганизмов с МПК ≤1 мг/л; но при увеличении продолжительности инфузии до 4 часов возможно с вероятностью 90% добиться эрадикации возбудителей с МПК 4 мг/л [22]. Применение продленной 4-часовой инфузии дорипенема в дозе 1 г каждые 8 часов обеспечивает 100%-ную вероятность достижения бактерицидного эффекта в отношении бактерий с МПК ≤8 мг/л. При уменьшении длительности инфузии и/или дозы препарата вероятность эффективной эрадикации возбудителя снижается. Таким образом, с точки зрения фармакодинамики оптимален режим введения дорипенема в дозе 1 г 3 раза в сутки путем 4-часовой внутривенной инфузии, а принятые в настоящее время критерии резистентности к дорипенему (резистентными считаются штаммы с МПК >2 мг/л) [8] представляются неоправданно строгими и не отражают реальную картину сравнительной активности карбапенемов.
Сходные данные были получены для применения дорипенема пациентами в критических состояниях [23] с различной степенью нарушения экскреторной функции почек (табл. 5).
Как видно из представленных данных, одобренные инструкцией по медицинскому применению препарата [14] стандартные режимы дозирования дорипенема у пациентов с нарушением функции почек обеспечивают эффективную эрадикацию микроорганизмов с МПК ≤4 мг/л [23].
Клинические данные об эффективности продленной инфузии дорипенема
Применение дорипенема 7 дней в дозе 1000 мг 3 раза в сутки в виде продленной 4-часовой инфузии было изучено в рандомизированном двойном слепом клиническом исследовании на пациентах с поздней вентилятор-ассоциированной пневмонией (ВАП) [24]. В качестве терапии сравнения использовался 10-дневный курс лечения имипенемом по 1 г в виде часовой внутривенной инфузии 3 раза в сутки. Фармакокинетические данные, полученные о 19 пациентах с ВАП в этом исследовании, показали, что фармакокинетика дорипенема у них отличается от таковой у здоровых добровольцев. В частности, у пациентов с ВАП были отмечены меньшие значения Cmax и площади под фармакокинетической кривой: 14,3 против 18,8 мг/л и 69,6 против 75,4 мг ч/л соответственно, но большие значения периода полувыведения, объема распределения и клиренса препарата: 2,91 против 1,53 ч; 18,0 против 39,8 л и 13,8 против 15,9 л/ч соответственно. Эти показатели, а также существенные различия по фармакокинетике у отдельных пациентов позволяют сделать вывод об эффективной эрадикации дорипенемом возбудителей ВАП с МПК не более 4 мг/л.
Клинически фиксированный 7-дневный курс лечения дорипенемом в этом исследовании статистически незначимо уступал 10-дневному курсу имипенема/циластатина по показателям клинической эффективности и выживаемости пациентов. На основании этих данных исследование было прекращено досрочно, и сделан вывод о необходимости проведения курса лечения дорипенемом при ВАП, превышающего 7 дней [24]. Примечательно, что в более раннем исследовании дорипенема и имипенема при ВАП, включавшем более 500 пациентов, частота клинического излечения составила 68,3 против 64,8%, при этом дорипенем имел преимущество по эффективности у пациентов с более тяжелым состоянием и у больных старших возрастных групп [25]. У пациентов с ВАП, вызванной P. aeruginosa, показатели клинической и микробиологической эффективности в группах лечения дорипенемом и имипенемом составили 80,0 против 42,9% и 65,0 против 37,5% соответственно. В группе лечения дорипенемом только 18% (5/28) изолятов P. aeruginosa имели МПК ≥8 мг/л, в то время как в группе терапии имипенемом частота выявления таких штаммов составила 64% (16/25; p=0,001) [25]. Кроме того, в сравнительных исследованиях с имипенемом была отмечена меньшая вероятность развития судорог при применении дорипенема.
Мета-анализы эффективности и безопасности дорипенема
Результаты мета-анализа, включившего 6 рандомизированных клинических исследований дорипенема при осложненных интраабдоминальных инфекциях (ОИАИ), осложненных инфекциях мочевыводящих путей (ОИМП), нозокомиальной пневмонии (НП) и острой инфекции билиарного тракта (всего 1427 пациентов), продемонстрировали статистически незначимую тенденцию к более высокой клинической эффективности дорипенема (отношение шансов – 1,26; 95% доверительный интервал [ДИ] – 0,93–1,69; р=0,13) [26]. В целом дорипенем не уступал препаратам сравнения ни по эффективности, ни по безопасности терапии (частоте нежелательных явлений и летальности пациентов).
В другом мета-анализе [27] была изучена эффективность дорипенема у пациентов с инфекциями, обусловленными синегнойной палочкой, которые принимали участие в 4 клинических исследованиях III фазы по лечению НП, ВАП и ОИАИ. Показатели клинической эффективности при ОИАИ и НП/ВАП, вызванных P. aeruginosa, составили 78,7 (37/47) и 59,6% (31/52) соответственно при лечении дорипенемом по сравнению с 74,3 (26/35) и 32,8% (19/58) соответственно при использовании АБП сравнения p<0,05).
Показатели достижения микробиологической эрадикации также были лучшими в группе лечения дорипенемом, однако не достигли уровня статистической значимости. Различия в клинической и микробиологической эффективности терапии составили 16 (95% ДИ – 3,1–29%) и 9,1% (95% ДИ – 4,2–22,3%) соответственно в пользу дорипенема [27].
Возможные варианты повышения эффективности применения дорипенема в клинической практике
Помимо использования метода продленной инфузии (официально зарегистрированного режима применения дорипенема) при лечении инфекций, вызванных полирезистентными грамотрицательными микроорганизмами, следует также рассмотреть дополнительные возможности повышения эффективности дорипенема в клинической практике, в частности комбинированной терапии с другими АБП.
Комбинированная терапия с одновременным использованием нескольких антимикробных препаратов различных химических классов служит общепризнанным методом лечения туберкулеза или ВИЧ-инфекции. В то же время подобный подход еще недостаточно изучен при лечении инфекций, вызванных полирезистентными грамотрицательными бактериями. Результаты исследований комбинаций АБП in vitro и на экспериментальных моделях животных во многих случаях продемонстрировали перспективность подобной тактики. В то же время отсутствие хорошо спланированных проспективных контролируемых клинических исследований пациентов с инфекциями не позволяет судить об эффективности различных вариантов комбинированной терапии в клинической практике [28].
В исследовании C. Urban и соавт. была изучена активность in vitro комбинаций полимиксина B, дорипенема и рифампицина в отношении 20 карбапенеморезистентных клинических изолятов грамотрицательных микроорганизмов (по 5 штаммов K. pneumoniae, A. baumannii, P. aeruginosa и Escherichia coli c различными механизмами резистентности) [29]. Было установлено, что комбинация трех препаратов в концентрациях, составляющих ¼ МПК этих АБП в отношении соответствующих микроорганизмов, обеспечивала бактерицидный эффект в отношении 85% исследованных штаммов (100% P. aeruginosa и E. coli, 80% K. pneumoniae и 60% A. baumannii), несмотря на устойчивость этих изолятов к карбапенемам и рифамипицину [29].
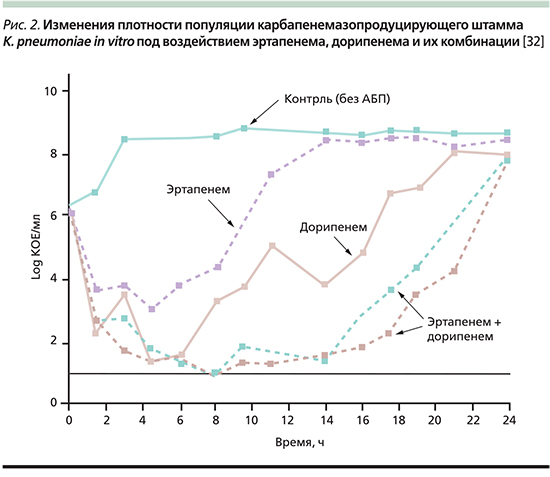
По данным систематического обзора и мета-анализа синергизма карбапенемов и полимиксинов in vitro [30], дорипенем оказался наиболее перспективным препаратом данной группы для применения в комбинированной терапии (табл. 6).
S.A. Clock и соавт. [31] также изучали активность комбинаций различных АБП с дорипенемом в отношении 96 полирезистентных клинических штаммов A. baumannii и K. pneumoniae, устойчивых к дорипенему. Синергизм комбинаций антибиотиков был отмечен в отношении 15% изолятов ацинетобактера и 48% штаммов клебсиелл. Наибольшую активность демонстрировали комбинации дорипенема с рифампицином и/или полимиксином.
Комбинация двух карбапенемов в отношении карбапенеморезистентных штаммов K. pneumoniae
Еще один интересный подход к преодолению резистентности к карбапенемам у штаммов K. pneumoniae, продуцирующих карбапенемазы, был предложен C.C. Bulik и D.P. Nicolau [32]. Идея заключается в одновременном применении двух карбапенемных антибиотиков, один из которых, эртапенем, способен высокоаффинно связываться с активным центром карбапенемаз, приводя к уменьшению количества активных молекул фермента, а второй – меропенем или дорипенем, применяемые в высоких дозах и/или путем продленной инфузии, позволяют при этом добиться эрадикации обычно устойчивых к ним штаммов [33].
Эртапенем является наименее активным in vitro карбапенемом в отношении карбапенемазопродуцирующих штаммов K. pneumoniae. Предположительно это связано с наиболее высокой аффинностью карбапенемаз именно к данному антибиотику [34].
При изучении комбинации дорипенем+эртапенем in vitro против штамма K. pneumoniae, продуцирующего карбапенемазы, наиболее выраженная бактерицидная активность была продемонстрирована для комбинации двух карбапенемов (рис. 2) [32].
В той же и в ряде других работ эффективность совместного применения эртапенема и дорипенема, который вводился через 2 часа после инъекции эртапенема путем продленной 4-часовой инфузии, была подтверждена in vivo на моделях инфекций у мышей, вызванных штаммами клебсиелл и других видов энтеробактерий, продуцирующими различные виды карбапенемаз [32, 35–38].
До настоящего времени не проведено клинических исследований, которые бы подтвердили эффективность и безо-пасность одновременного применения эртапенема и дорипенема у пациентов с инфекциями, вызванными карбапенемазопродуцирующими штаммами грамотрицательных бактерий. Однако описания отдельных клинических случаев успешного лечения НП, ВАП с бактериемией и ОИМП, вызванных карбапенеморезистентными клебсиеллами [39, 40], позволяют считать подобный подход оправданным для применения в случаях инфекций, не поддающихся лечению другими антибиотиками.
Заключение
Дорипенем обладает свойствами и характеристиками, выгодно отличающими его от других препаратов группы карбапенемов, а именно высокой активностью в отношении проблемных нозокомиальных грамотрицательных возбудителей, низким потенциалом селекции резистентности и возможностью использования в виде продленной инфузии. Таким образом, дорипенем представляет собой эффективный и безопасный АБП, который может использоваться как в монотерапии, так и в комбинации с препаратами других групп и даже с другими карбапенемами для лечения серьезных и жизнеугрожающих инфекций в стационаре.


