Инфекции, передаваемые половым путем, и антибиотикорезистентность
В 2014 г. Всемирной организацией здравоохранения (ВОЗ) был опубликован доклад «О глобальном наблюдении за устойчивостью к противомикробным препаратам», в котором эксперты с большой тревогой сообщили о надвигающейся «постантибиотиковой эре», связанной с резистентностью микроорганизмов к антибиотикам [1]. Доклад ВОЗ «О глобальном наблюдении за инфекциями, передаваемыми половым путем» (ИППП) 2015 г. подтвердил, что антибиотикорезистентность к некоторым распространенным инфекционным возбудителям имеет место во всем мире и ставит под угрозу возможность лечения инфекций, которые поддавались лечению в течение десятилетий и которые снова будут убивать [2].
Резистентность микроорганизмов к антибиотикам – это устойчивость микроорганизма к препарату, изначально эффективному для лечения инфекций. Стандартные виды лечения при этом становятся неэффективными, а инфекции сохраняются, увеличивая риск их распространения, приводят к затяжному течению болезни, более высоким расходам на здравоохранение и более высокому риску смерти.
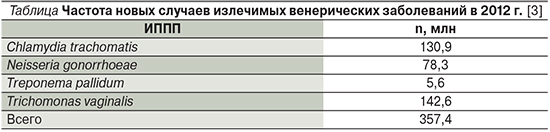
Глобальное бремя ИППП в мире составляет 1 млн новых случаев (хламидиоз, гонорея, сифилис и трихомониаз) ежедневно (см. таблицу).
Среди возбудителей ИППП резистентность к терапии в настоящее время проявляют следующие микроорганизмы [1]:
- Neisseria gonorrhoeae – к цефалоспоринам третьего поколения; в результате увеличились показатели заболеваемости и осложнений (бесплодие, неблагоприятные исходы беременности и младенческая слепота);
- Mycoplasma genitalium – к макролидам и тетрациклинам (азитроми-цину – 16%, доксициклину – 64%);
- ВИЧ – к препаратам антиретровирусной терапии первой и второй линий;
- Candida species (и др. non-albicans) – к противогрибковым препаратам (флуконазол).
Ускоряют появление и распространение устойчивости к противомикробным препаратам: ненадлежащее их использование (бесконтрольный прием антибиотиков в популяции); применение антимикробных средств в животноводстве, что способствует возникновению и селекции резистентных штаммов, передаче их человеку (80% антибиотиков используются в сельском хозяйстве); недостаточные меры по профилактике инфекций и инфекционному контролю в клинической практике.
В связи с этим ВОЗ разработан Глобальный план действий по борьбе с антимикробной резистентностью, который был принят на 68-й сессии Всемирной Ассамблеи здравоохранения (май 2015 г.), включивший 5 стратегических направлений [4]:
- повышение осведомленности об устойчивости к противомикробным препаратам и понимания этого феномена;
- принятие мер, направленных на уменьшение частоты инфицирования;
- оптимизация использования противомикробных препаратов;
- проведение клинических исследований и наблюдений для укрепления знаний по указанной проблеме;
- увеличение инвестиций в разработку новых лекарств, вакцин, диагностических инструментов и другие мероприятия с учетом потребностей всех стран.
Эксперты ВОЗ особо отмечают, что в борьбе с угрозой антибиотикорезистентности главным является снижение риска передачи резистентных организмов – дома, в населенных пунктах, медицинских учреждениях, пищевых предприятиях, через водоснабжение, в сельском хозяйстве, причем ключевым элементом здесь является повышенная гигиеничность.
Рекомендации по лечению ИППП в условиях резистентности возбудителей к антибиотикам
В связи с установленными фактами резистентности к антибиотикам эксперты ВОЗ пересмотрели рекомендуемые и альтернативные схемы лечения наиболее распространенных ИППП, вызванных C. trachomatis и N. gonorrhoeae, которые были опубликованы в 2016 г. [5, 6].
Критериями выбора лекарственных средств для лечения ИППП были признаны [5]:
- высокая эффективность (не менее 95%);
- высокое качество (активный ингредиент);
- экономичность;
- низкий уровень токсичности;
- отсутствие резистентности к препарату;
- разовая доза (однократное применение);
- пероральное введение;
- отсутствие противопоказаний для беременных или кормящих женщин;
- включение в национальные перечни основных лекарственных средств.
В новом руководстве подчеркивается [5], что женщин, которым поставлен диагноз неосложненной инфекции шейки матки, вызванной C. trachomatis, следует рассматривать как лиц с наличием субклинической инфекции верхних отделов репродуктивного тракта. Всем лицам, у которых обнаружены C. trachomatis, следует начинать лечение незамедлительно, поскольку задержка лечения может вести к осложнениям (воспалительные заболевания органов малого таза, внематочная беременность, бесплодие).
К препаратам, рекомендуемым для лечения инфекций, вызванных C. trachomatis (А56 – хламидийные болезни, передаваемые половым путем; А56.0 – хламидийные инфекции нижних отделов мочеполового тракта; А56.1 – хламидийные инфекции органов малого таза и других мочеполовых органов; А56.2 – хламидийная инфекция мочеполового тракта доксициклин 100 мг внутрь дважды в день в течение 7 дней, неуточненная; А56.3 – хламидийная инфекция аноректальной области), относят:
- азитромицин 1 г внутрь однократно или допустим и один из следующих вариантов:
- тетрациклин 500 мг внутрь 4 раза в день в течение 7 дней;
- эритромицин 500 мг внутрь дважды в день в течение 7 дней;
- офлоксацин 200–400 мг внутрь дважды в день в течение 7 дней.
Выбор лечения может зависеть от удобства дозировки, стоимости и качества лекарственных средств. Доксициклин, тетрациклин, офлоксацин противопоказаны при беременности.
 Мета-анализ 23 рандомизированных клинических испытаний, сравнивавших азитромицин 1 г однократно и доксициклин по 100 мг 2 раза в день, назначаемых в течение 7 дней, показал, что разница в их эффективности была незначительной – на 1,5–2,6% (например, 97 против 95%), и это различие клинически не значимо – как азитромицин, так и доксициклин могут быть рекомендованы в качестве схем лечения первого ряда (доказательность Ia; A) [7].
Мета-анализ 23 рандомизированных клинических испытаний, сравнивавших азитромицин 1 г однократно и доксициклин по 100 мг 2 раза в день, назначаемых в течение 7 дней, показал, что разница в их эффективности была незначительной – на 1,5–2,6% (например, 97 против 95%), и это различие клинически не значимо – как азитромицин, так и доксициклин могут быть рекомендованы в качестве схем лечения первого ряда (доказательность Ia; A) [7].
Руководство ВОЗ рекомендует рассматривать азитромицин как препарат первой линии выбора для беременных женщин, т.к он более дешев и принимается 1 раз в сутки, что способствует большей приверженности лечению и, следовательно, лучшим результатам терапии.
При инфицировании C. trachomatis, когда сопутствующая инфекция М. genitalium была верифицирована или подозревается (A63.8 – другие уточненные заболевания, передаваемые преимущественно половым путем), лечение азитромицином (в отсутствие установленной резистентности М. genitalium к макролидам у пациента, но в условиях повышения резистентности в популяции) проводится по следующей расширенной схеме: 500 мг в 1-й день, а затем 250 мг один раз в день в течение четырех дней (доказательность II; В) либо джозамицин 500 мг 3 раза в день 10 дней (доказательность IV, C) [8].
При инфекции, вызванной M. genitalium, и установленной у пациента резистентности к макролидам применяется моксифлоксацин в дозе 400 мг внутрь 1 раз в сутки, 7–10 дней (доказательность II; В), а при осложненной инфекции – до 14 дней (доказательность IV; C) после проведенного лечения азитромицином для элиминации C. trachomatis [8].
В соответствии с пересмотренными руководящими принципами, опубликованными ВОЗ в 2016 г. [6], наиболее эффективным методом лечения гонореи на сегодняшний день является комбинированная терапия: инъекционный антибиотик цефтриаксон 250 мг внутримышечно однократно вместе с пероральным антибиотиком – азитромицином 1 г внутрь однократно. Такая комбинация, по данным R.F. Savaris и соавт. [9], эффективна в 98% случаев против 83% при комбинации цефтриаксона с доксициклином.
Таким образом, монотерапия заболеваний, вызванных гонорейной инфекцией (A54.0 – гонококковая инфекция нижних отделов мочеполовых путей без абсцедирования периуретральных или придаточных желез; A54.1 – гонококковая инфекция нижних отделов мочеполовых путей с абсцедированием периуретральных и придаточных желез; A54.2 – гонококковый пельвиоперитонит и другая гонококковая инфекция мочеполовых органов; A54.6 – гонококковая инфекция аноректальной области), больше не рекомендуется.
Последние лабораторные данные свидетельствуют, что цефиксим более не является эффективным в лечении гонореи, и существуют опасения, что устойчивость может развиться ко всем цефалоспоринам (в связи с возникновением перекрестной резистентности к антибиотикам одной группы). Ограничение использования цефиксима сейчас может помочь сохранить цефтриаксон как один из вариантов для лечения этой инфекции [1, 6].
Перенесенные ИППП (хламидиоз, гонорея, трихомоноз) и антибиотикотерапия рассматриваются как факторы риска, ассоциированные с развитием бактериального вагиноза (БВ) [10].
И хотя БВ не относится к ИППП, высокая частота их сочетаемости требует рассмотрения этого вопроса в настоящей статье. Последние рекомендации по лечению БВ датируются 2014 г. (Рекомендации CDC по лечению инфекций, передаваемых половым путем [11]), и в них указывается, что всем женщинам с БВ рекомендуется пройти тестирование на ВИЧ и другие ИППП.
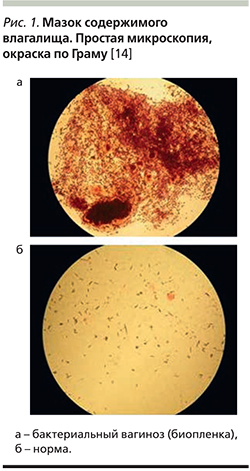
Ключевое звено патогенеза БВ – образование биопленки (рис. 1), которая состоит из Gardnerella vaginalis (60–90%), Atopobium vaginae (1–40%) и других бактерий (1–15%), при этом содержание лактобактерий снижается до 0,1–0,001% [12, 13].
В рекомендациях [11] указаны следующие схемы лечения БВ:
- метронидазол 500 мг внутрь 2 раза в день 7 дней;
- метронидазол гель 0,75%, один полный аппликатор (5 г) интравагинально 1 раз в день в течение 5 дней;
- клиндамицин крем 2%, один полный аппликатор (5 г) интравагинально перед сном в течение 7 дней.
Прием препаратов внутрь рекомендуется только при устойчивости к вагинальному лечению. Среди альтернативных вариантов терапии: тинидазол 2 г внутрь 1 раз в день, 2 дня; тинидазол 1 г внутрь, 1 раз в день, 5 дней; клиндамицин 300 мг внутрь 2 раза в день, 7 дней; клиндамицин 100 мг интравагинально 1 раз перед сном, 3 дня.
В Кокрейновском обзоре [15] указывается, что предпочтительна схема с введением метронидазола в дозе 500 мг 2 раза в день на протяжении 7 дней вагинально по сравнению с однократной дозой 2 г внутрь (эффективность – 82 против 62%), а клиндамицин и метронидазол одинаково эффективны независимо от режима введения при наблюдении в течение 2 и 4 недель (отношение рисков – 1,01, 95% доверительный интервал – 0,69–1,46; ОР – 0,91, 95% ДИ – 0,70–1,18 соответственно) [16].
Эффективность метронидазола была доказана в рандомизированных клинических исследованиях и достигает 90% по критериям Амселя [17].
Однако рецидивы БВ развиваются у 30% женщин в течение трех последующих месяцев, а у 50% – в течение года [18]. Такая высокая частота рецидивов не связана с низкой эффективностью лечения, а обусловлена сложностью элиминации условно-патогенных микроорганизмов из биопленок, восстановления нормальной микрофлоры и колонизационной резистентностью во влагалище [18]. Для лечения рецидивов заболевания рекомендуется два подхода. Первый – повторная терапия препаратом, использовавшимся при первом эпизоде БВ. Второй (при множественных рецидивах) – 0,75%-ный гель метронидазола 2 раза в неделю в течение 4–6 месяцев.
Ограниченные данные свидетельствуют о том, что терапия, включающая нитроимидазол внутрь (метронидазол или тинидазол 500 мг дважды в день в течение 7 дней) с последующим интравагинальным применением борной кислоты 600 мг в день в течение 21 дня, а затем 0,75%-ный гель метронидазола 2 раза в неделю в течение 4–6 месяцев, является возможным вариантом для женщин с рецидивирующим БВ в стадии ремиссии. Еще один вариант: ежемесячное (4–6 месяцев) применение метронидазола 2 г внутрь с флуконазолом 150 мг однократно (снижает частоту рецидивов и способствует колонизации нормальной флоры влагалища) [11].
С начала 1980-х гг. метронидазол широко используется при лечении БВ с хорошими клиническими результатами. Однако работы последних лет все чаще свидетельствуют о вариабельности клинического эффекта метронидазола в диапазоне от 58 до 100%, что, вероятно, связано с образованием биопленок и присутствием иных инфектов. Было показано, что метронидазол оказывается достаточно эффективным в присутствии планктонных микроорганизмов (не организованных в биопленки) и имеет значительно менее выраженное действие на биопленки [19].
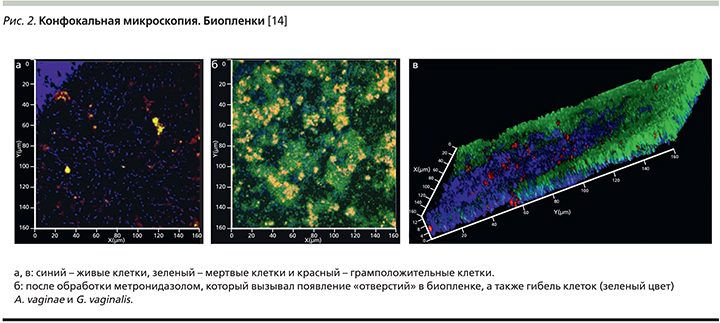
Работы А. McMillan и соавт. [14], выполненные in vitro, демонстрируют эффективность метронидазола, сравнимую с таковой штаммов лактобактерий L. reuteri RC-14 и L. rhamnosus GR-1, по отношению к G. vaginalis и А. vaginae, а также его способность к неполному разрушению биопленок (рис. 2) за счет образования «отверстий» в них.
Общепризнанно, что лактобактерии, присутствующие во влагалище, играют существенную роль в поддержании условий, ограничивающих рост патогенных микроорганизмов и препятствующих возникновению рецидивов [20]. Полученные А. McMillan и соавт. данные позволили получить определенные доказательства того, что пробиотики, содержащие L. reuteri RC-14 и L. rhamnosus GR-1, в сочетании с антимикробными препаратами (метронидазол) могут оказать более выраженный эффект в отношении биопленок, образованных патогенными анаэробами.
В работе других авторов клиническое применение метронидазола (500 мг внутрь 2 раза в день в течение 7 дней) в сочетании с пробиотиком 2 раза в день в течение 30 дней (1 капсула, содержащая L. rhamnosus GR-1 и L. reuteri РК-14) обеспечило более высокую эффективность по сравнению с приемом одного метронидазола [21].
Второй вариант использования пробиотиков для предотвращения рецидивов БВ – их применение после первого этапа лечения антимикробными средствами – продемонстрировал вариабельные результаты, но с общим выводом в пользу такого подхода [20].
Полученные в последние годы данные о большом разнообразии микрофлоры влагалища при БВ могут быть еще одним объяснением его рецидивирующего течения. Имеются сведения о достижении лучшего терапевтического эффекта при применении комбинированных средств (например, вагинальных свечей, содержащих метронидазола 500 мг и миконазола 100 мг) при одновременном присутствии возбудителей БВ и вагинального кандидоза (ВК) или наличии кокковой флоры и для профилактики ВК после лечения [22].
Некультивируемые или труднокультивируемые микроорганизмы могут оказаться устойчивыми к метронидазолу. И, если эти микроорганизмы не будут идентифицированы до назначения терапии, лечение может оказаться неэффективным [23, 24]. Так, например, в Европейском руководстве по лечению заболеваний, сопровождающихся вагинальными выделениями, пациенткам с персистирующими и рецидивирующими симптомами, связанными с БВ или урогенитальным трихомонозом, перед повторным курсом лечения метронидазолом рекомендуется провести эмпирическую терапию против кокковой флоры, которая может захватывать активную нитрогруппу и приводить к снижению концентрации действующего вещества, провоцируя таким образом относительную резистентность к терапии метронидазолом [25].
В ряде публикаций было показано, что в исследованиях in vitro A. vaginae проявляет бóльшую чувствительность к клиндамицину, чем к метронидазолу [23, 24]. Между тем те же авторы предостерегают от назначения клиндамицина при первом эпизоде БВ, поскольку анаэробная флора быстрее формирует устойчивость к клиндамицину, чем к метронидазолу. Так, R Beigi и соавт. проанализировали чувствительность 1059 изолятов анаэробных бактерий, из которых менее 1% были резистентны к метронидазолу, 17% были резистентны к клиндамицину изначально и 53% стали резистентными после проведенной терапии этим препаратом [23].
Согласно российским рекомендациям, на втором этапе лечения БВ для профилактики рецидивов и ацидификации влагалищной среды показано применение кислот (молочной, аскорбиновой). В отношении применения лактобактерий указывается, что «дальнейшие исследования должны определить роль этих режимов в лечении БВ и предотвращении его рецидивов» [10]. Использование пробиотиков в исследованиях зарубежных авторов, особенно содержащих Lactobacillus, принесли положительные результаты [27], но пока они не имеют достаточной доказательной базы и не включены в рекомендации ведущих профессиональных сообществ.
Стратегия борьбы с ИППП на глобальном уровне
Предлагаемая ВОЗ стратегия борьбы с ИППП служит основой для совместных действий ВОЗ и государств-членов на глобальном, региональном и национальном уровнях.
В предлагаемой стратегии [2] сформулированы обязательства ВОЗ в рамках работы по достижению ряда целей и целевых показателей, направленных на ликвидацию к 2030 г. ИППП как угрозы здоровью населения в контексте обеспечения для всех людей в любом возрасте возможности иметь здоровую и благополучную жизнь.
Экспертами выделено три ИППП в качестве приоритетных направлений для стратегической работы во всем мире:
- Neisseria gonorrhoeae – вследствие растущего риска возникновения неизлечимых форм этого заболевания, а также риска коинфицирования другими ИППП, включая C. trachomatis.
- Treponema pallidum – элиминация врожденного сифилиса, что предполагает наличие высокоэффективных систем, обеспечивающих скрининг и лечение всех беременных женщин, а также борьбу с сифилисом в особых группах населения.
- Вирус папилломы человека (ВПЧ) – особое внимание должно быть уделено вакцинации в целях устранения риска развития рака шейки матки и остроконечных кондилом.
Глобальные целевые показатели во всем мире на 2030 г. (по сравнению с глобальными исходными показателями 2018 г.): сокращение числа случаев инфекций, вызванных T. pallidum – на 90%, вызванных N. gonorrhoea – на 90%; менее 50 случаев врожденного сифилиса на 100 тыс. живорожденных в 80% стран; охват иммунизацией против ВПЧ не менее 90% населения на национальном уровне (в странах, где имеются программы иммунизации).
Консультирование и меры, направленные на изменение поведения, предлагают первичную профилактику ИППП (включая ВИЧ), а также предотвращение нежелательной беременности.
Они включают:
- всестороннее просвещение по вопросам сексуальности, консультирование в отношении ИППП и ВИЧ до и после тестирования;
- консультирование в отношении более безопасного секса, пропаганду использования презервативов;
- меры, ориентированные на основные и уязвимые группы населения, такие как подростки, работники секс-индустрии, гомосексуалисты и лица, употребляющие инъекционные наркотики.
Заключение
Таким образом, применение антибиотиков в эпоху всевозрастающей резистентности микроорганизмов к ним как с лечебной, так и с профилактической целью должно быть строго обосновано. Любые произвольные решения, не подкрепленные доказательными данными, в отношении как необоснованного назначения, так и, наоборот, отказа от применения антибиотиков при наличии показаний, в т.ч. с профилактической целью, должны быть исключены.


