Сахарный диабет (СД) – хроническое заболевание, характеризующееся стойким повышением уровня глюкозы крови в результате полного или частичного дефицита инсулина, единственным способом лечения которого является заместительная инсулинотерапия.
Инсулиновые помпы (ИП) в настоящее время являются самыми физиологичными и совершенными дозаторами инсулина. Первая ИП была произведена в Индиане (США) в 1963 г. Данная помпа была тяжелой и малоудобной в использовании. За прошедший период ИП прошла долгий путь от ящика-рюкзака до миниатюрного прибора, практически не заметного на теле и не мешающего ежедневному режиму жизни, занятиям спортом и т.п.
Для управления СД непрерывная подкожная инфузия инсулина посредством ИП основывается на болюс-базисной схеме введения инсулина. Постоянная подкожная инфузия инсулина (ППИИ) влияет на уровень гликозилированного гемоглобина (HbA1C); вариабельность суточной гликемии; контроль массы тела; частоту возникновения гипогликемии; сокращение случаев обращения в службы неотложной помощи и частоту госпитализаций по поводу острых состояний, а также влияет на качество жизни (например, проще путешествовать в разных часовых поясах).
Преимущество подачи инсулина микродозами в базисном режиме позволяет создавать индивидуальный физиологический уровень инсулина в организме, учитывающий циркадный суточный ритм инсулиновой секреции, феномен «утренней зари» и т.п. Имеется возможность настройки нескольких базальных уровней (например, базальный уровень стандартного дня, базальный уровень выходного дня или дня спортивных занятий, или базальный уровень критических дней у девушек); возможность временной коррекции базального уровня инсулина в сторону как увеличения, так и снижения до 100% на установленный промежуток времени (от 30 минут да 24 часов).
ИП имеют встроенный калькулятор болюса, облегчающий расчет болюсного введения инсулина с учетом текущего уровня глюкозы крови, количества хлебных единиц.
В некоторых моделях ИП при расчете болюса возможен учет планируемой физической нагрузки, болезни, стресса. Введение болюса возможно в трех режимах: стандартный болюс, растянутый (или квадратный) болюс, болюс двойной волны. Использование различных типов болюса позволяет достигать оптимального постпрандиального уровня гликемии у пациентов различных возрастных групп с учетом особенностей вариантов режима приема и состава пищи.
Стремительный рост заболеваемости СД в популяции, а также увеличение числа детей, особенно младшего возраста, нуждающихся в заместительной инсулинотерапии, отображают необходимость освоения и применения совершенных приборов, дозирующих инсулин, а также подготовку профессиональных кадров врачей-специалистов. Исходя из актуальности проблемы, в 2012 г. был принят Российский консенсус детских эндокринологов по помповой инсулинотерапии (ПИТ). Данный Консенсус разработан с учетом рекомендаций Европейской и Американской ассоциаций по изучению детского диабета, а также с учетом имеющегося отечественного опыта.
Основным показанием к установке ИП является инсулинозависимый СД, особенно с неудовлетворенностью от традиционной терапии, высоким уровнем HbA1с, выраженной суточной вариабельностью гликемии, частыми гипогликемическими состояниями, кетоацидозами, наличием микро- или макрососудистых осложнений СД.
В педиатрической группе приоритетны к установке ИП дети-спортсмены, дети с выраженной иглофобией, выраженным синдромом «утренней зари», дети и подростки с расстройством пищевого поведения. Однако при инициации ПИТ врач руководствуется не только установленным диагнозом, но и мотивационными характеристиками пациента и его семьи: готовностью к дополнительному обучению, частотой контроля гликемии, стремлением к достижению целевых уровней гликемии. Возраст пациента и стаж диабета не должны быть факторами перехода от инъекций к ППИИ.
Эффективность ПИТ в детском и подростковом возрасте подтверждена в многочисленных европейских и российских исследованиях. Наиболее интересным является 12-летнее проспективное исследование по улучшению метаболического контроля в педиатрической когорте пациентов, опубликованное в журнале Diabetes Technology and therapeutics (2014).
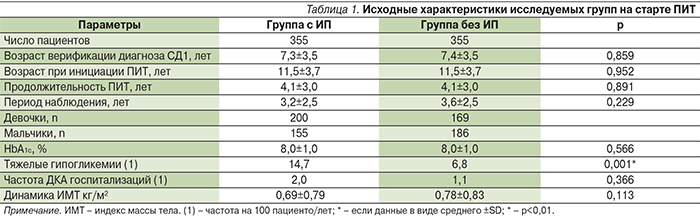
В исследовании приняли участие 355 пациентов, возраст установления диагноза СД – 7,3±3,5 года (р=0,859); стаж диабета – 4,1±3,0 года (р=0,891), средний уровень HbA1c – 8,0±1,0% (р=0,566) (табл. 1).
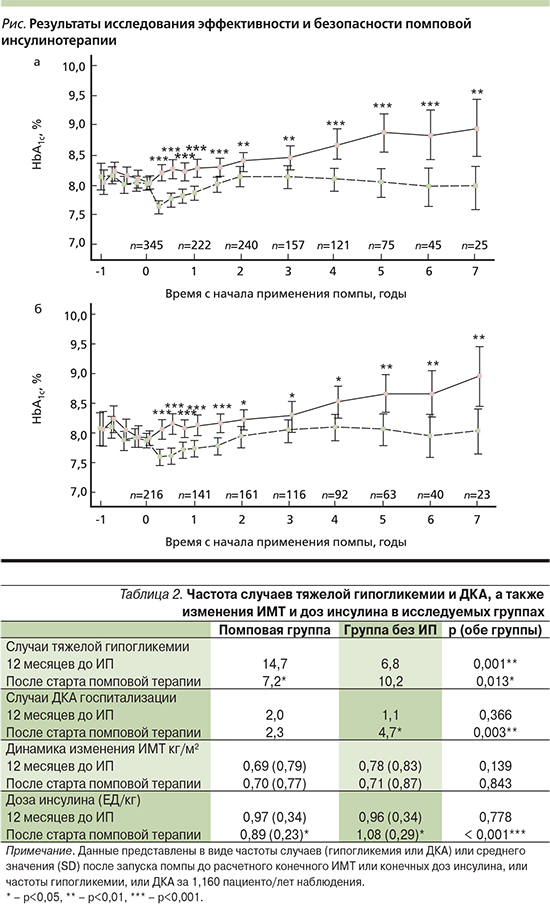
В задачи исследования входили: оценить эффективность ПИТ с учетом частоты и тяжести возникновения гипогликемических состояний, эпизодов диабетического кетоацидоза (ДКА), частоты госпитализаций, скорости изменения массы тела пациентов в зависимости от дозы инсулина (табл. 2).
Основным критерием достижения целевого уровня гликемии являлось определение уровня HbA1с. Результаты исследования продемонстрировали эффективность и безопасность данного вида инсулинотерапии. ПИТ улучшает гликемический контроль, что доказывает снижение уровня HbA1c (см. рисунок).
Снижение НbА1с на 0,6% значимо, что согласуется с результатами других исследований, и достоверно, т.к. в исследовании DCCT было показано, что снижение HbA1с на 1% сокращает риск микрососудистых осложнений с 21 до 49%. Частота гипогликемий снизилась на 30% в группе ИП (7,2 против 10,2). Частота госпитализаций при ДКА была вдвое меньше в группе ИП (2,3 против 4,7) [7]. Разницы в значениях индекса массы тела (ИМТ) в группах не отмечена [8]. Суточная доза инсулина (ед/кг) была на 9% меньше таковой в контрольной группе. [9]
Эффективность и безопасность использования инсулиновых дозаторов напрямую зависят от обученности пациента и его семьи. Для уменьшения риска побочных эффектов необходимо, чтобы пациенты имели представление о технических аспектах использования и особенностях прибора (инсулиновой помпы). Профилактические меры, такие как обучение правильной технике введения катетера, регулярный мониторинг глюкозы крови (≥4 или 5 раз в день), имеют большое значение. Пациенты должны быть информированы о значении сигналов ИП, особенно тех, которые сообщают о потенциальных перерывах в поступлении инсулина (например, отказ батареи, пустой шприц). Кроме того, пациенты должны помнить о том, что резервные запасы (например, дополнительные инфузионные наборы инсулина, насосные аккумуляторы и шприцы для инсулина или ручки) должны быть под рукой в случае сбоя работы помпы. Необходимо обеспечить пациенту доступность технической поддержки в течение 24 часов в сутки, чтобы он мог получить ответы на возникающие вопросы.
Дополнительное обучение требует времени и практических навыков не только от пациента и его семьи, но и от врачей. Дефицит времени, сложность освоения новых практических и теоретических навыков, а иногда и просто нежелание служат факторами, тормозящими распространение ПИТ. Данная проблема характерна не только для Российской Федерации, но и для стран Европы в целом. Несмотря на возникающие сложности, число используемых помп ежегодно увеличивается (табл. 3).

Лечение ИП является более дорогим методом по сравнению с традиционным лечением шприцами или шприц-ручками. С 2008 г. расходы на обеспечение расходными материалами (резервуары и наборы катетеров) для пациентов с СД, получающих лечение с помощью ИП, покрываются обязательным медицинским страхованием. Это стало серьезным шагом на пути внедрения ПИТ в Москве и Московской области. Однако до недавнего времени разовые расходы на приобретение инфузионного дозатора обеспечивались исключительно семьей пациента. За последние 2–3 года большой вклад в обеспечение инсулиновыми дозаторами детей и подростков с лабильным течением СД вносят благотворительные компании. В 2014 г. впервые 50 инсулиновых дозаторов (10 Парадигм Вео и 40 Акку Чек Комбо) для московских детей было закуплено Департаментом здравоохранения Москвы. Врачами отделения эндокринологии ГБУЗ «Морозовская ДГКБ» осуществлена установка ИП детям, обучение в школе «помповой инсулинотерапии» подростков и их родителей. Характеристика пациентов, которым были установлены ИП, представлены в табл. 5 и 6.
Наличие нескольких типов инфузионных наборов, различная длина микроканюли катетера обеспечивают возможность выбора с учетом особенностей строения тела, толщины подкожно-жировой клетчатки и возраста ребенка. Интегрированный бескатетерный насос микропомп (где резервуар и инфузионная система в одном микроустройстве) повышают привлекательность помп во всех возрастных группах.
Несмотря на множество новых возможностей, дальнейшие усовершенствования необходимы. Расширение возможностей подключения ИП к другим устройствам является еще одной областью улучшения результатов их применения. В течение многих лет инсулиновые насосы получали данные, передаваемые из глюкометров. Теперь ИП могут отображать данные из CGM (Computer Graphics Metafile) на одном экране и обмениваться данными для отображения на других удаленных устройствах. Эта функция может стать более распространенной в ближайшие несколько лет. В конечном счете ИП смогут посылать данные непрерывно в «облако». Однако в настоящее время большинство из них требует подключения к компьютеру. Усовершенствование отображения данных в интернет-передачу позволит ускорить связь «пациент–врач» для улучшения качества и скорости медицинской помощи пациентам с хроническими заболеваниями. Продолжаются исследования и с полностью замкнутым циклом «искусственной поджелудочной железы», в которой будут интегрированы CGM, ИП и алгоритм, дозируеющий необходимое количество инсулина в нужное время с конечной целью нормализации уровня глюкозы автоматически.
Помимо улучшений в интерфейсе пользователя есть очевидная потребность в учебных программах, осуществляемых квалифицированными, опытными врачами, чтобы предоставить их пациентам с различным опытом использования ИП.
Понятно, что даже после более чем десятилетнего опыта клинического использования ИП по-прежнему остается много нерешенных вопросов. Должны быть проведены высококачественные рецензируемые научные исследования, чтобы обеспечить оперативные ответы. Кроме того, поскольку технология ИП развивается быстрыми темпами, клиницисты должны иметь больше знаний о лучших и безопасных средствах для внедрения результатов исследований в клиническую практику.


