Воспалительный процесс, развивающийся в области слизистой оболочки, покрывающей верхние дыхательные пути, сопровождается увеличением числа бокаловидных клеток. Это ведет к повышению продукции секрета с высокой вязкостью и адгезией, что затрудняет его подвижность; снижению испарения секрета; угнетению мукоцилиарного транспорта; стагнации секрета на слизистой оболочке; фиксации бактерий к секрету и слизистой оболочке. Изменение реологических и физических свойств слизи является основной причиной большинства нарушений при воспалительных заболеваниях полости носа и околоносовых пазух, которые приводят к застою вследствие нарушения экспекторации (свободного отделения). Процесс слизеобразования, будучи физиологическим, способствует поддержанию биоценоза слизистой оболочки верхних дыхательных путей. В этой ситуации при нарушении возможностей реабилитации и защитных сил организма без внешней помощи сложно купировать подобный процесс.
Инфекционный процесс, представляющий вариант взаимодействия между бактерией и слизистой оболочкой, сопровождается адгезией и инвазией бактерий в слизистую оболочку. При этом на 60–80% уменьшается или останавливается мукоцилиарный транспорт. Снижается продукция секреторного иммуноглобулина А, препятствующего проникновению бактерий в организм, тормозя их адгезию и способствуя фагоцитозу, что особенно важно при хроническом воспалении [3, 5, 7, 8].
Регуляция гидратации слизи необходима для увлажнения вдыхаемого воздуха и для эффективности мукоцилиарного клиренса. Ионный состав, рН и осмолярность контролируют гидратацию слизи. Степень диффузии или всасывающая способность слизистой оболочки поддерживает ее эффективность как фильтрационного барьера против бактерий и контаминирующих агентов. Некоторые гликопротеины, содержащиеся в слизи, обладают выраженными бактериостатическими и бактерицидными способностями. В то же время адгезия к эпителию, снижение мукоцилиарного клиренса, приводящее к мукостазу, и продукция экскреторных энзимов помогают бактериям противостоять мукоцилиарному клиренсу. Так называемые адгезины находятся на поверхности бактерий и обеспечивают их сцепление со слизистой оболочкой. Затем патогены размножаются и «запускают» местную воспалительную реакцию.
Патофизиологические процессы, происходящие при воспалительных заболеваниях ЛОР-органов, особенно хронические, сопровождаются нарушением мукорегуляции. При этом происходит нарушение не только продукции слизи, ее состава, но и функции и структуры ресничек эпителия. Вырабатываемую при этом деструктурированную слизь с нарушенными реологическими свойствами организм не в состоянии выводить самостоятельно, что приводит к застою слизи и скоплению в полостях организма и прежде всего при ЛОР-заболеваниях, в полостях околоносовых пазух и среднем ухе [1, 6].
Большинство респираторных патогенов продуцируют экзотоксины, нарушающие функцию различных защитных механизмов, прежде всего мукоцилиарный клиренс. Как известно, наиболее частыми патогенами, вызывающими до 50% всех воспалительных заболеваний ЛОР-органов в мире являются Streptococcus pneumoniae и Нaemophilus influenzае. Так, пневмококк замедляет цилиарные колебания, вызывает некроз клеток эпителия и приводит к травмированию их стенок. Гемофильная палочка также вызывает замедление цилиарных колебаний и слущивание эпителия. Доказано, что инфекционное воспаление способствует сенсибилизации организма и более тяжелому течению аллергических заболеваний, в частности широко распространенного в настоящее время аллергического ринита. Многолетним опытом лечения воспалительных заболеваний околоносовых пазух и среднего уха подтверждена целесообразность включения в комплексную терапию муколитических препаратов. Острый бактериальный риносинусит в соответствии с международными рекомендациями по лечению синусита EPOS (2012) можно установить при наличии как минимум трех симптомов: гнойное отделяемое (больше с одной стороны) в полости носа, выраженная боль в области лица (больше с одной стороны), лихорадка (>38°С), повышение СОЭ/С-реактивного белка, «двух волн» (т.е. ухудшение состояния после исходно более легкой фазы заболевания).
 Введение в комплекс терапии риносинусита препаратов с муколитической активностью способствует разжижению вязкого секрета, содержащегося в пазухе, и, соответственно, улучшению эвакуации его из полости пазухи. Это стимулирует более быстрое разрешение воспалительного процесса. В то же время при нарушении или невозможности процесса эвакуации патологического отделяемого из околоносовых пазух, вовлеченных в процесс, могут развиваться осложнения (прежде всего внутричерепные) и хронизация процесса. Развитие воспаления в полостях среднего уха при остром среднем отите сопровождается экссудацией с образованием воспалительного или геморрагического выпота. Продуцируемый экссудат может эвакуироваться из среднего уха при нормальном функционировании слуховой трубы. Однако при высокой вязкости экссудата или при нарушении дренажной функции слуховой трубы он не покидает среднее ухо. При этом может формироваться экссудативный средний отит или хронический гнойный средний отит. Экссудат особой вязкости образуется при течении экссудативного среднего отита (ЭСО).
Введение в комплекс терапии риносинусита препаратов с муколитической активностью способствует разжижению вязкого секрета, содержащегося в пазухе, и, соответственно, улучшению эвакуации его из полости пазухи. Это стимулирует более быстрое разрешение воспалительного процесса. В то же время при нарушении или невозможности процесса эвакуации патологического отделяемого из околоносовых пазух, вовлеченных в процесс, могут развиваться осложнения (прежде всего внутричерепные) и хронизация процесса. Развитие воспаления в полостях среднего уха при остром среднем отите сопровождается экссудацией с образованием воспалительного или геморрагического выпота. Продуцируемый экссудат может эвакуироваться из среднего уха при нормальном функционировании слуховой трубы. Однако при высокой вязкости экссудата или при нарушении дренажной функции слуховой трубы он не покидает среднее ухо. При этом может формироваться экссудативный средний отит или хронический гнойный средний отит. Экссудат особой вязкости образуется при течении экссудативного среднего отита (ЭСО).
В такой ситуации для разрешения процесса экссудации также не бесполезным оказывается назначение препаратов с муколитическим эффектом.
В настоящее время препараты группы муколитиков внесены в разработанный стандарт лечения острого и хронического синусита в России и в международные рекомендации по лечению синусита EPOS-2012. В задачи муколитической терапии входят стимуляция выведения слизи, разжижение слизи, уменьшение внутриклеточного образования слизи, регидратация. В оториноларингологии используют несколько групп мукоактивных препаратов, обладающих различными механизмами действия [1–4, 6]. Муколитики прямого (ацетилцистеин) и непрямого действия (карбоцистеин) включены в рекомендации по ведению пациентов острым и хроническим синуситом и в стандарт специализированной помощи.
Муколитики прямого действия достаточно широко используют в РФ. Действие этого вида муколитиков определяется их способностью к восстановлению свойств слизи путем разрыва дисульфидных связей мукополисахаридов мокроты – молекулы деполимеризуются и мокрота становится менее вязкой и адгезивной. Однако одновременно происходит разрушение и молекулы секреторного иммуноглобулина А, являющегося первой линией защиты слизистой оболочки от патогенов. Тем самым наблюдается усугубление снижения местного иммунитета, развивающееся на фоне воспалительного процесса. Это может неблагоприятно сказаться на течении заболевания, а также способствовать переходу воспаления в хроническую форму. Кроме того, препратам – производным ацетилцистеина присущи множественные побочные реакции, развивающиеся как при местном, так и при системном их применении [2, 5].
Механизм действия муколитиков непрямого действия связан с активацией сиаловой трансферазы – фермента бокаловидных клеток слизистой оболочки. Сиаловая трансфераза нормализует количественное соотношение кислых и нейтральных гликопептидов, что восстанавливает вязкость и эластичность слизи, т.е. происходит замещение патологической слизи реструкторизованной, которая располагается между патологической слизью и слизистой оболочкой. При этом патологическая слизь как бы приподнимается, а пульсация ресничек осуществляется уже в контакте с физиологической слизью [9].
При осуществлении мета-анализа за последние 25 лет было обнаружено семь исследований, в которых участвовали 283 ребенка с ЭСО и рассматривалось 146 ушей с выявленным процессом. В основных группах пациенты получали карбоцистеин, а в контрольных – плацебо. При этом критериями улучшения состояния считали изменение до нормы тимпанограммы (тип А), аудиограммы и отоскопии, а также мнение родителей (улучшение или отсутствие проблемы). При статистической обработке использовали шкалу для оценки достоверности результатов исследований. Успешные результаты были достигнуты у 17% детей, получавших плацебо (от 5 до 38% в отдельных исследованиях), и у 35% детей, получавших S-карбоксиметилцистеин (от 22 до 80%). Из этого был сделан вывод, что один из пяти или шести детей, получающих лечение S-карбоксиметилцистеином на протяжении 1-3 месяцев, может избежать операции шунтирования барабанной полости, которую пришлось бы провести в случае, если бы этот ребенок получал плацебо. В среднем из каждых 100 детей, получавших плацебо в семи рассматриваемых исследованиях, 17 могли бы избежать операции (95% доверительный интервал от 11 до 23). В то же время в среднем из каждых 100 детей, получавших S-карбоксиметилцистеин в 7 рассматриваемых исследованиях, 35 могли бы избежать операции (95% доверительный интервал от 29 до 41) [10].
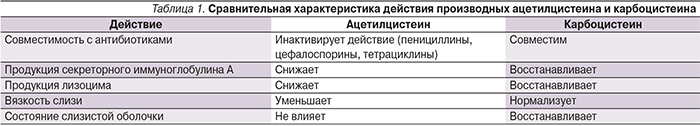
В табл. 1 мы представили сравнительную характеристику основных представителей мукоактивных препаратов: производных ацетилцистеина и карбоцистенина.
Представленный в нашей стране карбоцистеин Флюдитек снижает развитие мукостаза: нормализует вязкость секрета за счет регуляции соотношения кислых и нейтральных муцинов слизи, стимулирует активность ресничек. Повышает сопротивляемость организма к инфекции: снижает адгезию бактерий, титры вирусов, усиливает выработку секреторного иммуноглобулина A и лизоцима, ингибирует медиаторы воспаления (интерлейкины-6 и -8), нейтрализует реактивные промежуточные продукты окисления. Препарат выпускают в форме сиропа для детей и взрослых [7, 8].
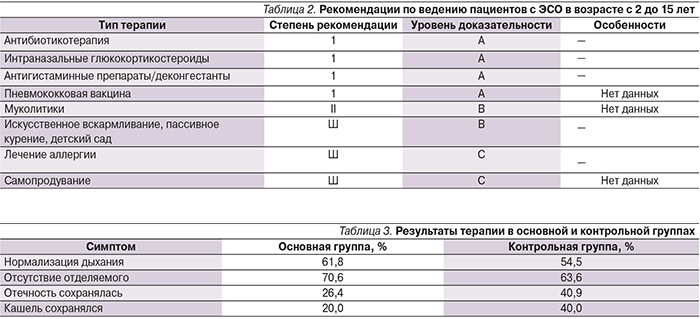
По данным зарубежных исследователей было показано, что один из пяти или шести больных, страдающих ЭСО и получающих лечение S-карбоксиметилцистеином на протяжении 1–3 месяцев, может избежать операции шунтирования барабанной полости, которую пришлось бы провести в случае, если бы пациент получал плацебо. Это снижает инвазивность комплексной терапии ЭСО, благодаря чему общие затраты на лечение в целом уменьшаются, а кроме того, экономится время хирурга, улучшается качество жизни больных. В настоящее время существуют лишь единственные, соответствующие требованиям доказательной медицины исследования в отношении целесообразности использования муколитиков в комплексной терапии ЭСО. Эти исследования включали препараты карбоцистеина, которые в нашей стране представлены препаратом Флюдитек. Обобщенные международные рекомендации по ведению пациентов, страдающих ЭСО в возрасте старше 2 лет, могут быть представлены в виде таблицы (табл. 2) [10].
Полученные результаты выполненного нами исследования в детском санатории, в которое были включены 58 часто болеющих детей в возрасте с 3 до 8 лет на этапе реабилитации, свидетельствуют об эффективности использования препарата Флюдитек в комплексном лечении воспалительных заболеваний верхних дыхательных путей. С целью объективизации результатов исследования мы использовали методику эксфолиативной цитологии назального секрета. Цитологическое исследование назального секрета основывали на подсчете общего относительного (%) количества клеточных элементов на 200 клеток с количественной оценкой фона (слизи) и микрофлоры. Особые различия у больных основной, в которой в комплекс терапии был включен препарат Флюдитек, и контрольной групп проявились в количестве, длительности и характере отделяемого.
Кашель почти у всех детей (у 88,2%) основной группы купировался к 7-му дню лечения. В контрольной группе характер отделяемого, видимо, стал меняться лишь на 5–6-й день от начала лечения. Уменьшение же его интенсивности наблюдали с 6–7-го дня. При эксфолиативной цитологии назального секрета у большинства больных до лечения были выявлены низкий цитоз реснитчатого эпителия, превалирование плоского эпителия, высокие цифры нейтрофилов, большое количество слизи, наличие в большом количестве разнообразной микрофлоры, преимущественно кокковой.
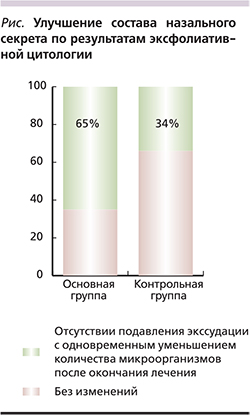
Эксфолиативные цитограммы по окончании лечения у 64,7% детей основной группы свидетельствовали об урегулировании процесса фагоцитоза и отсутствии подавления экссудации с одновременным уменьшением количества микроорганизмов. В контрольной группе подобные изменения имели место лишь у 36,4% пациентов и были менее выраженными. Через 14 дней от начала лечения всем пациентам также делали забор назального секрета и его цитологическое исследование (см. рисунок). Изменение в состоянии пациентов оценивали по состоянию дыхания, количеству или ликвидации отделяемого из полости носа, наличию отечности слизистой оболочки полости носа и наличию или купированию кашля. Эти данные отражены в табл. 3.
Мукоцилиарный транспорт представляет собой сложный процесс, в котором задействованы различные механизмы, поэтому с целью его реактивации следует использовать мукоактивные препараты, прежде всего препарат системного действия группы карбоцистеина (Флюдитек). К преимуществам препарата Флюдитек относят отсутствие риска развития синдрома «затопления» (у малышей, лежачих и ослабленных пациентов), повышение сопротивляемости инфекциям (у часто болеющих детей), отсутствие риска развития бронхоспазма (при бронхиальной астме и хронической обструктивной болезни легких), синергизм с бронхолитиками, меньший риск аллергических и побочных реакций.
Полученные результаты свидетельствуют об эффективности использования препарата Флюдитек в комплексном лечении воспалительных заболеваний верхних дыхательных путей, а также рациональности включения его в комплекс лечения детей, находящихся на санаторном этапе реабилитации. Терапевтическую эффективность применения мукоактивных препаратов целесообразно оценивать на основании результатов методики эксфолиативной цитологии назального секрета. Активность препарата сохраняется в течение 8 дней после окончания его приема. Поэтому не требуется дополнительной мукоактивной терапии.


