Широкое использование антибактериальных препаратов в медицинской практике ХХ в. позволило кардинально решить проблему инфекционной заболеваемости и смертности во всем мире. Начиная с 1950-х гг. появление пенициллина открыло эру антибиотиков, которые стали одними из самых распространенных рецептурных препаратов в мире. Спектр используемых антибактериальных средств с течением времени изменился: натуральные пенициллины уступили место полусинтетическим и синтетическим препаратам, на долю которых в настоящее время приходится основная часть назначений во всем мире. С увеличением частоты применения выявились и побочные эффекты антибиотикотерапии (АБТ), такие как аллергические реакции, формирование резистентных к антимикробным препаратам штаммов микроорганизмов и антибиотико-ассоциированная диарея (ААД), которая проявляется у каждого 5-го пациента [1].
Механизм развития ААД связан с неизбирательностью действия антибактериальных препаратов в отношении патогенных бактерий. Антибиотики широкого спектра действия оказывают влияние, в т.ч. и на «нормальные» микроорганизмы, населяющие желудочно-кишечный тракт (ЖКТ) человека, которые (как установлено в последние десятилетия) не только участвуют в процессах пищеварения [2, 3], но и осуществляют метаболическую и иммунологическую функции, участвуя в формировании пищевой толерантности и предотвращении развития аллергических реакций [4, 5], аутоиммунных [6, 7], инфекционных [8, 9] и, возможно, онкологических заболеваний [10, 11].
В настоящее время общепризнан факт наличия микроорганизмов в кишечнике человека с рождения. Состав микробиоты после рождения зависит от метода родоразрешения, характера питания, применения лекарственных препаратов в период новорожденности [12–16]. В дальнейшем количественные и качественные показатели микрофлоры зависят от продолжительности грудного вскармливания [17–19], наличия бактериальных и вирусных инфекций и воздействия других экзогенных патологических агентов [20–22]. Максимальное отрицательное влияние на состав микрофлоры в последующие возрастные периоды оказывают нарушение характера и режима питания, острый и хронический стресс, частая смена часовых поясов, заболевания органов пищеварения и, конечно, воздействие лекарственных препаратов – цитостатиков, гормонов, антибиотиков [23]. Наиболее уязвима микрофлора кишечника новорожденных и детей раннего возраста, которых антибактериальные препараты приводят к выраженным нарушениям состава микробиоты и развитию ААД [24, 25].
По определению Всемирной организации здравоохранения, ААД – это 3 и более эпизодов неоформленного стула в течение двух и более последовательных дней, возникших на фоне применения антибактериальных средств и/или в течении 8 недель после их отмены, если не выявлены другие причины. ААД возникает приблизительно у 5–10% пациентов, получающих ампициллин, 10–25% больных, леченных ампицилин/клавунатом или цефиксимом, и 2–5% детей, принимающих антибактериальные препараты других групп [26, 27].
Развитие ААД в 20% случаев связано с избыточным ростом Clostridium difficile – аэробной грамположительной бактерии. Эта форма болезни протекает наиболее тяжело за счет продукции энтеротоксинов, под влиянием которых развивается поражение эпителия тонкого и толстого кишечника, гиперсекреция электролитов и воды [28–30]. Значительно реже ААД вызывается размножением других условно-патогенных микроорганизмов: Clostridium perfringens (тип А), Staphylococcus aureus, Salmonella spp., Klebsiella oxytoca, грибами рода Candida [26, 27, 31, 32] или этиологический бактериальный фактор не определяется. Появлению идиопатической ААД могут способствовать повышение осмолярности кишечного содержимого за счет неполного всасывания некоторых антибиотиков (цефалоспоринов), а также нарушение метаболической активности кишечной микрофлоры с увеличением количества желчных кислот и стимуляцией выброса хлоридов и воды. Клавулановая кислота и макролиды, кроме того, способствуют усилению моторики кишечника, вызывая гиперкинетический тип диареи [23].
Клиника ААД зависит от возраста ребенка. У детей первого года жизни доминируют проявления по типу среднетяжелых форм колита и энтероколита с незначительным повышением температуры тела и интоксикацией. У детей более старшего возраста клиническая картина клостридиоза более яркая с диарейным, гипертермическим и интоксикационным синдромами. Самым тяжелым проявлением инфекции, вызванной Clostridium difficile, является псевдомембранозный энтероколит, проявляющийся выраженными симптомами интоксикации, резким учащением стула и изменением его характера до водянистого с примесью крови, тяжелым эксикозом. При проведении колоноскопии выявляются бляшковидные или лентовидные плотные налеты желтого цвета («псевдомембраны»), плотно спаянные с эпителиальными клетками на фоне отека слизистой оболочки [30].
По возможности лечение ААД следует начинать с отмены противомикробного препарата, послужившего причиной развития заболевания. Кроме того, при высеве патогенных или условно патогенных микроорганизмов, необходимо назначение антибактериальных или противогрибковых средств [30, 31]. В комплексной терапии ААД используют также антидиарейные средства и регидратацию.
В последние годы активно изучается использование пробиотиков – живых микроорганизмов, являющихся представителями индигенной кишечной микрофлоры человека, для лечения и профилактики ААД [33, 34]. Механизм их действия в данном случае связан с восстановлением количественного и качественного состава нормальной кишечной микрофлоры с подавлением роста патогенных штаммов и вторичной нормализацией процессов пищеварения. Выделяют монокомпонентные пробиотики, содержащие микроорганизмы одного штамма, поликомпонентные препараты, в состав которых входит несколько микроорганизмов, а также синбиотики, представляющие собой комбинацию пробиотиков и пребиотиков (веществ, способствующих росту собственной нормальной микрофлоры) [35, 36].
Фармацевтической промышленностью разрабатывается довольно большой арсенал пробиотиков, но далеко не все из них удовлетворяют нуждам клиники. Идеальное пробиотическое средство должно оставаться жизнеспособным при прохождении через ЖКТ; иметь хорошую адгезию на эпителии слизистой оболочки кишечника и способность к его колонизации; синтезировать вещества против патогенных микроорганизмов; сохранять стабильность при хранении; быть безопасными и иметь клинически доказанную пользу для здоровья человека [35, 36]. Одним из средств, удовлетворяющих всем перечисленным требованиям, является Нормобакт (МЕДАНА ФАРМА АО, Польша) – биологически активная добавка к пище, источник пробиотических микроорганизмов (бифидо- и лактобактерий) и пребиотических веществ – фруктоолигосахаров. Входящие в состав Нормабакта штаммы бактерий Lactobacillus acidophilus LA-5 и Bifidobacterium animalis BB-12 имеют достаточный положительный опыт применения в медицине [37–39].

Однако опыт использования Нормобакта при ААД у детей до настоящего времени был недостаточным, что и определило цель настоящей работы.
Материал и методы
С одобрения Локального этического комитета при Мордовском государственном университете на базе Мордовской Детской республиканской клинической больницы (Саранск) нами проведено сравнительное рандомизированное клиническое исследование эффективности синбиотика Нормобакта по сравнению с пробиотическим препаратом Линекс (представляющего собой смесь лакто- и бифидобактерий) для профилактики АДД у детей раннего возраста. В исследование были включены 60 детей в возрасте от 6 до 12 месяцев без клинически значимой патологии ЖКТ, получавшие антибиотики для лечения основного заболевания, при наличии письменного информированного согласия законного представителя пациента на участие в наблюдении.
Из исследования исключались дети с острой кишечной инфекцией; пациенты, получавшие пробиотики или пребиотики до назначения исследуемых препаратов, больные с имеющейся индивидуальной непереносимостью компонентов препаратов в анамнезе, а также в отсутствие информированного согласия родителей или опекунов и отказом в участии в процессе исследования.
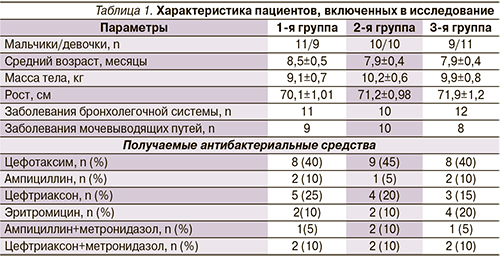
В исследование включены 33 ребенка с патологией бронхолегочной системы (острый обструктивный бронхит, бронхиолит, пневмония) и 27 пациентов с патологией мочевыделительной системы (инфекция мочевыводящих путей, пиелонефрит). После подписания информированного согласия методом простой рандомизации пациенты были разделены на три группы по характеру назначаемой терапии. Группы были сопоставимы по полу и возрасту, антропометрическим данным, основному заболеванию и характеру проводимой АБТ (табл. 1).
В 1-ю группу были включены 20 детей, получавших на фоне приема антибиотиков Нормобакт по 1 саше в сутки (в течение не менее 7 дней АБТ и 10 дней после ее окончания); 2-ю группу составили 20 детей, получавших антибиотики и Линекс по 1 капсуле 3 раза в сутки по аналогичной схеме, а 3-ю – 20 детей, получавших АБТ без пробиотиков.

Оценивали влияние Нормобакта и Линекса на функциональное состояние ЖКТ по наличию срыгиваний, рвоты, метеоризма, кишечных колик, диареи, запоров по 4-балльной системе (0 баллов – отсутствие признака; 1 балл – наличие признака 1 раз в неделю; 2 балла – наличие симптома 2–3 раза в неделю; 3 балла – наличие симптома ежедневно; 4 балла – наличие изучаемого симптома несколько раз в сутки). Также определяли темпы прибавки массы тела и динамику состава микрофлоры дистальных отделов кишечника по микробиологическому анализу фекалий. Физикальное обследование, антропометрию и анализ кала проводили в начале исследования, после завершения курса лечения (20±2 дня исследования) и на завершающем этапе – через 30 дней после завершения курса терапии (50±2 дня). Результаты обработаны общепринятыми методами вариационной статистики.
Результаты исследования
За время лечения у пациентов групп сравнения, получавших пробиотики, не зафиксировано достоверных отличий в динамике показателей роста и массы тела (табл. 2), однако по сравнению с детьми контрольной группы прибавка роста и массы тела была более выражена у пациентов, получавших Нормобакт.
До применения антибактериальных препаратов у некоторых детей отмечались явления дисфункции ЖКТ в виде редких эпизодов срыгиваний (у 3–15% детей в 1-й и 2-й группах и 4–20% детей контрольной группы), метеоризма (у 15–75% детей в каждой группе), кишечных колик (по 1 пациенту в группе Нормобакта и контрольной группе) и запоров (по 1 представителю 1-й и 3-й групп). Выраженность указанных симптомов не превышала 1 балла. На фоне дополнительного к антибиотикам использования пробиотиков несколько реже, чем в контрольной группе, регистрировались такие симптомы нарушений функций ЖКТ, как метеоризм (у 40 и 50% пациентов группы Нормобакт и Линекс соответственно против 85% в контроле), кишечные колики (у 45 и 55% против 90% детей соответственно) и диарея (у 30 и 45% против 75% в контроле соответственно). Срыгивания наиболее редко выявлялись у детей, получавших Нормобакт, а такой признак, как рвота, отсутствовал вовсе.
Отмеченные различия сохранялись и даже нарастали через 4 недели после прекращения лечения (табл. 3), при этом у пациентов, получавших Нормобакт, в отличие о больных, получавших Линекс, в 2 раза реже регистрировались метеоризм и кишечные колики (10,5 и 10,5% против 26,4 и 21% соответственно), тогда как в контроле эти проявления ААД сохранялись у 58,8 и 59,2% детей соответственно (p<0,05). Диарея через месяц после окончания лечения не отмечена ни у одного из больных группы Нормобакта, сохраняясь у 1 пациента, получавшего Линекс, и у 6 (56%) детей контрольной группы (p<0,05).
На фоне приема Нормобакта заметно снижалась общая продолжительность диспепсии. Так, если у детей контрольной группы диспепсические явления дебютировали в среднем на 2,2±1,1 суток приема антибиотиков и продолжались еще 16,5±1,9 суток после прекращения АБТ, в группе детей, дополнительно получавших Нормобакт, они проявились только на 5,2±0,9 суток АБТ (p<0,05) и продолжались только 6,4±0,52 суток (р<0,001). Использование пробиотика Линекс сокращало длительность диареи не так эффективно, как применение синбиотика – до 10,3±1,4 суток после окончания АБТ (отличия с группой Нормобакта достоверны при р<0,01), но достоверно относительно контроля.
Следует отметить, что степень выраженности метеоризма, кишечных колик и диареи была статистически значимо меньше у детей, получавших пробиотики, а среди них имела тенденцию к более низким значениям в группе пациентов, получавших Нормобакт, как во время АБТ, так и через 4 недели после прекращения терапии (рис. 1).

Интенсивность срыгиваний в период АБТ также была выражена статистически значимо меньше у детей, получавших дополнительно пробиотики, по сравнению с контрольной группой, но без различий в группах Нормобакта и Линекса.
При оценке состояния микрофлоры кишечника у детей, получавших антибактериальную терапию, во всех группах было отмечено снижение количества бифидо- и лактобактерий (рис. 2), однако оно было минимальным у пациентов, получавших синбиотик Нормобакт.
Через месяц после окончания терапии у детей, получавших биологически активную добавку Нормобакт, в 84,2% случаев отмечена нормализация содержания бифидобактерий и в 89,4% – лактобактерий, что существенно отличалось от группы контроля, в которой уровень бифидобактерий восстановился лишь у 38,4%, а лактобактериий – у 41,2% больных (p<0,05). Среди больных, получавших Линекс, нормальное количество бифидо- и лактобактерий зарегистрировано в 63,1 (p>0,05) и 73,6% (p<0,05) случаев соответственно. Весьма важным считаем тот факт, что только на фоне приема синбиотика Нормобакта через четыре недели после прекращения терапии не было выявлено детей с полным отсутствием бифидо- и лактобактерий (тогда как во 2-й и 3-й группах их было 15,7 и 35,3%, 10,5 и 17,6% соответственно).
У всех пациентов на фоне АБТ было отмечено появление гемолизирующей кишечной палочки (в 5–15% случаев), однако у пациентов, получавших пробиотические препараты, через месяц после окончания лечения гемолизирующая кишечная палочка в посеве фекалий не определялась, а в контрольной группе продолжала выделяться у 29,4% детей. Качественно подобные, но менее убедительные результаты получены и в отношении гемолитического стафилококка, лактозонегативных энтеробактерий, спорообразующих клостридий и микроорганизмов рода Proteus (рис. 3)
Грибы рода Candida на фоне антибактериальной терапии также выявлялись у представителей всех групп (в 30–47,4% случаев), а через 30 дней от момента прекращения терапии высевались только у 5,3% пациентов, получавших Нормобакт, у 15,8% детей, получавших Линекс, и у 41,2% детей контрольной группы (рис. 4).
Таким образом, применение препаратов, содержащих пробиотические культуры бактерий, способствовало более позднему развитию диспепсических явлений, меньшей степени их выраженности и более быстрому исчезновению. Лучшие результаты по сокращению сроков диспепсии отмечены у препарата синбиотика Нормобакт по сравнению с препаратом Линекс, что, вероятнее всего, связано с наличием в составе Нормобакта пребиотика (рафтилозы) и более высокой концентрацией бифидо- и лактобактерий.


