Хроническая обструктивная болезнь легких (ХОБЛ) – заболевание, в основе которого лежит воспаление всех структур легочной ткани, индуцированное воздействием патогенных частиц или газов (поллютантов), приводящее к нарастающим, необратимым грубым морфологическим и функциональным изменениям в легких. Ведущим клиническим синдромом ХОБЛ остается нарастающая необратимая обструкция и прогрессирующая дыхательная недостаточность. Заболеваемость и смертность от ХОБЛ неуклонно растут. Так, по прогнозам Исследования глобального ущерба от заболеваний, ХОБЛ, занимавшая 6-е место по числу смертей в 1990 г., к 2020 г. выйдет на 3-е, а к 2030-му – на 4-е места среди причин смерти [1]. Поскольку ХОБЛ является заболеванием, которое можно лечить [2], особенно важными становятся вопросы ранней диагностики и дифференцированной, индивидуально подобранной, своевременно начатой терапии. Для решения этой задачи выбран метод интегрального подхода к оценке ХОБЛ.
Интегральный подход к оценке ХОБЛ. Основные критерии оценки заболевания
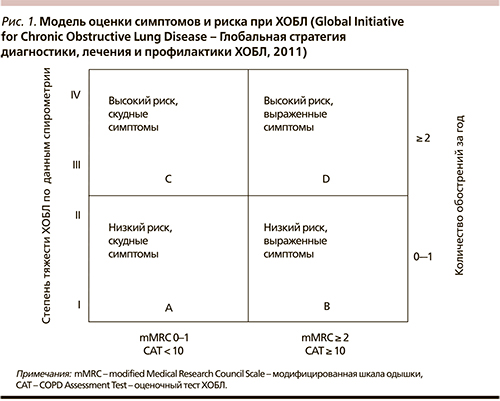
Длительное время существовавший подход, характеризующий ХОБЛ с позиций только оценки степени выраженности вентиляционных нарушений, оказался ошибочным, что было продемонстрировано в исследовании ECLIPSE (Evaluation of COPD Longitudinally to Identify Predictive Surrogate End-point) [3, 4]. Это исследование выявило отсутствие прямой корелляции между нарушением вентиляционных показателей и основными клиническими проявлениями болезни (частотой обострений, выраженностью одышки, качеством жизни). В качестве критериев интегральной оценки ХОБЛ были выбраны следующие показатели, характеризующие особенности течения болезни: степень выраженности вентиляционных нарушений, частота и степень тяжести обострений, выраженность одышки, критерий влияния болезни на качество жизни пациента. Все больные по этим критериям делятся следующим образом: по степени выраженности вентиляционных нарушений – на категории А и С, по частоте и тяжести обострений – на категории B и D, по выраженности проявлений и влиянию на качество жизни – на категории А и В. Основной причиной изменения подхода к оценке заболевания (интегральный подход) явилось отсутствие прямой корреляции между степенью вентиляционных нарушений и основными критериями, характеризующими болезнь. Результатом исследования ECLIPSE стала разработка интегрального подхода к оценке заболевания, схема представлена на рис. 1.
Краеугольным, характеризующим болезнь, служит понятие риска – риска неблагоприятного исхода (снижения качества жизни, физической работоспособности, инвалидности, летального исхода). Для правильной оценки заболевания и степени риска со стороны конкретного пациента крайне важно понимать, что критерии оценки заболевания не связаны между собой. Кроме того, эти критерии обладают разной степенью важности для определения прогноза больного.
По степени значимости для характеристики болезни критерии можно распределить в следующем порядке:
Наличие в анамнезе жизнеугрожающего обострения является важнейшим критерием неблагоприятного прогноза. Больного, перенесшего жизнеугрожающее обострение, следует отнести к категории D – категории высокого риска.
Частота обострений: 0–1 случай за 1 год – низкий риск; ≥ 2 – высокий риск. Таким образом, если пациент за последний год перенес 2 и более обострений, его также следует относить к категории D.
Нарушение вентиляционной функции (объем форсированного выдоха [ОФВ1] < 50 % должной величины – высокий риск; < 50 % – низкий риск) – важный критерий, особенно при редких обострениях (0–1 случай за год); пациент, перенесший 0–1 обострение за год при ОФВ1 < 50 %, относится к категории С – категории высокого риска.
Выраженность клинических проявлений (оценка по mMRC, CAT) – когда пациент имеет 0–1 обострение за год, а ОФВ1 > 50 %, оценка выраженности клинических проявлений позволяет решить, определить пациента к группе А или В: при оценке по mMRC 0–1 и по САТ менее 10 баллов пациент относится к категории А, при оценке mMRC более 2, оценке по САТ более 10 пациент относится к категории В.
Этот алгоритм позволяет объективно стратифицировать риск неблагоприятного прогноза заболевания, а следовательно, верно подойти к выбору стартовой терапии.
Алгоритм выбора стартовой терапии
Лечение ХОБЛ представляет собой достаточно сложную задачу, требующую от врача четкого понимания проблемы, знания патогенеза болезни и применения определенных алгоритмов.
Немедикаментозное лечение ХОБЛ предполагает в первую очередь отказ от курения, ежегодную вакцинацию против гриппа, улучшение микроэкологии жилища, респираторную поддержку, легочную реабилитацию.
Средства для медикаментозного лечения ХОБЛ должны обладать доказанной способностью снижать частоту обострений, уменьшать выраженность симптомов, замедлять прогрессирование вентиляционных нарушений, кардинально снижать риск неблагоприятного прогноза. Эти показатели – основополагающие в прогнозировании течения ХОБЛ у конкретного пациента.
Одним из лекарственных препаратов с доказанной эффективностью в отношении неблагоприятных исходов ХОБЛ относится комбинированный препарат флутиказона пропионат/сальметерол [5]. Результаты многочисленных и долгосрочных исследований TORCH (Towards a Revolution in COPD Health), INSPIRE (Investigating New Standards for Prophylaxis in Reducing Exacerbations) подтверждают выраженные долгосрочные эффекты от флутиказона пропионата/сальметерола: снижение частоты обострений, замедление падения ОФВ1, улучшение качества жизни, снижение выраженности симптомов [6–12].
Так, в 3-летнем исследовании TORCH было показано снижение риска смерти при приеме салметерола/флутиказона пропионата на 17,5 % по сравнению с плацебо, однако этот тренд не достиг статистической значимости (p = 0,052), хотя надо отметить, что эффективность препарата, продемонстрированная в исследовании TORCH, клинически значима и сравнима с влиянием статинов на снижение летальности при ишемической болезни сердца и прекращением курения при ХОБЛ.
В 2-летнем исследовании INSPIRE отмечено статистически значимое снижение риска летальности по любой причине на 52 % в группе терапии салметеролом/флутиказона пропионатом по сравнению с тиотропия бромидом.
Стратегически важно выделение в течение болезни стабильной фазы и фазы обострения. Количество обострений в течение года является важнейшим фактором, влияющим на прогноз. В период обострения ухудшается общее состояние больного, стойко нарушаются показатели газообмена, ускоряется снижение вентиляционных показателей и как следствие – болезнь быстрее прогрессирует. Таким образом, у пациентов с числом обострений 2 и более за год можно говорить о неконтролируемом течении ХОБЛ. Даже если вне обострения показатели функции внешнего дыхания пациента могут быть в пределах среднестатистической нормы, необходимо помнить, что речь идет именно о среднестатистической, а не об индивидуальной норме. Влияние на частоту обострений ХОБЛ является одним из путей лечения, направленного на улучшение прогноза болезни [13]. Именно поэтому так важно стремиться не только к купированию обострения и переводу в стабильное течение, но и к полному контролю над заболеванием.
Критерии достаточного контроля:
- отсутствие жизнеугрожающих обострений;
- число обострений 0–1 за год;
- падение спирометрических показателей в течение года не более физиологической нормы (50–60 мл/год), поэтому важным мероприятием остается регулярный контроль и самоконтроль спирометрических показателей с помощью пикфлоуметра или вентило-метра.
Комбинированные препараты (ингаляционные глюкокортикостероиды/длительно действующие β2-агонисты или длительно действующие β2-агонисты) подходят не только для ведения стабильной ХОБЛ, но и для купирования обострения, а также для снижения риска обострений в будущем. Так, комбинация салметерол/флутиказона пропионат статистически значимо снижала ежегодную частоту среднетяжелых/тяжелых обострений на 25 % среди пациентов с ХОБЛ (ОФВ1 < 60 % должного) по сравнению с плацебо (p < 0,001), в т.ч. тяжелых обострений, требующих госпитализации, – на 17 % (p < 0,03) [12]. Один из последующих анализов исследования TORCH продемонстрировал возможность комбинации салметерол/флутиказона пропионат снижать скорость падения ОФВ1 и таким образом замедлять прогрессирование заболевания [14].
Следует добавить, что терапия обострений ХОБЛ требует более высоких доз базисных препаратов, проведения активной противовоспалительной и противоинфекционной терапии, а подчас и респираторной поддержки.
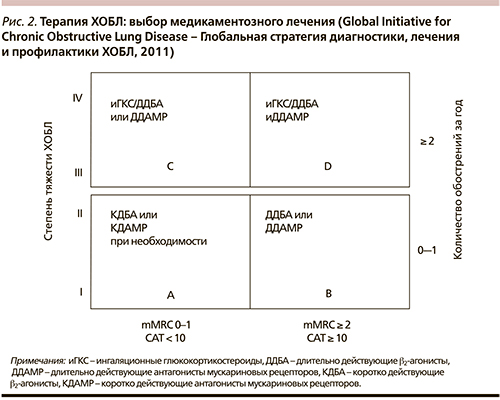
При выборе медикаментозной терапии необходимо руководствоваться следующим алгоритмом [5]:
1. Оценка параметров, характеризующих заболевание:
- оценка частоты и степени тяжести обострений (0–1 случай за год – низкий риск; ≥ 2 – высокий риск, жизнеугрожающие обострения);
- оценка степени вентиляционных нарушений (ОФВ1 < 50 % должной величины – высокий риск; < 50 % – низкий риск);
- оценка выраженности симптомов заболевания: выраженность одышки по шкале MRC (British Research Medical Council scale) (0–1 балл – низкая; ≥ 2 – выраженная);
- влияние на качество жизни по CAT-тесту (COPD Assessment Test) (≤ 10 баллов – низкое, >10 баллов – серьезное).
2. Определение группы, к которой отнесен данный пациент.
3. Выбор терапии согласно определенной группе в соответствии с рекомендациями Global Initiative for Chronic Obstructive Lung Disease (Глобальная стратегия диагностики, лечения и профилактики ХОБЛ, 2011) [1], рис. 2.


