Введение
Проблема лечения болевого синдрома во многих странах мира представляет весьма актуальную проблему, в частности лечение болевых синдромов с локализацией «голова–шея». Это также достаточно часто обсуждаемая тема в литературе, посвященной проблемам лечения дорсалгий, вертеброгенных болевых синдромов, что еще раз подчеркивает ее актуальность. Это продиктовано тем, что болевой синдром порой характеризуется достаточной стойкостью и длительностью, что влечет за собой развитие психоэмоциональных расстройств [1]. Боль в любом отделе позвоночника – это симптом, а не нозологическая форма, поэтому термины, относящиеся к шейной локализации боли («цервикалгия», «цеврикобрахиалгия» и т. д.) и не только, чаще отображают скелетно-мышечную этиологию болевого синдрома [2, 5].
Цервикокраниалгические болевые синдромы встречаются в основном среди трудоспособной части населения. Причиной их развития могут быть избыточный вес, гиподинамия, тяжелая физическая работа, длительные «тонические» нагрузки, связанные с профессиональной деятельностью. Обычно интенсивная боль проходит в течение 1–2 недель, но незначительные боли у 66–70 % пациентов сохраняются еще в течение приблизительно месяца. Для большинства пациентов причины цервикокраниалгии связаны с морфологическими и функциональными изменениями в опорно-двигательном аппарате. Патологические морфологические изменения локализуются в межпозвонковых дисках, телах позвонков. С возрастом межпозвонковые диски теряют воду, в них происходит изменение протеогликанов, что приводит к снижению высоты диска. Фасеточные суставы испытывают большую нагрузку, уменьшается натяжение связок, что сопровождается гипермобильностью позвонково-двигательного сегмента. Это приводит к раздражению болевых рецепторов синовиальных оболочек межпозвонковых суставов и как следствие – возникновению болевого синдрома. При этом изменения в шейном отделе позвоночника, выявляемые с помощью рентгенограмм, компьютерной, магнитно-резонансной томографии, слабо коррелируют с наличием и интенсивностью цервикалгии. Также нет четкой корреляции между наличием боли и дискогенными изменениями в определенном отделе позвоночника. Чаще боль возникает при морфо-анатомических изменениях, типичных для спондилолистеза, остеохондроза и других дегенеративно-дистрофических изменений позвоночника. В происхождении боли наряду с морфологическими изменениями важную роль играет функциональное обратимое блокирование межпозвонковых суставов. К причинам блокирования относятся статические или динамические нагрузки, микротравмы, нефизиологические позы. На появление болевой импульсации мышцы практически всегда реагируют тонической рефлекторной реакцией. Напряжение задней группы мышц шеи, и перикраниальных в т. ч., необходимо для иммобилизации пораженного сегмента и создания мышечного корсета. Однако при длительном тоническом напряжении мышц последние в конечном итоге сами становятся источником болевой импульсации. В большинстве случаев мышцы могут страдать первично. Избыточное напряжение ряда мышечных групп, обусловленное различными причинами, приводит к дисфункции миофасциальных тканей с формированием болевого синдрома. Миофасциальные болевые синдромы могут как наблюдаться вне зависимости от вертеброгенной патологии, так и быть осложнением вертеброгенных болей. Таким образом, источники боли в спине многообразны. Ими могут быть капсулы суставов, связки, фасции, мышцы, позвонки (болевые рецепторы обнаружены в надкостнице и кровеносных сосудах), межпозвонковые диски (болевые рецепторы обнаружены в наружной трети фиброзного кольца). Болевые рецепторы, с которых начинается формирование болевого импульса в вышеперечисленных структурах, называются ноцицепторами. От них импульс поступает в центральные структуры нервной системы (спинной и головной мозг). В головном мозге происходит процесс перцепции – пришедший импульс трансформируется в понятие «боль». Боль, которая формируется по такому патофизиологическому механизму, называется ноцицептивной. Более редкой причиной боли в спине является компрессия, или ишемия, корешка, нерва, спинального ганглия (компрессионная радикулопатия). Это патологическое состояние приводит к более тяжелому и длительному (часто хроническому) болевому синдрому. При повреждении нервной ткани в ней изменяются количество и функционирование ионных каналов. Такая боль часто сопровождается рядом других симптомов: парестезией, аллодинией и т. п. Боль, возникающая вследствие подобных патофизиологических процессов, называется нейропатической. У пациентов, страдающих депрессией, боли в спине могут иметь чисто психогенную природу, когда психические факторы играют основную роль в возникновении, тяжести, усилении и сохранении боли, а собственно боль является продуктом измененного восприятия окружающего мира пациента [6, 7]. Понимание ведущего патофизиологического механизма боли (ноцицептивная, нейропатическая, психогенная) очень важно для правильного выбора тактики ее медикаментозного лечения. Абсолютно доказана полезность, возможно, скорейшего обезболивания пациента. Чем раньше начато лечение и быстрее достигнут значимый анальгетический эффект, тем меньше вероятность хронизации боли и лучше общий прогноз. Для лечения боли в спине наиболее часто применяют нестероидные противовоспалительные препараты (НПВП), опиоиды, миорелаксанты, антиконвульсанты, антидепрессанты, местные анестетики, препараты витаминов группы В. Нестероидные противовоспалительные препараты, опиоиды, миорелаксанты наиболее эффективны при ноцицептивной боли, а антиконвульсанты, антидепрессанты, местные анестетики, препараты витаминов группы В – при нейропатической [4]. Общепризнанным при ноцицептивных болях в различных отделах позвоночника считается обезболивание с помощью НПВП. Препараты этой группы способны влиять на болевую импульсацию на всех уровнях афферентной передачи – от периферических ноцицепторов до таламических центров мозга [3]. Основной механизм действия НПВП заключается в нарушении продукции простагландинов благодаря ингибированию ключевого фермента их синтеза – циклооксигеназы (ЦОГ). В конце ХХ в. были открыты различные изоформы ЦОГ, что дало толчок к пониманию механизмов развития лечебного и побочного эффектов НПВП. Стало известно, что в патологических условиях активация ЦОГ второго типа (ЦОГ 2) определяет продукцию провоспалительных и проальгогенных простагландинов. Синтезированные при участии ЦОГ 2 в очаге повреждения тканей простагландины повышают чувствительность ноцицепторов к различным стимулам, переводя ноцицепторы в состояние, когда они легко возбуждаются при различном воздействии. Нестероидные противовоспалительные препараты, блокируя образование простагландинов в очаге повреждения тканей, прекращают или ослабляют болевую импульсацию. Исследования последних лет показали, что в отличие от других органов в центральной нервной системе ЦОГ-2 синтезируется в постоянном режиме. Предполагается, что ЦОГ-2 нервной системы также принимает участие в проведении болевого стимула. Например, наблюдается экспрессия ЦОГ-2 в спинном мозге после развития периферической гиперальгезии. НПВП оказывают эффект и на супраспинальном уровне. Они влияют на таламические центры болевой чувствительности, блокируя синтез простагландинов в таламусе. Реализация всех этих механизмов приводит к достаточно высокой эффективности НПВП при ноцицептивной и смешанной боли, но к незначительному уменьшению интенсивности нейропатической боли. Циклооксигеназа-1 в большей степени отвечает за наработку нормального физиологического пула простагландинов, осуществляющих гастропротекторную и ряд других важных физиологических функций в организме. Понимание различной роли изоформ ЦОГ в воспалении и генезе побочных эффектов представителей группы НПВП привело к созданию и внедрению в клиническую практику наряду с классическими относительно селективных и высокоселективных ЦОГ-2 ингибиторов. Эти препараты имеют меньшую гастроэнтерологическую токсичность. В связи с этим достаточно интересным и актуальным остается применение препарата Кетонал. Этот НПВП, являясь производным пропионовой кислоты, обладает достаточно сбалансированным эффектом в отношении ЦОГ-1 и ЦОГ-2 [8]. Кетонал – один из наиболее мощных анальгетиков в группе НПВП. Выраженное противовоспалительное и обезболивающее действие Кетонала определяется его фармакокинетическими и фармакодинамическими свойствами. Он мощно и сбалансированно ингибирует ЦОГ-2 и ЦОГ-1, тормозит образование интерлейкина-6 и синтез индуцибельного оксида азота. Кроме того, препарат стимулирует опиоидергические системы, усиливая выработку эндогенного динорфина и эндорфина, что способствует физиологической активации антиноцицептивной системы организма.
Роль НПВС в терапии хронических болевых синдромов в области шеи Эффективное лечение миофасциального болевого синдрома является непростой задачей, стоящей перед врачом, и требует изыскания новых терапевтических возможностей. НПВП являются средством выбора «первого ряда» для лечения воспалительных заболеваний костно-мышечной системы и занимают непоследнее место в терапии болевых синдромов любой локализации. Благодаря своему механизму действия НПВП лучшим образом зарекомендовали себя при обострении болевых синдромом слабой и умеренной интенсивности [11].
В последние годы арсенал НПВП значительно увеличился, появились новые перспективные лекарства, имеющие широкий фармакологический профиль и удачно сочетающие скорость наступления обезболивающего эффекта и безопасность. Это существенно расширяет терапевтические возможности врача, позволяет подобрать адекватное лечение с оптимальным соотношением пользы и риска, максимально его индивидуализировать на догоспитальном этапе.
Одним из наиболее перспективных обезболивающих препаратов является Кетонал (Lek, Словения), основным действующим веществом которого является кетопрофен. Он неселективно ингибирует ферменты ЦОГ-1 и ЦОГ-2 и частично – липооксигеназу [9, 10]. Мощные противовоспалительный и анальгетический эффекты Кетонала связаны с тем, что он обладает как периферическим, так и центральным механизмами действия, поэтому применяется даже при выраженном болевом синдроме. В периферических тканях кетопрофен подавляет синтез простагландинов, стабилизирует лизосомальные мембраны, обладает отчетливой антибрадикининовой активностью.
Целью настоящей работы (рандомизированного открытого сравнительного исследования) является сравнительная оценка эффективности и скорости наступления обезболивающего эффекта препаратов Кетонал, Ортофен и Мовалис на больных цервикокраниалгией на догоспитальном этапе.
Материал и методы
В исследование были включены 42 пациента (35 женщин и 6 мужчин), страдающих цервикокраниалгией. Длительность заболевания составила 2,3 года. Средний возраст –35,5 ± 3,7 года. Пациенты методом простой рандомизации были разделены на 3 группы: 1-я группа (14 человек) применяла Мовалис 7,5 мг 2 раза в день, 2-я (14 человек) – получала терапию Кетоналом 100 мг 2 раза в день, пациентам 3-й группы (14 человек) был назначен Ортофен 25 мг по 1 таблетке 2 раза в день. Препараты были выбраны по причине популярности среди врачей амбулаторной практики. Параллельно с назначенными препаратами врачами применялись антиоксидантная, седативная терапия, а также антидепрессанты.
Критерии включения в исследование:
- миофасциальный болевой синдром с интенсивностью не менее 6 баллов по визуально-аналоговой шкале (ВАШ);
- отрицательный тест на беременность у женщин детородного возраста;
- возраст от 18 лет и старше.
Критерии исключения:
- неадекватное поведение пациента;
- непереносимость НПВП;
- язвенная болезнь с наличием симптомов диспепсии;
- наличие у больных вторичной или злокачественной артериальной гипертензии (3-я степень, III стадия);
- тяжелые нарушения ритма сердца, требующие дополнительной антиаритмической терапии;
- тяжелые бронхообструктивные заболевания;
- декомпенсированный сахарный диабет;
- индивидуальная непереносимость исследуемых препаратов.
Максимальный срок назначения препаратов составил 10 дней. Важно отметить, что в отличие от многих НПВП, у Кетонала отсутствует ограничение по длительности использования, что позволяет свободно использовать его для длительных курсов терапии, без необходимости переключения на альтернативный НПВП. Использовался клинико-неврологический анализ, оценка боли по ВАШ (средняя интенсивность боли – 5,86), оценка наступления эффективности препаратов через определенные интервалы времени оценивалась больным лично, параллельно проведен анализ побочных явлений терапии. Также регистрировалась интенсивность болевого синдрома по ВАШ, степень ее уменьшения по 10-балльной шкале.
Результаты
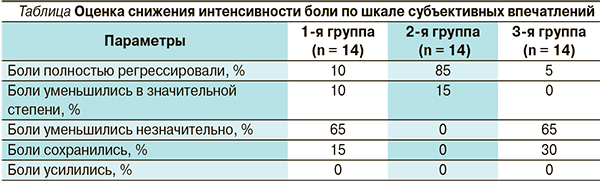
Достоверное снижение интенсивности боли в первой группе отмечено к 25-й минуте (оценка по ВАШ – 4,70 ± 1,94) после приема первой дозы препарата, во второй группе – к 15-й минуте (ВАШ – 5,20 ± 1,96), в третьей группе к – 40-й минуте (ВАШ – 4,5 ± 1,90). Больным также предлагалось оценить обезболивающий эффект препаратов по шкале субъективных впечатлений (см. таблицу).
Выявлено статистически значимое улучшение (р < 0,001), снижение интенсивности болевого синдрома через 10 дней терапии в исследуемых группах. По окончании исследования средние значения оценки боли по ВАШ составили в 1-й группе 3,7 ± 0,4, во второй – 1,5 ± 0,2, в третьей группе – 4,0 ± 0,3 балла.
Среди всех участников исследования у 3 (21 %) пациентов первой, 1 (7 %) второй и 5 (35 %) пациентов третьей групп отмечены нежелательные побочные действия в период лечения и проявились болью в эпигастральной области (2 пациента), изжогой (3 пациент), ощущением горечи во рту (4 пациента). Все нежелательные явления разрешились выздоровлением пациентов в большинстве случаев на момент завершения ими программы исследования.
Анализ вышеизложенных побочных реакций показал, что на догоспитальном этапе больные принимали НПВП по рекомендации фармацевта, опирались на собственный опыт и не только. Применения лекарственных средств для лечения нежелательных явлений не потребовалось.
Обсуждение и заключение
Таким образом, Кетонал является эффективным препаратом лечения болевого синдрома в области шеи. Он превосходит Мовалис и Ортофен по скорости наступления обезболивающего эффекта, что связано с фармакокинетическими особенностями препарата и быстрой всасываемостью.
Полученные показатели динамики анальгетической активности согласуются с данными литературы, которые показывают более быстрое наступление обезболивающего действия Кетонала по сравнению с Ортофеном при цервикокраниалгии. Эффект Кетонала отмечен даже при краткой длительности его применения и достоверно не различается в зависимости от доминирования в клинической картине артропатического или миогенного болевого синдрома и может быть объяснен универсальностью анальгетического действия. Препарат не уступает по анальгетической активности самым эффективным НПВП, позволяет также быстро купировать обострение миофасциального болевого синдрома, что является его несомненным преимуществом перед другими препаратами. С учетом полученных экспериментальных данных а также с учетом особенностей фармакокинетики и фармакодинамики Кетонала можно рекомендовать использовать данный препарат как на догоспитальном этапе, так и для длительных курсов терапии в период стационарного консервативного/хирургического лечения с последующей реабилитацией.
Особо нужно отметить новую форму Кетонала – капсулы Кетонал ДУО 150 мг с модифицированным высвобождением действующего вещества. Каждая капсула содержит два вида пеллет. Первые высвобождают «ударную» дозу препарата 90 мг, которая обеспечивает максимально быстрый и мощный анальгетический эффект, вторая часть пеллет в дозе 60 мг, обеспечивает пролонгированное обезболивание и противовоспалительное действие на протяжении 24 часов. Данная форма уже активно применяется как неврологами, так и ревматологами для в терапии болевых синдромов. Кетонал ДУО также не имеет ограничения по длительности использования, что позволяет продолжить лечение в условиях стационара с параллельным применением комбинированной терапии и физиотерапевтических процедур. Купирование болевого синдрома и воспаления ведет к улучшению физического, психоэмоционального и социального статуса больных, значительно повышая их качество жизни.
Таким образом, мощное противовоспалительное, обезболивающее действие препарата Кетонал позволяет рекомендовать его, как препарат первого выбора при болевых синдромах мышечно-скелетного генеза шейной локализации.


