Исследования состава микробиоценоза желудочно-кишечного тракта (ЖКТ) человека начались более трех столетий назад, когда в 1681 г. голландский исследователь Антони Ван Левенгук впервые сообщил о своих наблюдениях относительно бактерий и других микроорганизмов, обнаруженных в человеческих фекалиях, и выдвинул гипотезу о совместном существовании различных видов бактерий в ЖКТ. В настоящее время отмечается повсеместное возрождение интереса к кишечной микрофлоре, ее влиянию на здоровье и болезни человека. Развитие новых молекулярно-генетических технологий, которые позволяют идентифицировать многочисленные виды бактерий, не поддающихся культивированию, послужили пусковым фактором к углубленному изучению микробиоты человека. Появились новые факты, свидетельствующие о связи кишечного биоценоза с заболеваниями не только ЖКТ, но и сердечно-сосудистой системы, с ожирением, аллергическими и аутоиммунными болезнями [1].
Для изучения состояния микробиоценоза и выявления возможных отклонений от нормального состава микрофлоры ЖКТ определились с понятием нормальной микрофлоры. Нормальная микрофлора – качественное и количественное соотношение в отдельных органах и системах разнообразных популяций микробов, поддерживающих биохимическое, метаболическое и иммунное равновесие макроорганизма, необходимое для сохранения здоровья человека [2]. Для обозначения нормальной микрофлоры высших организмов Т. Rosebury в своей монографии «Microorganisms Indigenous to Man», изданной еще в 1962 г. в Нью-Йорке, предложил название «microbiota», наиболее часто используемое в современной литературе. Характеризуя микробиоту, часто используют термин «биотоп». Под биотопом принято понимать участок слизистой оболочки, кожи или органа макроорганизма с однотипными условиями существования микроорганизмов [3]. С современных позиций нормальную микрофлору человека рассматривают как филогенетически сложившуюся систему множества микробиоценозов, характеризуемых определенным видовым составом и занимающих тот или иной биотоп в организме человека [4]. Общая масса всех микроорганизмов, колонизирующих органы и ткани человека, равняется 3–5 кг.
Микрофлора ЖКТ является наиболее представительной, ее масса у взрослого человека составляет более 2,5 кг, численность – 1014 КОЕ [5]. С учетом новых данных, полученных при исследовании микрофлоры различных биотопов ЖКТ с помощью молекулярно-генетических методов, общий геном бактерий ЖКТ насчитывает 600 тыс. генов, что в 24 раза превышает размер генома человека. Большинство из предполагаемых новых филотипов микроорганизмов являются представителями родов Firmicutes и Bacteroides. Общее число видов приближается к 1500 и требует дальнейшего уточнения [6].
Полость ЖКТ через систему сфинктеров сообщается с внешней средой окружающего нас мира и одновременно через кишечную стенку – с внутренней средой организма. Благодаря этой особенности в полости ЖКТ создалась собственная среда, которую можно разделить на две отдельные ниши: химус и слизистую оболочку. В микроэкологическом плане желудочно-кишечный биотоп может быть разделен на ярусы (ротовая полость, желудок, отделы кишечника) и микробиотопы (полостной и пристеночный).
Полостной микробиотоп на протяжении ЖКТ неоднороден, его свойства определяются составом и качеством содержимого того или иного яруса. Ярусы имеют свои анатомические и функциональные особенности, поэтому их содержимое различается по составу веществ, консистенции, рН, скорости перемещения и другим свойствам. Эти свойства определяют качественный и количественный состав адаптированных к ним полостных микробных популяций. Полостная микрофлора более изменчива, чем мукозная, и чувствительна к различным экзогенным воздействиям.
В связи с этим для формирования оптимальных количественных и качественных параметров полостной микрофлоры большое значение имеет поступление с пищей неперевариваемых пищевых волокон, которые выступают в роли как питательного субстрата, так и матрицы, на которой фиксируются и образуют колонии представители облигатной микрофлоры.
Пристеночный микробиотоп является важнейшей структурой, ограничивающей внутреннюю среду организма от внешней. Он представлен слизистыми наложениями (слизистый гель, муциновый гель), гликокаликсом, расположенным над апикальной мембраной энтероцитов (колоноцитов) и поверхностью самой апикальной мембраны. Пристеночная микрофлора кишечника колонизирует слизистую оболочку в виде микроколоний, образуя своеобразную биологическую пленку, состоящую из микробных тел и экзополисахаридного матрикса. Экзополисахариды микроорганизмов (гликокаликс) защищают микробные клетки от разнообразных физико-химических и биологических воздействий. Слизистая оболочка кишечника также находится под защитой биологической пленки. Между колониями микроорганизмов и кишечной стенкой имеется тесная взаимосвязь, что позволяет их объединять в микробно-тканевой комплекс [7]. Пристеночный микробиотоп представляет наибольший интерес с позиции бактериологии, т. к. именно в нем возникает полезное или вредное для человека взаимодействие с бактериями – то, что мы называем симбиозом. Полостная и пристеночная микрофлора – две взаимосвязанные популяции, между которыми происходит постоянный обмен микроорганизмами, в результате чего формируется индивидуальный вариант нормальной кишечной микрофлоры.
Между кишечной эубиотической микрофлорой и основными функциями ЖКТ существует тесная взаимосвязь: кишечная эубиотическая микрофлора влияет на функции ЖКТ, которые в свою очередь оказывают влияние на эубиоз. В этой взаимосвязи осуществляются сохранение структурной и функциональной целостности слизистой оболочки; моторная активность, обеспечивающая перемещение субстрата по ЖКТ; трансформация пищевых полимеров путем липолиза и гидролиза; транспорт питательных веществ через слой слизистых наложений; регуляция пищеварительного процесса с помощью субстратного и нейроэндокринного механизмов; защита организма от агрессии чужеродных антигенов; поддержание эубиоза и сохранение качественных и количественных констант популяционного равновесия кишечного микробиоценоза [8].
Одним из заболеваний, которое, как доказали многочисленные исследования последних лет, сопровождается изменениями микробиоценоза ЖКТ, является синдром раздраженного кишечника (СРК). Согласно Римскому Консенсусу-III по функциональным пищеварительным расстройствам, СРК является функциональным заболеванием кишечника, при котором боль в животе или абдоминальный дискомфорт связаны с дефекацией, изменениями частоты и характера стула. В зависимости от симптоматики СРК подразделяют на три формы: с преобладанием диареи, с преобладанием запора и смешанную, для которой характерно чередование запора и поноса [9]. Способность кишечной микрофлоры вырабатывать нейротрансмиттеры, влияющие на энтериновую систему и тем самым изменяющие секрецию и моторику кишечника, а также порог висцеральной чувствительности, свидетельствует о важности дисбиотических изменений в патогенезе CPK [10, 11].
Известно, что состав микрофлоры фекалий отличается от такового слизистой оболочки кишечника. Но каков характер этих отличий и имеет ли значение клиническая форма заболевания, особенность моторной дисфункции кишечника, неизвестно. С учетом вышеизложенного нам показалось актуальным и интересным изучить состав пристеночной микрофлоры прямой кишки здоровых лиц и больных СРК; провести сравнительную оценку состава микрофлоры полостного и пристеночного микробиотопа прямой кишки пациентов СРК методом полимеразной цепной реакции в режиме реального времени (ПЦР-РВ).
Материал и методы
Для решения поставленных задач отобраны 40 пациентов с СРК: у 20 – диагностирован СРК с преобладанием диареи (СРК-Д), у 20 – СРК с преобладанием запоров (СРК-З). Диагноз заболевания основывался на диагностических критериях, разработанных Римским Консенсусом-III по функциональным пищеварительным расстройствам. Мужчины составили 62,5 %, средний возраст пациентов – 39,6 ± 8,0 лет. В группу контроля (ГК) вошли 14 здоровых добровольцев нормального питания в возрасте от 19 до 50 лет (11 мужчин и 3 женщины). Обязательным условием включения в группу исследуемых было письменно оформленное каждым пациентом и здоровым субъектом информированное согласие. От здоровых лиц и отобранных пациентов при фибросигмоскопии получены образцы биоптатов слизистой оболочки прямой кишки, у пациентов собраны фекальные образцы, которые были заморожены для проведения в последующем молекулярного анализа методом ПЦР-РВ.

ПЦР-диагностика исследуемых образцов производилась с использованием амплификатора ДТ96 (НПО «ДНК-Технология», Россия), обеспечивающего проведение ПЦР с автоматической регистрацией результатов в режиме «реального времени». Набор реагентов включил смесь для ПЦР-амплификации, специфичную для всех бактерий (общая бактериальная масса), специфичные смеси для определяемых микроорганизмов. В одну из пробирок со смесью для амплификации был добавлен внутренний контрольный образец, предназначенный для оценки эффективности протекания ПЦР. Одна из пробирок содержала смесь для амплификации геномной ДНК человека, предназначенная для оценки контроля взятия клинического материала.
В исследуемых образцах методом ПЦР-РВ определены следующие показатели: контроль взятия материала (КВМ), общая бактериальная масса (ОБМ), абсолютные значения микроорганизмов, с последующим расчетом относительных показателей. Абсолютные значения показателей ОБМ, КВМ и диагностируемых микроорганизмов в результатах ПЦР-РВ были представлены в виде десятичного логарифма (lg), рассчитанного по номеру порогового цикла, и ориентировочно соответствовали количеству искомой ДНК, выраженной в геном-эквивалентах в образце (ГЭ/обр). Для более объективного анализа рассчитаны относительные количественные показатели микробиоты, отразившие количество конкретных микроорганизмов по отношению к общей бактериальной массе. Относительные показатели были представлены в виде разницы десятичных логарифмов соответствующей группы микроорганизмов и общей бактериальной массы.
В образцах были идентифицированы 27 групп бактерий основных четырех филотипов (Firmicutes, Bacteroidetes, Proteobacteria, Actinobacteria) (табл. 1).
Статистическая обработка данных произведена на персональном компьютере с использованием лицензионных компьютерных программ Microsoft Excel 2007 и «SPSS-Statistics 17». При анализе распределений количественных данных определены меры центральной тенденции – медиана (Ме), и меры дисперсии – интерквартильный размах в виде 25 и 75 % процентилей. Для расчета достоверности различий малых выборок использован непараметрический критерий Манна–Уитни. Критерием статистической значимости был уровень p ≤ 0,05.
Результаты исследования и обсуждение
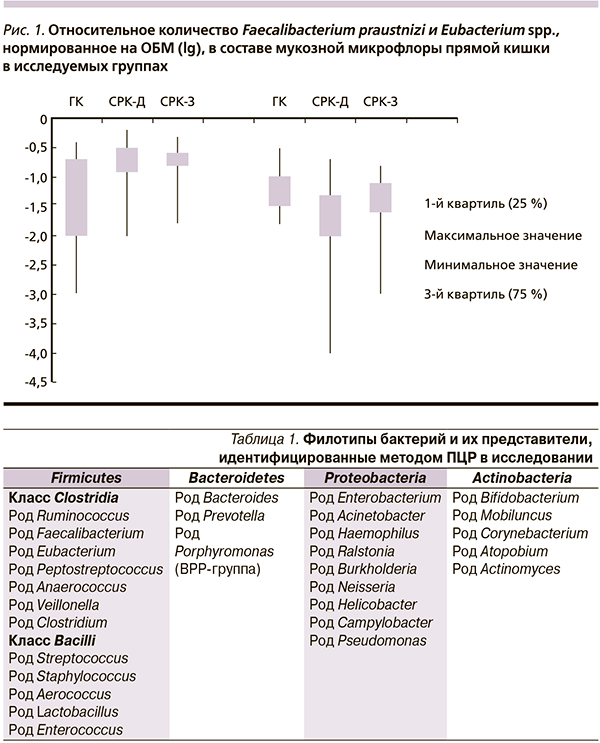
На первом этапе работы проведен сравнительный анализ микрофлоры слизистой оболочки прямой кишки здоровых добровольцев и больных СРК-Д и СРК-З. Прежде всего обращает на себя внимание увеличение общей бактериальной обсемененности слизистой оболочки прямой кишки при обеих клинических формах СРК. Статически значимыми оказались различия при СРК-З – ОБМ – 6,0 (5,6; 6,5) lg ГЭ/обр. по сравнению с груп-пой контроля – ОБМ – 5,2 (4,0; 5,6) lg ГЭ/обр. (р = 0,002).
При СРК вне зависимости от клинической формы в мукозной микрофлоре прямой кишки по сравнению с ГК обнаружено повышенное содержание Faecalibacterium praustnizi: при СРК-З (р = 0,047), СРК-Д (р = 0,05). У больных СРК-Д по сравнению с ГК оказалась ниже концентрация Eubacterium spp. (р = 0,049) (рис. 1).
Для установления связи между максимальной частотой стула в сутки при СРК-Д и концентрацией эубактерий в слизистой оболочке прямой кишки был проведен корреляционный анализ этих показателей. Установлено, что максимальное количество дефекаций в день отрицательно коррелирует с концентрацией эубактерий в слизистой оболочке прямой кишки (-0,47; р < 0,05), т. е. учащение стула сопровождается снижением содержания данных микроорганизмов в слизистой оболочке прямой кишки.
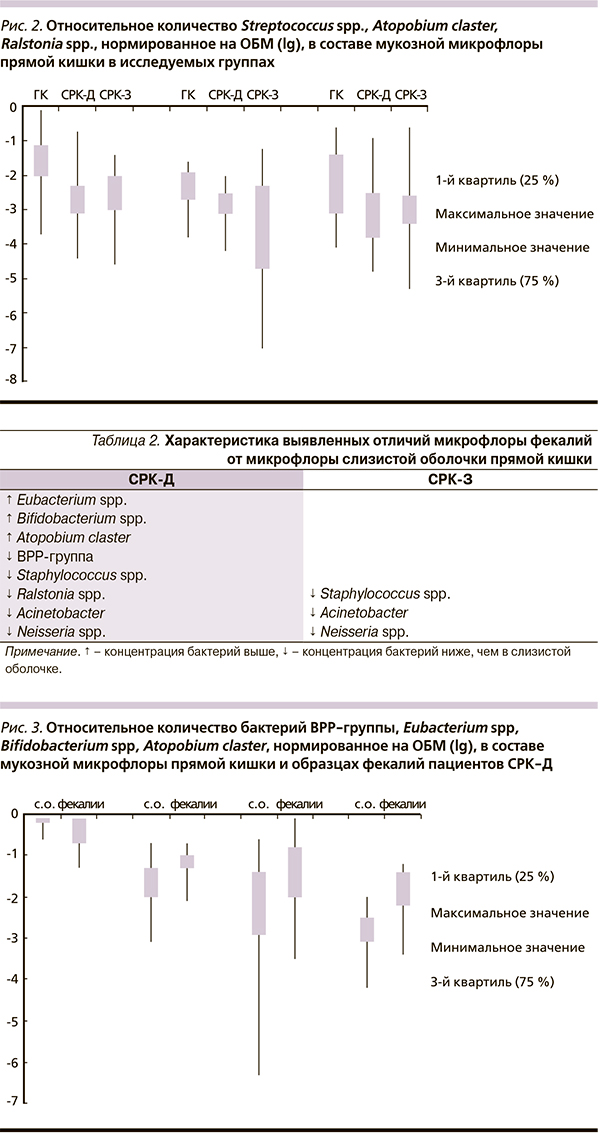
При обеих клинических формах СРК достоверно ниже, чем в ГК, оказались концентрации Streptococcus spp. (СРК-Д, р = 0,003; СРК-З, р = 0,003), Atopobium claster (СРК-Д, р = 0,028; СРК-З, р = 0,023), Ralstonia spр. + Burkholderia spр. (СРК-Д, р = 0,034; СРК-З, р = 0,002) (рис. 2).
Только при СРК-З оказалась ниже концентрация Staphylococcus spp. + Aerococcus spp. (р = 0,039), Acinetobacter (р = 0,009).
Таким образом, при обеих формах СРК по сравнению с ГК выявлены различия в составе мукозной микрофлоры прямой кишки: повышение концентрации бактерий семейства Ruminococcaceae, снижение концентрации ряда бактерий 3 ведущих филотипов (Firmicutes (класса Bacilli), Proteobacteria, Actinobacteria). Если причину снижения концентрации аэробов при СРК-З объяснить пока затруднительно, то снижение Eubacterium spp. при СРК-Д можно связать с известным участием этих микроорганизмов в деконъюгации желчных кислот и, соответственно, влиянием их на моторную функцию кишечника. Кроме того, большинство видов Eubacterium являются сахаролитическими, т. е. способными ферментировать углеводы с накоплением смеси короткоцепочечных жирных кислот, которые, являясь важным питательным веществом, необходимым для поддержания здоровья колоноцитов, участвуют в регуляции апоптоза, пролиферации эпителия слизистой оболочки кишечника, стимулируют всасывание воды и электролитов, тем самым предотвращая диарею. Соответственно, одним из звеньев патогенеза СРК-Д может оказаться уменьшение продукции короткоцепочечных жирных кислот вследствие снижения концентрации Eubacterium spp. в составе мукозной микрофлоры толстой кишки.
Вторым этапом работы было проведение сравнительного анализа состава пристеночной и полостной микробиоты прямой кишки больных СРК с запором и диареей. В результате сравнительного анализа обнаружены следующие статистически значимые различия: при СРК-Д в составе микрофлоры фекалий по сравнению с микрофлорой слизистой оболочки прямой кишки оказалось достоверно ниже содержание бактерий ВРР-группы (p < 0,05); Staphylococcus spp. + Aerococcus spp. (p < 0,01); Ralstonia spp. + Burkholderia spp. (p < 0,001); Acinetobacter (p < 0,001); Neisseria spp. (p < 0,01). Кроме бактерий ВРР-группы, являющихся строгими анаэробами, все остальные микроорганизмы относятся к группе аэробов или факультативных анаэробов. Достоверно выше, чем в составе микрофлоры слизистой оболочки, в составе микрофлоры фекалий оказалось содержание Eubacterium spp. (p < 0,05); Bifidobacterium spp. (р < 0,05); A. claster (p < 0,001). Увеличение концентрации этих микроорганизмов в просветной микрофлоре, возможно, отражает избыточное выведение (потерю) данных микроорганизмов вследствие гипермоторной дисфункции кишечника при СРК-Д и характеризует их адгезивные свойства.
При СРК-З выявлено меньше различий: в фекальной микрофлоре оказалось достоверно ниже содержание Staphylococcus spp. + Aerococcus spp. (p < 0,05); Acinetobacter (p < 0,001); Neisseria spp. (p < 0,001). Наглядно выявленные различия отражены в табл. 2.
Таким образом, наиболее выраженные различия в составе фекальной и мукозной микрофлоры обнаружены при СРК-Д среди как облигатных анаэробов (рис. 3), так и аэробов (рис. 4).
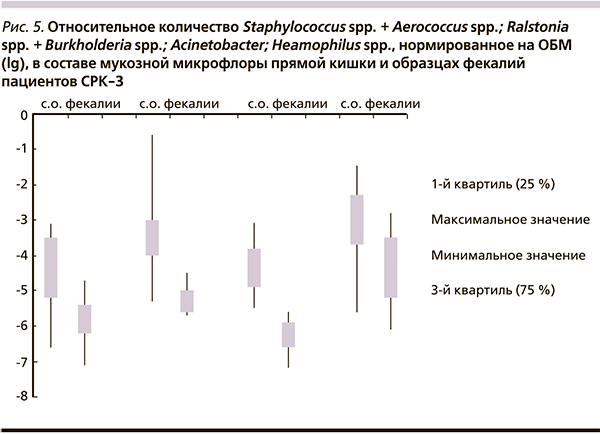
При СРК-З различия в составе фекальной и мукозной микрофлоры прямой кишки обнаружены только в группе аэробов (рис. 5).
Суммируя полученные данные, можно сделать следующий вывод: при СРК-З композиция фекальной микрофлоры отражает состав микрофлоры слизистой оболочки прямой кишки по ведущим группам микроорганизмов, не считая отдельных групп аэробов, содержание которых в кале ничтожно мало. При СРК-Д различия в составе фекальной и мукозной микрофлоры более выражены, в т. ч. среди облигатных микроорганизмов, поэтому оценка микроэкологии кишечника при данной клинической форме СРК не может производиться на основании композиции микрофлоры фекалий. Выявленные различия в составе микрофлоры слизистой оболочки прямой кишки и фекалий позволяют предположить, что и пристеночный, и полостной микробиотопы выполняют каждый свою роль в поддержании микроэкологии ЖКТ.
Заключение
Таким образом, у больных СРК вне зависимости от клинической формы слизистой оболочки прямой кишки имеются достоверные количественные отличия от группы контроля среди бактерий филотипов Firmicutes, Proteobacteria, Actinobacteria: повышено содержание F. praustnizi; понижена концентрация Streptococcus spp., A. claster, Ralstonia spр. + Burkholderia spр.
В составе полостного и пристеночного микробиотопов прямой кишки при СРК-З и СРК-Д имеются статистически значимые различия в разных группах микроорганизмов: при СРК-Д они обнаружены среди как облигатных анаэробов, так и аэробов; тогда как при СРК-З различия обнаружены только в группе аэробов.
Полимеразная цепная реакция в режиме реального времени является достоверным и высокоспецифичным методом диагностики нарушений микробиоценоза ЖКТ у больных СРК. Для адекватной оценки микробиоценоза при СРК с запором достаточно проведения исследования фекальной микрофлоры данным методом. Обнаруженные изменения в составе пристеночной и полостной микробиоты прямой кишки при синдроме раздраженного кишечника обосновывают необходимость дальнейших углубленных исследований современными молекулярно-генетическими методами и позволяют продолжить изучение роли про- и пребиотиков в поддержании здорового микробиоценоза желудочно-кишечного тракта человека. С учетом выявленных изменений в составе микрофлоры слизистой прямой кишки при синдроме раздраженного кишечника, в схемы лечения данного функционального расстройства целесообразно включать пробиотики, содержащие Streptococcus spp.
Состав биологической активной добавки РиоФлора Иммуно Нео отвечает заявленным требованиям. Пробиотический мультиштаммовый комплекс РиоФлора Иммуно Нео содержат сбалансированную комбинацию 9 штаммов различных пробиотиков: Streptococcus thermophilus W69, Bifidobacterium longum W108, Lactobacillus acidophilus W22, Lactobacillus plantarum W21, Lactobacillus paracasei W20, Lactobacillus salivarius W24, Bifidobacterium lactis W51, Bifidobacterium lactis W52 и Lactococcus lactis W19. Входящие в состав РиоФлора Иммуно Нео пробиотические микроорганизмы поддерживают колонизационную резистентность, ферментативную, антитоксическую, иммунную, метаболическую функции толстой кишки, участвуют в синтезе аминокислот и витаминов. Капсула защищает пробиотические бактерии от агрессивной среды желудочных ферментов и желчи. Безопасность пробиотических штаммов и их положительные клинические эффекты доказаны в результате контролируемых научных клинических исследований.
Лечение синдрома раздраженного кишечника представляет собой большой комплекс как медикаментозных, так и немедикаментозных мероприятий. Наряду с нормализацией нервно-психического статуса, моторной дисфункции, коррекция дисбиоза является важной составной частью комплексной терапии синдрома раздраженного кишечника. Препаратом выбора в данном случае может явиться мульти-штаммовый пробиотический комплекс РиоФлора Иммуно Нео.


