Профилактика тромбозов – одна из самых актуальных проблем травматологии. Свидетельством тому служит удручающая статистика смертности от этих осложнений и как следствие – огромные силы и средства, направленные на предотвращение последних [1–3].
В настоящее время в клинической практике с целью профилактики и лечения тромбоэмболических осложнений используют 4 класса антитромботических препаратов: 1 – прямые антикоагулянты (в т. ч. гепарин); 2 – непрямые антикоагулянты (ингибиторы тромбина, воздействующие на витамин-К-зависимые факторы свертывания); 3 – антиагреганты (препараты, воздействующие на адгезию и агрегацию тромбоцитов – нестероидные противовоспалительные средства, клопидогрел), 4 – тромболитические препараты (средства, активирующие фибринолитическую систему через преобразование плазминогена в плазмин) [4–6]. Традиционно в стационарах с целью предупреждения тромбозов используют гепаринотерапию [7, 8]. В химическом отношении гепарин является представителем сульфатированных мукосахаридов – гликозаминогликанов. В организме он синтезируется в тучных клетках, в секреторных гранулах которых гепарин находится в ковалентно связанном состоянии с белками. При его высвобождении из тучных клеток происходит деградация этой связи и в кровоток поступает смесь гепариновых фрагментов различной молекулярной массы [9]. Уникальное химическое строение гепарина обусловливает его растворимость в водных и жировых средах. Такие свойства способствовали расширению спектра антитромботических средств на основе гепарина, используемых, в частности, местно. Таким средством направленного действия является гель Лавенум® для наружного применения 1000 МЕ/г (ОАО «Синтез», Курган; Россия).
Материал и методы
На проведение исследований было получено разрешение Комитета по этике при ФГУ РНЦ «ВТО им. акад. Г.А. Илизарова» Минздрава РФ. Нами были обследованы 12 пациентов с закрытыми переломами костей верхних и нижних конечностей (плечо, предплечье, бедро, голень). Из них 6 пациентам (23–59 лет, средний возраст – 50 ± 13 лет) на 2-й день после операции на область подкожного кровоизлияния или гематомы наносили гель Лавенум® в течение 14 дней с периодичностью 2–3 раза в сутки. Шесть пациентов (27–56 лет, средний возраст – 47 ± 5 лет) составили группу контроля. Все пациенты были пролечены по методикам центра с применением аппарата Илизарова. До начала исследований всем больным проведены необходимые клинические и лабораторные обследования. Согласно критериям включения, в группу лиц, проходивших исследования, были включены испытуемые с нормальной функцией экскреторных органов. По критериям исключения в исследования не включены беременные женщины, лица с аллергическими заболеваниями, тучные и истощенные люди.
Всем пациентам произвели общеклиническое исследование, осмотр конечности, ультразвуковое исследование (УЗИ) вен нижних конечностей на аппарате VOLUSON-730 PRO (Швеция). Субъективную симптоматику оценили с помощью анкеты, куда были включены следующие вопросы: возникновение спонтанных болей, болезненность при пальпации по ходу вен, наличие отека, ограничение функции конечности, ощущение «тяжести» в пораженной конечности, парестезии и судороги, наличие эритемы, общее состояние кожных покровов, кожный зуд. Каждый параметр оценивали по 10-балльной шкале. Кроме того, всем больным до и после применения средства Лавенум® выполняли в динамике клинический и биохимический анализы крови. Биохимическое исследование сыворотки крови включило определение активности маркеров мышечного повреждения – лактатдегидрогеназы (ЛДГ) и креатинфосфокиназы (КК), а также определение концентрации недоокисленных продуктов энергообмена – молочной (МК) и пировиноградной (ПВК) кислот.
Активность ферментов, концентрация молочной кислоты определены на автоматическом анализаторе «BM/Hitachi 902» (Австрия) с использованием наборов реактивов фирмы «Vital Diagnostic» (Россия). Содержание ПВК в сыворотке определены по реакции с 2,4-динитрофенилгидразином. Исследование коагуляционного звена гемостаза проведено на коагулометре «STart 4» (Diagnostica Stago, фирма «Roche», Германия). Для контроля активности реактивов ежедневно использовали донорскую контрольную плазму. Определение физиологических антикоагулянтов проведено с использованием хромогенного субстрата («Хромотех-антитромбин», «Технология-Стандарт», Барнаул; Россия) на биохимическом фотометре «Stat Fax® 1904 Plus» (США).
В качестве маркеров активации процесса свертывания крови определены растворимые фибрин-мономерные комплексы (РФМК) – ортофенантролиновый тест (по Елыкомову и Момоту, 1996).
Использованы наборы фирмы «Технология-Стандарт» (Барнаул, Россия). Гематологические исследования показателей периферической крови осуществлены в соответствии с требованиями клинико-гематологического обследования (Тодоров Й., 1969).
Для определения значимости различий между группами использован непараметрический W-критерий Вилкоксона для связанных выборок. Достоверность межгрупповых различий (множественное сравнение) определена с помощью непараметрического H-критерия Крускала–Уоллиса с последующим применением Q-критерия Данна. Результаты в таблицах представлены в виде средней, ошибки средней, медианы, 25-го и 75-го процентилей.
Результаты и их обсуждение
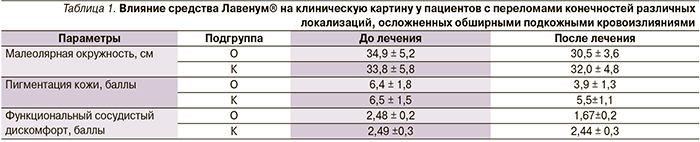
После травмы и в первые сутки после операции ткани поврежденного сегмента конечностей всех пациентов сопровождались отеками, подкожными кровоизлияниями, гематомами различной степени интенсивности и выраженным болевым синдромом поврежденной конечности. В опытной подгруппе в отличие от контрольной уже на 3–4-й день применения геля пациенты отмечали уменьшение болевого синдрома поврежденной конечности, уменьшение отека и размеров подкожного кровоизлияния, гематом, а также их интенсивности (см. рисунок).
Клинически исчезновение подкожных кровоизлияний и гематом в опытной группе наступило на 21–28-е сутки после операции, тогда как в контрольной группе изменения со стороны кожи, ощущение тяжести, боли и онемения сохранялись в течение 30–40 дней (табл. 1).
Результаты определения показателей красной крови и лейкоцитарной формулы пациентов с переломами конечностей различных локализаций, осложненных обширными подкожными кровоизлияниями, в опытной и контрольной подгруппах достоверно не различались (табл. 2, 3).
На фоне проводимой терапии препаратом Лавенум® показатели гемостаза до и после лечения в опытной и контрольной подгруппах достоверно различались. Изменения свертывающей системы крови затрагивали количество фибриногена и активность антитромбина III в опытной подгруппе (табл. 4).
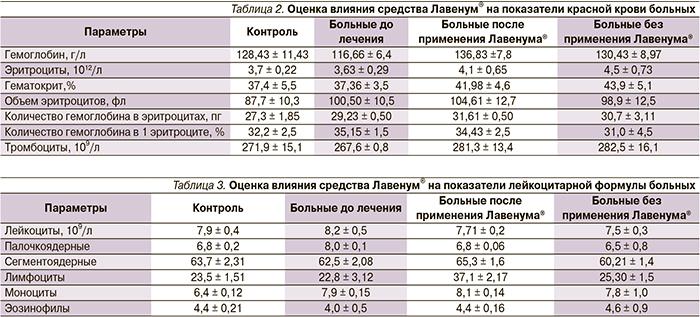
Результаты биохимических исследований показали, что у пациентов опытной и контрольной подгрупп в сыворотке крови относительно нормы были достоверно повышены значения активности КК, концентрации МК и произведения МК × ПВК (табл. 5).
Статистически значимых отличий между подгруппами перед началом исследования не обнаружено. После окончания приема препарата у пациентов опытной подгруппы в сыворотке крови относительно исходных значений происходило достоверное снижение активности КК, концентрации МК, ПВК и их произведения.
В контрольной подгруппе за аналогичное время происходило снижение концентрации МК, ПВК и коэффициента МК × ПВК. При этом значение МК в контрольной подгруппе, хотя и снижалось относительно исходных значений, относительно нормы оно оставалось повышенным, чего не наблюдалось в опытной подгруппе. Кроме того, активность КК у пациентов, не применявших препарат за время исследования, изменялась незначительно, оставаясь к концу наблюдения достоверно выше нормы, чего также не наблюдалось среди пациентов, применявших препарат, в результате чего средние показатели активности КК у пациентов опытной подгруппы были значимо ниже уровня фермента у пациентов контроля (р = 0,02).
Полученные данные демонстрируют, что применение геля Лавенум® пациентами с переломами конечностей различных локализаций, осложненных обширными подкожными кровоизлияниями, в посттравматическом периоде вызывало нормализацию обменных процессов в тканях поврежденного сегмента конечности, о чем свидетельствовало более значительное снижение уровня недоокисленных продуктов обмена (МК и ПВК) в сыворотке крови испытуемых опытной группы. Такие изменения способствовали раннему восстановлению метаболизма скелетных мышц и их целостности у пациентов, использовавших гель, в пользу чего говорило существенное снижение у них активности КК к концу исследования.
Данные проведенных биохимических исследований согласовались с данными УЗИ мягких тканей пораженной конечности. УЗИ проведено через 2 дня после операции и затем через 10 дней после использования препарата. При сканировании мягких тканей датчик установили непосредственно над областью подкожного кровоизлияния. За эталон (контрольный срез) принят аналогичный участок на контралатеральной конечности. Проведена качественная оценка исследуемого участка тканей: однородность, четкость контуров и количественная оценка; определен показатель эхоплотности (ПЭХ, усл. ед.) всего исследуемого участка или выбрана зона наибольшего интереса. ПЭХ измерен при постоянной стандартной настройке аппарата путем автоматического построения гистограмм. Для оценки мягких тканей в зависимости от требуемого уровня среза больной находился в положении лежа на спине, на животе и на боку, при переднем, боковом и заднем доступах с учетом анатомических ориентиров каждой проекции.
При сканировании зоны с подкожным кровоизлиянием до применения геля Лавенум® в обеих группах пациентов было выявлено увеличение ПЭХ подкожного слоя, которое сопровождалось полным нарушением дифференцировки слоев дермы, увеличением толщины дермы и неровностью ее контура. Таким образом, по данным УЗИ, применение препарата Лавенум® пациентами с переломами конечностей различных локализаций, осложненными обширными подкожными кровоизлияниями, уже в первые 2–3 дня снижает проявления подкожных кровоизлияний.
Полученный положительный эффект применения геля Лавенум® в плане быстрого купирования гематом, отеков, болевого синдрома влиял на скорость репаративного остеогенеза, что приводило к сокращению сроков фиксации в аппарате у пациентов опытной подгруппы относительно контрольной в среднем на 7–10 дней.
Таким образом, гель Лавенум® обладает высокой клинической эффективностью и может применяться в качестве лечения лиц с травмами конечностей, сопровождающимися обширными гематомами. Достоверно улучшает показатели микроциркуляции и обмена энергетических субстратов в тканях нижних конечностей, уменьшает выраженность гиперемии и отека нижних конечностей, способствует раннему восстановлению целостности поврежденных мягких тканей, особенно скелетных мышц.


