Артериальная гипертензия (АГ) в Российской Феде-рации (РФ), как и во всех странах с развитой экономикой, является одной из актуальных медико-социальных проблем. Это обусловлено широкой распространенностью, высоким риском развития осложнений и недостаточным контролем в масштабе популяции. Распространенность АГ среди взрослого населения составляет примерно 40 %, что предопределяет высокую частоту возникновения сердечно-сосудистых осложнений (ССО), в т. ч. с летальным исходом [1, 2]. Артериальная гипертензия является ведущим фактором высокой смертности населения от заболеваний сердечно-сосудистой системы, в 3–4 раза увеличивая риск развития ишемической болезни сердца (ИБС) и инсульта [3, 4].
По результатам исследования, проведенного в рамках целевой федеральной программы “Профилактика и лечение артериальной гипертонии в Российской Федерации”, распространенность АГ среди населения в 2009 г. составила 40,8 % (у мужчин – 36,6 %, у женщин – 42,9 %). Осведомленность больных АГ о наличии у них заболевания составляет 83,9–87,1%. Принимают антигипертензивные препараты (АГП) 69,5 % больных АГ, из них эффективно лечатся 27,3 %, а контролируют артериальное давление (АД) на целевом уровне 23,2 % [5].
Основной целью лечения больных АГ является максимальное снижение риска развития ССО и смерти от них. Для достижения этой цели требуются снижение АД до целевого уровня, коррекция всех модифицируемых факторов риска (курение, нарушение липидного обмена, гипергликемия, ожирение), предупреждение, замедление темпа прогрессирования и/или уменьшение поражения органов-мишеней, а также лечение ассоциированных и сопутствующих заболеваний (ИБС, сахарного диабета – СД и др.).
В рекомендациях Всероссийского научного общества кардиологов [6] отмечено, что целевой уровень АД должен быть менее 140/90 мм рт. ст., а при хорошей переносимости назначенной терапии целесообразно снижение АД до более низких значений.
Пациентам с высоким и очень высоким риском ССО необходимо снижать АД до 140/90 мм рт. ст. и менее в течение 4 недель. При условии хорошей переносимости рекомендуется дальнейшее снижение АД до 130–139/80–89 мм рт. ст. При проведении антигипертензивной терапии следует иметь в виду, что пациентам с СД, пожилым больным и лицам, уже имеющим ССО, бывает трудно достичь уровня систолического АД < 140 мм рт. ст. При плохой переносимости снижения АД рекомендуется достижение целевого уровня АД в несколько этапов. На каждом этапе АД снижают на 10–15 % от исходного уровня за 2–4 недели с последующим перерывом для адаптации пациента к более низким величинам АД. Следующий этап снижения АД и, соответственно, усиление антигипертензивной терапии (а именно увеличение дозы и/или числа принимаемых препаратов) возможны только при условии хорошей переносимости уже достигнутых величин АД. Если переход на следующий этап вызывает ухудшение состояния пациента, целесообразно вернуться на предыдущий уровень еще на некоторое время.
Таким образом, снижение АД до целевого уровня происходит в несколько этапов, число которых индивидуально и зависит как от исходного уровня АД, так и от переносимости антигипертензивной терапии. Использование такой этапной схемы снижения АД с учетом индивидуальной переносимости, особенно пациентами с высоким и очень высоким риском ССО, позволяет достигать целевого уровня АД и избегать эпизодов гипотонии, с которыми связано увеличение риска развития инфаркта миокарда и мозгового инсульта. При достижении целевого уровня АД необходимо учитывать нижнюю границу снижения САД до 110–115 и ДАД до 70–75 мм рт. ст., а также следить за тем, чтобы в процессе лечения не происходило увеличения пульсового АД у пожилых пациентов, что возникает главным образом за счет снижения ДАД [6].
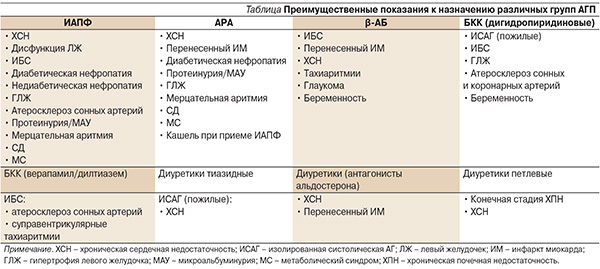
В настоящее время для лечения АГ рекомендовано пять основных классов АГП: ингибиторы ангиотензинпревращающего фермента (ИАПФ), антагонисты рецепторов ангиотензина II (АРА), блокаторы кальциевых каналов (БКК), β-адреноблокаторы (β-АБ), диуретики (см. таблицу). В качестве дополнительных классов для комбинированной терапии могут использоваться α-АБ, агонисты имидазолиновых рецепторов и прямые ингибиторы ренина.
При выборе препарата врач должен учитывать многие факторы, наиболее важными из которых являются наличие у больного факторов риска; поражение органов-мишеней; ассоциированные клинические состояния, поражения почек, МС, СД и другие сопутствующие заболевания, ограничивающие применение АГП:
- предыдущие индивидуальные реакции больного на препараты различных классов;
- вероятность взаимодействия с лекарствами, которые пациенту назначены по другим поводам;
- социально-экономические факторы, включая стоимость лечения.
При выборе АГП в первую очередь необходимо оценить эффективность, вероятность развития побочных эффектов и преимущества лекарственного средства в определенной клинической ситуации. Из результатов многоцентровых рандомизированных исследований следует, что ни один из основных классов АГП не имеет существенного преимущества в плане как снижения АД, так и эффективности снижения риска ССО и смерти от них. При назначении любого из основных классов АГП есть свои «за» и «против».
В каждой конкретной клинической ситуации необходимо учитывать особенности действия АГП различных классов, обнаруженные при проведении рандомизированных исследований. Выбор того или иного АГП должен основываться на результатах больших клинических исследований, в которых доказана высокая эффективность и безопасность применения пациентами именно этого препарата в подобной клинической ситуации.
Однако рекомендуемые стандарты и программы лечения АГ не всегда учитывают состояние органов пищеварения, хотя метаболизм многих лекарственных средств начинается и осуществляется именно там. По данным ЦНИИГ за три года (1999–2001), в гепатологических отделениях были обследованы и пролечены 1200 больных циррозом печени (ЦП), среди них гипертоническая болезнь I–III стадий встречалась среди 18,4 % больных (практически у каждого 5-го больного ЦП имелась АГ).
Все группы лекарственных препаратов, применяющихся в лечении АГ, оказывают различное влияние на органы пищеварения. Это могут быть положительные эффекты. Например, использование β-АБ для профилактики кровотечения из варикозно-расширенных вен пищевода при ЦП, БКК при ахалазии кардии. Известно и отрицательное действие кардиологических препаратов: эрозивно-язвенное поражение желудка при применении ацетилсалициловой кислоты, усиление проявлений гастроэзофагеальной рефлюксной болезни на фоне приема БКК (группы дигидропиридинов). В связи с этим необходима рациональная фармако-, а иногда и многоцелевая монотерапия (возможность использовать системные эффекты одного лекарства для одновременной коррекции нарушенных функций нескольких органов или систем).
У больных хроническими заболеваниями печени жирорастворимые препараты могут кумулироваться, вызывая нежелательные эффекты, тогда как концентрация водорастворимых средств у пациентов без гепаторенального синдрома остается близкой к стандартной [7–9]. При заболеваниях печени пролекарства в рекомендуемых дозах не могут оказывать достаточного гипотензивного эффекта больным АГ, и для достижения целевого уровня АД требуется увеличение разовых и суточных доз препарата. Поэтому при лечении АГ у лиц с патологией органов пищеварения необходимо учитывать все фармакологические особенности антигипертензивных препаратов различных групп.
Тиазидные и тиазидоподобные диуретики подразделяются на два поколения. Первое включает производные бензотиадиазина (гидрохлоротиазид) и хлорталидон, второе поколение – производные хлорбензамида (индапамид). Тиазидные диуретики слабо метаболизируются в печени и почти полностью выводятся почками в неизменном виде. В отличие от тиазидных диуретиков индапамид подвергается метаболизму в печени, поэтому с осторожностью должен применяться при лечении больных АГ с патологией печени. Строгий контроль показан больным ЦП, особенно с отеками или асцитом, т. к. повышается риск развития метаболического алкалоза и возможно усиление проявлений печеночной энцефалопатии.
С другой стороны, длительный прием диуретиков пациентами с дефицитом магния из-за нарушения его всасывания (рвоты, диареи, алкогольного поражения печени, резекции кишечника) может приводить к гипомагниемии, при которой уровень магния в сыворотке крови опускается ниже 0,75 ммоль/л. В связи с этим при лечении диуретиками необходим контроль уровня магния в крови при данных сопутствующих заболеваниях.
Ко второй группе АГП относятся БКК, которые являются вазодилататорами непрямого действия. Общее свойство БКК – липофильность, объясняющая их хорошую всасываемость (90–100 %) в желудочно-кишечном тракте (ЖКТ), и единственный путь элиминации из организма – метаболизм в печени. В печени БКК полностью метаболизируются до неактивных метаболитов, которые выводятся через почки и ЖКТ. Этими общими фармакокинетическими свойствами БКК объясняется замедление их выведения из организма с возрастом, при дисфункции печени, но практически не изменяется при почечной недостаточности. Поэтому лицам старше 60–65 лет и больным ЦП разовую дозу или кратность приема БКК рекомендуется уменьшать.
С другой стороны, БКК снижают тонус нижнего пищеводного сфинктера [10, 11]. При нарушении функции нижнего пищеводного сфинктера отсутствует полноценный барьер для рефлюкса кислого содержимого желудка в пищевод, что может обусловливать развитие эзофагита. Так как заброс кислого желудочного содержимого в пищевод может вызывать кровотечение из варикозно-расширенных вен (желудочно-пищеводный рефлюкс особенно опасен для больных ЦП), применение дигидропиридинов нежелательно при ЦП, осложненном варикозным расширением вен пищевода [12].
К третьей группе АГП относятся β-АБ, которые в зависимости от их растворимости в жирах и воде подразделяются на жирорастворимые (или липофильные), водорастворимые (гидрофильные) и жироводорастворимые. Липофильные β-АБ (бетаксолол, карведилол, метопролол, пропранолол, тимолол, небиволол и др.) быстро и полностью (более 90 %) всасываются в ЖКТ, обычно метаболизируются в печени (80–100 %) [13–15].
В печени они подвергаются метаболизму путем гидроксилирования и конъюгирования, превращаясь в метаболиты, которые эскретируются почками после превращения в водорастворимые вещества. У больных ЦП со сниженным печеночным кровотоком и печеночно-клеточной недостаточностью данные препараты способны к кумуляции в организме, т. к. они находятся в крови более продолжительное время из-за уменьшения активности печеночных ферментов, обусловливая большую частоту побочных эффектов [16–20]. По этой причине разовые дозы или кратность приема липофильных β-АБ необходимо уменьшать для лиц со сниженным печеночным кровотоком (т. е. для пожилых лиц, больных сердечной недостаточностью или ЦП).
Гидрофильные β-АБ (атенолол, надолол, соталол и др.) неполностью (30–70 %) и неравномерно всасываются в ЖКТ и обычно незначительно (0–20 %) метаболизируются в печени, а следовательно, не требуют изменения дозы и поэтому могут использоваться для лечения больных АГ с патологией печени. При применении метопролола больным ЦП необходимо снижать дозу препарата во избежание кумулятивных эффектов и связанных с ним побочных эффектов. Использование гидрофильного атенолола коррекции дозы не требует [21].
Некоторые препараты растворяются как в жирах, так и в воде (ацебутолол, бисопролол, пиндолол) и имеют два пути элиминации – печеночный метаболизм и почечную экскрецию. Такой сбалансированный клиренс данных β-АБ обусловливает безопасность при лечении больных АГ с сопутствующей патологией печени и низкую вероятность их взаимодействия с препаратами, тормозящими активность микросомальных ферментов печени.
С другой стороны, β-АБ способны оказывать многообразное воздействие на функции органов пищеварения.
В частности, они уменьшают кровоток по печеночной и мезентериальным артериям, повышают тонус нижнего сфинктера пищевода, усиливают перистальтику пищевода, желудка и кишечника. Основанием к применению β-АБ при гастроэзофагеальном рефлюксе и грыже пищеводного отверстия диафрагмы является их способность повышать тонус нижнего сфинктера пищевода и тем самым предотвращать гастроэзофагеальный рефлюкс, а также стимулировать моторику пищевода и снижать частоту развития рефлюкс-эзофагитов. Еще в 1980 г.
D. Lebrec и соавт. сообщили, что длительное применение пропранолола в дозе, которая уменьшает частоту сердечных сокращений на 25 %, снижает риск развития повторного кровотечения из варикозно-расширенных вен пищевода у больных портальной гипертензией. По сводным данным различных исследований, длительное применение β-АБ больными ЦП приводит к снижению числа эпизодов первого или повторного кровотечения в среднем на 44 % (по сравнению с контрольной группой), уменьшению смертности от кровотечения – на 42 % и общей смертности – на 24 %.
Профилактическая эффективность (в частности, пропранолола и надолола) не зависит от этиологии и тяжести ЦП. Одним из предполагаемых механизмов снижения давления в системе воротной вены, возможно, является уменьшение кровотока по печеночной и мезентериальной артериям в результате снижения сердечного выброса (β1-адреноблокада) и вазоконстрикции (β2-адреноблокада).
Среди других возможных механизмов называют следующие:
- повышение тонуса нижнего сфинктера пищевода, что приводит, с одной стороны, к уменьшению желудочно-пищеводного рефлюкса, с другой – к сдавлению коллатеральных сосудов, кровоснабжающих варикозные узлы;
- подавление активности ренин-ангиотензиновой системы и связанной с ней секреции альдостерона, обычно повышенной при ЦП, особенно при наличии асцита [22].
Поэтому β-АБ могут применяться для профилактики кровотечений из варикозно-расширенных вен пищевода. При давлении в воротной вене более 12 мм рт. ст. следует начинать терапию β-АБ независимо от степени расширения вен, стремясь поддерживать давление на уровне не выше 12 мм рт. ст. [23].
На основании вышеперечисленного можно сделать следующее заключение: гидрофильные β-АБ являются препаратами выбора для больных АГ с патологией печени.
К четверной группе АГП относятся ИАПФ. Несмотря на общий механизм действия, ИАПФ различаются по химической структуре, наличию в молекуле дополнительных функциональных групп, природе пролекарства, активности и фармакинетическому профилю, что очень важно учитывать при лечении пациентов с различной патологией органов пищеварения [24].
В настоящее время наиболее известны следующие ИАПФ: каптоприл, эналаприл, беназеприл, фозиноприл, лизиноприл, моэксиприл, периндоприл, квинаприл, рамиприл и трандолаприл [25, 26]. В гастроэнтерологической практике наибольший интерес представляет классификация, которая учитывает данные о физико-химических свойствах и фармакокинетических особенностях ИАПФ. Печень – основное место биотрансформации неактивных ИАПФ в активные диацидные метаболиты. Поэтому тяжелые заболевания печени могут оказывать существенное влияние на фармакокинетику неактивных ингибиторов. Например, у больных ЦП максимальная концентрация квинаприла уменьшается на 70 %. Теоретически при ЦП наиболее безопасны квинаприл и лизиноприл, которые не метаболизируются в печени. В связи с этим становится особенно актуальным использование АГП, не метаболизирующихся в печени, способных обеспечить больным АГ с патологией ЖКТ адекватный контроль АД в течение 24 часов [27].
При тяжелых заболеваниях печени уменьшается не только биотрансформация неактивных ИАПФ, но и превращение их активных диацидных метаболитов в неактивные соединения. Поэтому трудно предсказать изменения плазменных концентраций активных диацидных метаболитов различных неактивных ИАПФ у больных ЦП. Например, в отличие от квинаприла плазменные концентрации диацидного метаболита трандолаприла – трандолаприлата – у пациентов с патологией печени выше, чем у здоровых лиц. Поэтому больным ЦП рекомендуется увеличивать дозу квинаприла, но уменьшать дозу трандолаприла.
Липофильные ИАПФ (каптоприл) обладают самостоятельной фармакологической активностью, но в печени подвергаются дальнейшим превращениям с образованием фармакологически активных дисульфидов, которые выводятся путем почечной экскреции. Липофильные пролекарства (фармакологически неактивные) становятся активными диацидными метаболитами после метаболизма в печени, затем трансформируются в неактивные соединения [28]. У лиц с патологией печени оба этих процесса нарушены, а при снижении кровотока в печени отмечается задержка конверсии пролекарства в его активную форму при первом прохождении через нее [29]. Соответственно, при заболеваниях печени препараты, нуждающиеся в трансформации для приобретения активности, действуют слабее [30].
Ингибиторы АПФ этого класса разделяются на три подгруппы в зависимости от преимущественного пути элиминации их активных диацидных метаболитов:
- подкласс А – препараты с преимущественно почечной элиминацией;
- подкласс В – препараты с двумя основными путями элиминации;
- подкласс С – препараты с преимущественно печеночной элиминацией.
Гидрофильные препараты (лизиноприл) не подвергаются метаболизму в организме больного, циркулируют в крови в форме, не связанной с белками плазмы, и подвергаются элиминации через почки в неизмененном виде. Концентрацию их в плазме крови определяют величина принятой дозы, а также скорость абсорбции и скорость экскреции через почки [31–33]. Лизиноприл, представляя собой активное вещество, не требующее биотрансформации в печени, является препаратом выбора для больных патологией печени (что нередко встречается и при МС) и не требует коррекции дозы. Он оказывает пролонгированное антигипертензивное действие. Начало антигипертензивного эффекта наблюдается через 1–3 часа после приема внутрь, пик действия – через 6 часов, продолжительность действия – 24 часа со стабильным действием через 2–4 недели лечения. Показатели фармакокинетики после приема лизиноприла больными ЦП и без патологии печени достоверно не различаются. Таким образом, ЦП меняет фармакокинетику эналаприла и не влияет не фармакокинетические параметры лизиноприла [34, 35].
Некоторые ИАПФ (каптоприл, лизиноприл) непосредственно обладают биологической активностью. Все другие ИАПФ сами по себе являются неактивными веществами, или пролекарствами, т. е. свое действие проявляют после биотрансформации в печени и образования активных метаболитов.
К следующей группе АГП относятся антагонисты рецепторов ангиотензина II (АРА). В зависимости от наличия активного метаболита АРА разделяются на пролекарства (лосартан, кандесартан, тазосартан), которые становятся активными после метаболических превращений в печени, и активные лекарственные вещества (валсартан, ирбесартан, телмисартан и эпросартан), обладающие фармакологической активностью. Соответственно, при лечении АГ лицами с патологией печени предпочтение отдается активным АРА, которые выводятся в неизмененном виде. Данные препараты также не влияют на активность печеночного цитохрома Р450, что определяет низкий риск взаимодействия их с другими препаратами (например, ранитидином).
Таким образом, при патологии органов пищеварения лечение больных АГ препаратами, подвергающимися печеночному метаболизму, следует проводить с осторожностью. Это связано с тем, что данные препараты могут находиться в крови больных более продолжительное время, что может способствовать развитию нежелательных явлений [36, 37]. При лечении больных АГ с патологией печени важно использовать АГП, не метаболизирующиеся в печени и не ухудшающие ее функциональное состояние [38]. Важнейшей задачей лечения больных АГ с патологией органов пищеварения считается выбор наиболее эффективного АГП с учетом функционального состояния ЖКТ.
Заключение
Таким образом, согласно принципам рациональной фармакотерапии (по Д.Р. Лоуренсу), врач должен среди многих других ставить перед собой и такие вопросы:
- Какой должна быть схема медикаментозного лечения с учетом функционального состояния организма (в первую очередь почек, печени)?
- Превосходит ли возможность предполагаемого улучшения вероятность ущерба и опасность возникновения побочного действия лекарственного средства?


