Проблема выбора третьей и последующих линий терапии
метастатического рака молочной железы (мРМЖ)
На сегодняшний день в качестве лечения РМЖ зарегистрировано и применяется более двух десятков классических цитостатиков, употребление которых (со времен внедрения в клиническую практику тамоксифена и режима циклофосфамид + метотрексат + фторурацил) позволило добиться абсолютной прибавки к выживаемости больных диссеминированным РМЖ, составляющей более 7 месяцев. Появление и внедрение в рутинную клиническую практику таргетных препаратов дали возможность значимо увеличить число эффективных линий терапии для отдельных подгрупп больных (например, HER2+ РМЖ).
Тем не менее следует признать, что большинство рекомендаций, посвященных цитостатическому лечению мРМЖ, которое рано или поздно начинают получать все пациенты независимо от рецепторного и HER2- статуса опухоли, заканчивались на 2-й, максимум 3-й линиях терапии. Так, согласно рекомендациям NCCN, v.2.2013, цитотоксическое лечение не показано в случае прогрессирования на трех последовательных линиях химиотерапии (ХТ) или при ECOG 3. В этих случаях больным может быть рекомендована только паллиативная симптоматическая терапия.
Рекомендации других регулирующих комитетов, например Евросоюза (ESMO, 2011), еще более расплывчаты: “…целью системной терапии метастатического рака молочной железы является продление жизни и улучшение ее качества, в связи с чем предпочтение должно быть отдано последующему применению монотерапии различными препаратами, принимая во внимание тот факт, что комбинированная терапия при большем шансе на достижение эффекта сопряжена с большей токсичностью, при этом данных об увеличении выживаемости нет”.
Лишь рекомендации NICE 2009 г. (в Великобритании) более-менее четко прописывают последовательность использования режимов лечения больных диссеминированным РМЖ. Согласно этим рекомендациям, для большинства больных предпочтительней последовательное применение различных цитостатиков в монотерапии; комбинированная ХТ может быть использована пациентками, для которых достижение непосредственного эффекта имеет большое клиническое значение, при условии, что они смогут перенести дополнительную токсичность. Для больных, которым не могут быть назначены антрациклины, препаратами выбора являются: 1-я линия –доцетаксел, 2-я – винорельбин или капецитабин, 3-я линия – капецитабин или винорельбин (в зависимости от режима 2-й линии). Гемцитабин в комбинации с паклитакселом может рассматриваться как лечебная опция только наравне с комбинацией доцетаксел + капецитабин.
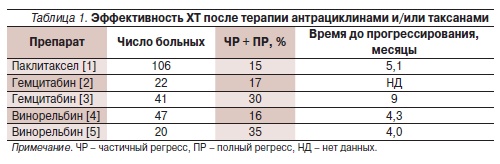
Эффективность в 3-й и последующих линиях монотерапии таких препаратов, как паклитаксел, гемцитабин и винорельбин, невысока (табл. 1). Использование комбинированных режимов в большинстве случаев дает выигрыш во времени до прогрессирования и частоте непосредственных ответов, но не в общей выживаемости (ОВ) и, что немаловажно для больных мРМЖ, ценой значимо более высокой токсичности.
В 2012 г. были опубликованы рекомендации 1-й консенсусной конференции по терапии мРМЖ [6] (1st
International consensus guidelines for advanced breast cancer – ABC 1), согласно которым, для больных, получавших и антрациклины, и таксаны и не требовавших (или в отсутствие возможности вследствие общего состояния) назначения комбинации цитостатиков, терапией выбора является капецитабин (см. табл. 2).
Таблица 2. Эффективность капецитабина после антрациклинов и таксанов.
Из доступных в России для лечения РМЖ цитостатиков только капецитабин и винорельбин имеют показания к их использованию при прогрессировании на антрациклинах и таксанах. Иксабепилон, имеющий сходные показания к применению, в настоящее время одобрен к использованию в качестве лечения мРМЖ только в США.
Тем не менее вне рамок всяких рекомендаций многие пациентки с мРМЖ получали и продолжают получать терапию 3-й, 4-й и последующих линий. В США, например, такие больные за время болезни успевают получить в среднем 4–6 линий ХТ. Однако до последнего времени мы не имели четких доказательств того, что какие-либо варианты цитотоксической терапии, используемые после двух стандартных линий лечения, увеличивают выживаемость больных. В 2011 г. такой препарат появился. Более того, он показал преимущества в отношении не только непосредственной эффективности,
но и ОВ по сравнению со сводными результатами, отражающими рутинную практику более 2-й линии, применявшуюся до сих пор.
Эрибулин (Халавен) [производное морской губки Halichondria okadai] ингибирует микротрубочки посредством секвестрирования тубулина в неактивные конгломераты. В доклинических исследованиях была показана его эффективность в отношении клеточных линий, имеющих мутации β-тубулина, определяющих резистентность к таксанам. В двух исследованиях II фазы [11, 12] (n = 103 и 299) на больных мРМЖ, получивших в среднем по 4 линии ХТ, была продемонстрирована не только непосредственная эффективность (частота объективного ответа составила 11,5 и 9,3 %), но и большая для этих сроков лечения ОВ (медиана составила 9,0 и 10,4 месяца).
Регистрационное исследование EMBRACE
Полученные данные о значимом увеличении ОВ послужили предпосылкой инициации рандомизированного исследования уже III фазы – EMBRACE [13, 14]. Отличительной особенностью этого исследования, ставшего, по сути, регистрационным для эрибулина, было то, что первичной целью оценки являлась именно ОВ больных, получивших в среднем 2–5 линий ХТ, обязательно включивших антрациклины и таксаны.
Включенные в исследование 762 пациентки, средний возраст которых составил 55 (27–85) лет, получившие в среднем по 4 (2–7) линии ХТ, причем длительность последней линии терапии составляла 3,5 месяца, были рандомизированы в соотношении 2 : 1 на получение эрибулина по 1,4 мг/м2, дни 1 и 8 каждого 3-недельного цикла (n = 508), и проведение оговоренной до рандомизации ХТ по выбору
врача (n = 254). Как правило, в качестве такой ХТ использовались винорельбин, гемцитабин и капецитабин. Предшествующее лечение капецитабином, а также HER2-статус опухоли и географический регион проведения исследования стали стратификационными факторами. Эти факторы были выбраны для изучения различий в доступности препаратов и особенностей рутинной клинической практики в зависимости от географического региона.
Следует отметить, что 80,6 % включенных больных имели подтвержденную рефрактерность (прогрессирование на фоне применения или в течение 6 месяцев) к таксанам, 57,7 % –к анатрациклин-содержащей ХТ, а 67,7 % – к капецитабину.
HER2+-статус опухоли был подтвержден 16 % пациенток, наличие эстрогеновых и прогестероновых рецепторов (РЭ+/РП+) – 64 %, 19 % больных имели опухоль с тройным негативным фенотипом. Наиболее частой локализацией метастазов были кости – у 61 % и печень – у 60 % больных. Более
половины пациенток имели метастазы трех и более локализаций.
Лечение проводилось до прогрессирования болезни либо развития непереносимой токсичности. Как уже говорилось выше, первичной целью исследования стала оценка ОВ больных в обеих группах. Кроме того, сравнивались выживаемость без прогрессирования (ВБП), частота достижения объективного ответа и длительность ответа.
Медиана продолжительности лечения эрибулином составила 3,9 (0,7– 16,3) месяца, причем 5 и более циклов получили 59 % больных. В то же время медиана длительности терапии “по выбору врача” составила 2,1 (0,03–21,2) месяца. Ожидать значимого противоопухолевого ответа на этих сроках
терапии, как правило, не приходится, тем не менее в группе эрибулина 12 % больных, по мнению независимых экспертов, был достигнут объективный ответ (из них 3 полных), а контроля над болезнью удалось добиться 23 % пациенток. Для больных, получавших терапию “по выбору врача”, эти цифры
были ниже: 5 % – частота достижения объективного ответа и 17 % – контроль над болезнью (р = 0,002).
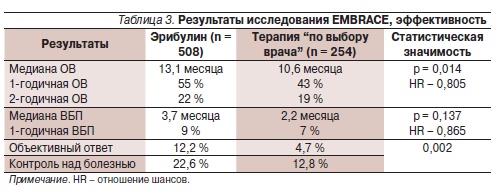
Медиана ВБП в обеих группах не выглядит впечатляющей (3,7 месяца при терапии эрибулином и 2,2 – в группе сравнения) и служит нам напоминанием о неудовлетворительных результатах лечения больных в n-ной линии терапии мРМЖ. И на этом фоне весьма неожиданными и обнадеживающими оказались данные по ОВ больных, включенных в исследование. Медиана ОВ составила 13,1 месяца
(95 % доверительный интервал [ДИ] –11,8–14,3) в группе эрибулина и 10,6 месяца (95 % ДИ – ,3–12,5) в группе терапии “по выбору врача”; 1-летняя выживаемость – 53,9 и 43,7 % соответственно (табл. 3). При анализе по стратификационным группам преимущество в отношении ОВ у больных в группе эрибулина сохранились независимо от HER2-статуса опухоли и наличия/отсутствия предшествующей
терапии капецитабином.
По известным причинам очевидно, что проведение противоопухолевого лечения больным, уже получившим две линии и более ХТ, минимум не должно ухудшить качество их жизни. Как и в более ранних работах, в исследовании EMBRACE было продемонстрировано, что профиль токсичности у эрибулина хорошо управляем. Самым частым осложнением 3–4-й степени у больных, получавших эри-
булин, была нейтропения (45 %), в то же время фебрильная нейтропения была зарегистрирована лишь
в 5 % случаев; прекращение лечения в связи гематологической токсичностью потребовалось только 4 больным. Периферическая нейропатия возникла у 35 % больных в группе эрибулина, что оказалось даже несколько ниже, чем у пациенток, получавших в качестве терапии “по выбору врача” таксаны (45 %). Лишь у 8 % больных, получавших эрибулин, отмечено развитие нейропатии 3–4-й степени, и только 24 (5 %) женщины этой группы были вынуждены прекратить лечение.
Несмотря на то что те или иные нежелательные явления всех степеней были отмечены практически у всех больных, получавших эрибулин, следует отметить, что серьезные нежелательные явления возникли лишь у 25 % женщин, что оказалось сопоставимым с частотой (26 %) их развития в контрольной группе. Частота нежелательных явлений, потребовавших редукции дозы препаратов, в обеих группах была сопоставимой: 29 % – в группе эрибулина и 26 % – в группе больных, получавших терапию “по выбору врача”. Отмена лечения в связи с осложнениями потребовалась 13 и 15 %
больных соответственно.
Результаты исследования EMBRACE показали, что, обладая управляемой токсичностью, эрибулин позволяет существенно увеличивать ОВ сильно предлеченных больных мРМЖ по сравнению с доступными вариантами терапии.
На основании результатов исследования EMBRACE 15.11.10 эрибулин (Халавен) был одобрен FDA США к применению больными мРМЖ, получившими минимум 2 линии предшествующего лечения по поводу распространенной болезни. Предшествующее лечение должно было включать антрациклины и таксаны, причем их использование допускалось как в адъювантном режиме, так и при метастатической болезни. Препарат Халавен (эрибулин) получил одобрение к применению 20.11.11 по тем же показаниям в Европейском Союзе (EMEA), а в октябре 2012 г. – в России.
Клинический случай
Представляем клинический случай эффективного применения эрибулина (Халавена) больными мРМЖ, получившими более 10 линий лечения. В августе 2001 г. у больной Е. 1962 года рождения был диагностирован рак правой молочной железы T2N1M0. Радикальная мастэктомия ей была выполнена 12.09.01. Гистологическое заключение: инфильтративный дольковый рак; метастазы в 2 из 14 лимфоузлов. После получения результатов определения иммуноферментным методом уровней РЭ (6,3 фмоль/мг белка) и РП (30,8 фмоль/мг белка), согласно существующим на то время принципам терапии гормоно-позитивного РМЖ, 26.09.01 была выполнена лапароскопическая овариэктомия.
В качестве адъювантной терапии с сентября 2001 по февраль 2002 г. больная получила 6 курсов CEF (эпирубицин + циклофосфамид + фторурацил). С февраля 2002 г. был начат прием тамоксифена по 20 мг/сут, однако через 6 месяцев в связи с гиперплазией эндометрия (подтвержденной по данным гистологического исследования материала, полученного при раздельном диагностическом выскабливании) адъювантная эндокринотерапия была заменена на Фарестон (торемифен) по 60 мг/сут, который больная получала до декабря 2005 г.
При контрольном обследовании (УЗИ, магнитно-резонансная томография [МРТ] с внутривенным контрастированием) в декабре 2005 г. был выявлен и цитологически подтвержден солитарный метастаз РМЖ в S7 печени. Солитарный характер метастазирования был подтвержден по данным позитронно-эмиссионной томографии (ПЭТ).
В качестве 1-й линии терапии мРМЖ с декабря 2005 по июнь 2006 г. было проведено 8 курсов ХТ в режиме доцетаксел 50 мг/м2 + карбоплатин AUC-5 каждые 3 недели. На фоне лечения был достигнут полный регресс метастаза в печени, подтвержденный данными УЗИ, МРТ и ПЭТ.
С июня 2006 по июль 2009 г. (37 месяцев) больная получала летрозол 2,5 мг/сут (2-я линия терапии мРМЖ). В июле 2009 г. отмечено прогрессирование болезни – единичные метастазы в печени (оценка велась по данным УЗИ и МРТ).
Принимая во внимание ранее достигнутый длительный эффект на фоне терапии 1-й линии, с июля по
декабрь 2009 г. было проведено 6 курсов реиндукции ХТ: доцетаксел 50 мг/м2 + карбоплатин AUC-5 каждые 3 недели.
Достигнут частичный регресс (по данным УЗИ и МРТ), при ПЭТ после окончания ХТ определен единичный очаг в S7 печени, SUV = 3,8.
С декабря 2009 г. была начата терапия фульвестрантом по 250 мг внутримышечно каждые 28 дней, однако при контроле в январе 2010 г. отмечено появление новых метастазов в печени.
С января по сентябрь 2010 г. больная получила 8 курсов ХТ: винорельбин 25 мг/м2 внутривенно в дни 1 и 8 + капецитабин 2000 мг/м2/сут внутрь в дни 1–14 каждые 3 недели (3-я линия терапии мРМЖ). Максимальный эффект лечения (после 6-го курса) – частичный регресс по данным МРТ; частичный метаболический ответ по данным ПЭТ.
При контрольном обследовании в октябре 2010 г. вновь отмечено прогрессирование болезни в виде появления новых метастазов в печени (по данным УЗИ, МРТ и ПЭТ).С целью определения HER2-статуса
опухоли была выполнена биопсия метастаза в печени (по данным гистологического исследования: метастаз инвазивного долькового РМЖ). Иммуногистохимия (ИГХ): РЭ – 7 баллов (шкала Allred), РП – 5 баллов (шкала Allred), HER2 – 1+, Ki 67 – 75 %.
В качестве 4-й линии терапии мРМЖ был выбран режим гемцитабин 800 мг/м2 + паклитаксел
90 мг/м2 каждые 2 недели, начат прием Мегейса (мегестрол) по 160 мг/сут перорально.
При первом же контрольном обследовании в декабре 2010 г. зарегистрировано дальнейшее прогрессирование болезни – увеличение размеров и числа метастазов в печени (УЗИ, МРТ): в S8 – до 3,7 × 3,9 см; в S6 – до 2,1 × 2,0 см; в S3 – 2 очага до 1,2 см.
С декабря 2010 по май 2011 г. больная получала бевацизумаб 15 мг/кг + эпирубицин 80 мг/м2 каждые 3 недели (5-я линия терапии мРМЖ). На этом фоне была достигнута стабилизация болезни.
При обследовании в мае 2011 г. – прогрессирование болезни: множественное, уже билобарное метастатическое поражение печени (УЗИ, МРТ).
С мая по август 2011 г. проведена ХТ: гемцитабин 1000 мг/м2 + иринотекан 125 мг/м2 каждые 2 недели (6-я линия терапии).
В августе 2011 г. – прогрессирование болезни, дальнейшее увеличение размеров (до 6,0 см в S8) и числа метастазов в печени (УЗИ, МРТ).
ХТ – цисплатин 75 мг/м2 в день 1 + этопозид по 100 мг/м2 в дни 1–3 каждые 3 недели, которую больная получала с августа по октябрь 2011 г., также оказалась безуспешной (7-я линия терапии).
Принимая во внимание сохранившуюся высокую экспрессию РЭ в метастатической опухоли (ИГХ биоп-
сии метастаза в печени), а также ранее отмечаемый длительный контроль над болезнью на фоне ингибиторов ароматазы, было принято решение о попытке терапии в режиме паклитаксел 60
мг/м2 в дни 1, 8 и 15 + эверолимус 5 мг/сут внутрь + экземестан 25 мг/сут внутрь (8-я линия терапии мРМЖ). Уже через 2 месяца терапии был отмечен частичный регресс метастазов в печени (МРТ – уменьшение размеров и исчезновение части метастазов). В марте 2012 г. после эпизода генерализованного эпилептоидного припадка были диагностированы (по данным МРТ) единичные метастазы в головной мозг, при этом достигнутый частичный регресс метастазов в печени
сохранялся. Проведено радиохирургическое лечение метастазов в головноймозг 27.03.12. Терапия паклитакселом, эверолимусом и экземестаном была продолжена.
К сожалению, в апреле 2012 г. проводимое лечение пришлось прервать в связи с гепатотоксичностью (повышение уровня печеночных ферментов до 10 норм).
После купирования явлений гепатотоксичности (уровень печеночных ферментов снизился до 2 норм, достигнутый эффект со стороны метастазов в печени сохранялся) с мая по сентябрь 2012 г. проведена терапия, включившая доцетаксел 40 мг + винорельбин 30 мг каждые 2 недели (9-я линия терапии мРМЖ).
При контрольном обследовании в июле 2012 г. отмечена стабилизация болезни с уменьшением размеров части метастазов в печени, снижение размеров метастазов в головном мозге; эпизодов судорожных припадков больше не повторялось.
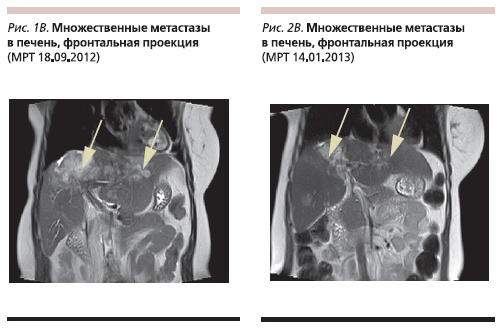
Однако уже в сентябре 2012 г., по данным МРТ, отмечено увеличение размеров метастазов в головной мозг и конгломерата метастатических узлов в S8–4 печени – до 9,2 см, появилась инфильтрация ворот печени, также отмечено появление новых метастазов в S4–5 и S5–6 печени до 4 см (рис. 1 А, Б, В).

Таким образом, к сентябрю 2012 г. практически все возможные варианты терапии РМЖ у обсуждаемой больной были исчерпаны. За период лечения пациентка получила 9 режимов ХТ, включая антиангиогенную терапию (бевацизумаб) и эверолимус, и последовательно все возможные варианты
эндокринотерапии.
В качестве терапии отчаяния в 10-й линии терапии мРМЖ с октября 2012 г. больной было начато лечение эрибулином в комбинации с капецитабином. Терапия эрибулином была начата в рекомендованной инструкцией дозе – 1,4 мг/м2, однако в связи с развившейся нейтропенией 2-й степени, потребовавшей пропуска введения препарата на день 8, была проведена редукция дозы до 1 мг суммарно в дни 1 и 8 каждые 3 недели. Капецитабин больная принимала по 1000 мг в дни –
1–14 каждые 3 недели.
При контрольном обследовании в ноябре 2012 г. был зафиксирован частичный регресс метастазов в печени (конгломерат в S8–4 уменьшился до 6,7 см, перестала определяться часть метастазов в других сегментах печени; рис. 2 А, Б, В), отмечено уменьшение размеров очагов в головном мозге.

В интервале между курсами наблюдали кратковременную нейтропению 2-й степени, тромбоцитопению 1-й степени, не потребовавших отсрочки введения препаратов. Периферическая
нейропатия находилась в пределах 1-й степени. Весь период лечения больная сохраняла статус ECOG 1 и продолжала вести активный образ жизни.
При контрольном обследовании в январе 2013 г. при сохранении достигнутого частичного регресса со стороны метастазов в печени было отмечено появление метастатического поражения оболочек головного мозга, сопровождавшегося неврологической симптоматикой в виде выраженного тремора конечностей и нарастающей атаксии. В то же время произошло развитие стойкой тромбоцитопении 2-й степени, в связи с чем терапия эрибулином и капецитабином была прервана (длительность лечения составила 3,5 месяца).
С января по март 2013 г. проведена интратекальная терапия метотрексатом, на фоне которой отмечено временное улучшение состояния. Однако при контрольном обследовании в марте 2013 г. имело место увеличение размеров метастазов в печени и развитие печеночной недостаточности, на фоне чего больная погибла.
Данное клиническое наблюдение подтверждает, что мРМЖ –по-настоящему хроническое заболевание, протекающее с периодами обострений и ремиссий и позволяющее длительное время больным жить с сохранением удовлетворительного качества жизни. Последовательное применение различных вариантов эндокринотерапии и химиотерапевтических режимов позволило этой больной прожить более 7 лет (87 месяцев) с метастатической болезнью, причем 7 лет она провела практически без нарушения качества жизни. Использование в качестве “последней” линии терапии появившегося к тому моменту эрибулина внесло посильную лепту в достижение такого впечатляющего результата.
Перспективы применения эрибулина
После демонстрации эффективности и приемлемой токсичности эрибулина у сильно предлеченных больных были начаты исследования по изучению его эффективности уже в 1-й линии терапии мРМЖ.
По предварительным результатам исследования 206, включившего 48 (из 52 планируемых) больных HER2-негативным распространенным РМЖ, объективный эффект был достигнут 27,1 % пациенток, причем больными с трижды негативным фенотипом – в 30 % случаев. Контроль над болезнью
(частичный регресс + стабилизация болезни > 6 месяцев) был достигнут 45,8 % женщин, при этом медиана длительности ответа составила 7,4 месяца. Медиана времени до прогрессирования в этом исследовании на момент предварительного анализа составила 5,9 месяца (95 % ДИ – 3,5–7,4). При анализе безопасности режима применения эрибулина в дозе 1,23 мг/м2 внутривенно в дни 1 и 8
каждые 3 недели наиболее частым нежелательным явлением (как и в исследовании EMBRACE) оказалась нейтропения всех степеней (у 72,9 % больных), фебрильная нейтропения была зарегистрирована лишь в 4,2 % случаев. Клинически значимая периферическая нейропатия (3–4-й степени) отмечена лишь у 12,5 % пациенток [15].
В пилотном исследовании II фазы, включившем 40 больных HER2-позитивным мРМЖ, ранее не получавших лечения по поводу метастатической болезни, использование эрибулина в стандартном режиме (в комбинации с трастузумабом) в 1-й линии терапии оказалось высокоэффективным и безопасным. Объективный эффект (ПР + ЧР) был достигнут 55 % пациенток, а контроля над болезнью удалось добиться в 62,5 % случаев. При этом медиана времени до прогрессирования составила 9,2 месяца
для всех больных, 7,1 месяца – для больных, опухоли которых были расценены как позитивные по РЭ, и 13,9 месяца – в отсутствие экспрессии РЭ. Токсичность и степень выраженности побочных эффектов лечения были аналогичными отмеченным при использовании эрибулина в других исследованиях: нейтропения всех степеней – в 60 % случаев, фебрильная нейтропения – лишь в 7,5 %, периферическая нейропатия – в 47,5 %, при этом 3–4-я степени выраженности нейропатии –
лишь в 12,5 % случаев. Окончательные результаты этого исследования, как и исследования 206, ожидаются к концу 2013 г. [16].
Заключение
Таким образом, в настоящее время эрибулин (Халавен) является новой клинической опцией для больных таксан- и антрациклин-резистентным мРМЖ. Исследования по изучению возможности применения препарата на более ранних этапах лечения и в комбинации с другими цитостатиками и таргетными препаратами продолжаются.
Характеризуясь управляемой токсичностью, эрибулин позволяет существенно увеличивать ОВ сильно предлеченных больных мРМЖ по сравнению с ранее доступными вариантами терапии. В связи с этим очень важным представляется поиск факторов, способных выделить подгруппу больных или подтипы опухоли, при которых продолжение терапии за пределами существующих стандартов принесло
бы наибольшую пользу.


