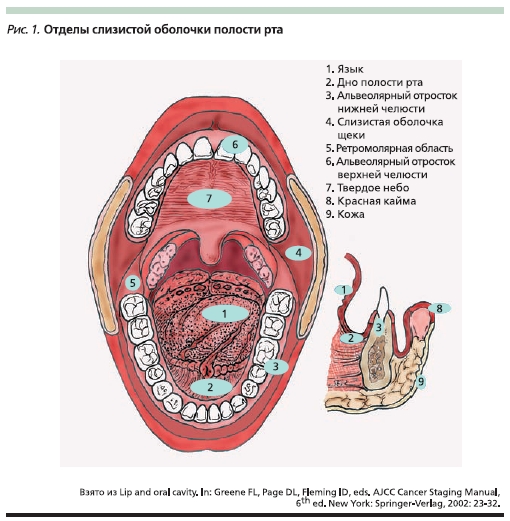
Полость рта – это область слизистой оболочки от красной каймы губ до входа в ротоглотку. Вход в ротоглотку ограничен сверху переходом твердого неба в мягкое, латерально – передними небными дужками и снизу – желобоватыми сосочками на границе подвижной части и корня языка. Подслизистая
оболочка богата малыми слюнными железами с высокой их концентрацией в области твердого неба. Полость рта разделена на отделы, включающие слизистую оболочку преддверия рта, слизистую оболочку щек, дна полости рта, ретромолярной области, языка, альвеолярного отростка нижней челюсти, альвеолярного отростка верхней челюсти и твердого неба (рис. 1).
Проблема лечения плоскоклеточного рака слизистой оболочки полости рта заключается в том, что
с данной патологией зачастую сталкиваются врачи достаточно узких специальностей, например стоматологи, челюстно-лицевые хирурги. Отсутствие достаточной онкологической настороженности среди этих специалистов, а также слабая информированность самого населения приводят к тому, что зачастую больные обращаются к врачу-терапевту, а затем направляются к онкологу с запущенными стадиями заболевания. Так, по данным статистики, с 1997 по 2007 г., например, опухоли полости рта и глотки III–IV стадий составили почти 70 % от всех выявленных опухолей этой локализации, при этом летальность на 1-м году после выявления этого заболевания в 2007 г. составила 39,1 % [1].
Тактика лечения рака полости рта
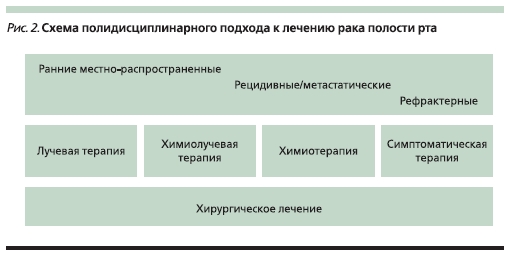
Лечение рака полости рта является комплексной проблемой и требует участия в решении судьбы пациента нескольких основных специалистовонкологов: хирурга по опухолям головы и шеи, специалиста по лучевой терапии и химиотерапевта (рис. 2). В этой работе мы разберем основные вопросы комплексного подхода к лечению данной патологии на разных этапах развития опухолевого процесса. Это вопросы лечения первичных опухолевых процессов как на ранней стадии, так и местно-распространенных, лечения регионарных метастазов и рецидивов.
При выборе того или иного метода лечения или их комбинации необходимо определить первичные опухоли полости рта по классификации TNM с учетом распространенности опухолевого процесса.
Ранние стадии: Т1 или Т2 (экзофитные формы), N0, М0.
На ранних стадиях развития заболевания возможно применение одного из методов лечения – либо хирургического, либо лучевого. Лучевая терапия (ЛТ) – достаточно распространенный метод лечения опухолей данной стадии. Так, при опухолях, соответствующих стадиям Т1 и Т2, при использовании различных методик лучевого лечения, в частности сочетанной ЛТ (дистанционной гамма-терапии и внутриполостной), получена пятилетняя безрецидивная выживаемость 80–85 % и 40–60 % больных соответственно [2, 3]. Хирургическое лечение в самостоятельном варианте позволяет достигать результатов, сравнимых с таковыми после лучевого лечения. Так, O’Brien и соавт. в 1986 г. представили данные о хирургическом лечении рака полости рта стадий Т1 и Т2 с 2-летней безрецидивной выживаемостью 95 и 87 % соответственно [4]. Spiro и соавт., предоставив свой опыт самостоятельного хирургического лечения рака языка и дна полости рта и получив уровень локальных рецидивов в 12 %,
также сделали вывод о преимуществах самостоятельного хирургического лечения.
Умеренные стадии: Т2 (инфильтративные формы) или Т3 (экзофитные формы), N0 или N1, М0.
Распространенные стадии: Т3 (инфильтративные формы), Т4, N2 или N3, М0. Лечение процессов такой распространенности требует комбинированного или комплексного подхода. Применение в самостоятельном варианте ЛТ обеспечивает безрецидивное течение процесса менее чем у половины пациентов [6, 7]. Необходимо применять комбинированный метод лечения. Обычно это комбинация
радикального хирургического вмешательства и лучевого лечения. Это показано в многочисленных публикациях как в России, так и за рубежом. Так, по рекомендациям ESMO [8] при плоскоклеточном раке полости рта умеренных и распространенных стадий с регионарными метастазами (III–IV стадий)
рекомендовано комбинированное воздействие с хирургическим вмешательством на первом этапе. С этим спорят отечественные специалисты [9], а также ряд зарубежных [10–12], которые рекомендуют на первом этапе проведение конкурентного химиолучевого лечения, а отечественные –самостоятельного лучевого [9]. При использовании предоперационной ЛТ суммарная очаговая доза (СОД) обычно составляет 40–50 Гр в зависимости от принятых стандартов клиники [9, 10]. Авторы, рекомендующие послеоперационную ЛТ, подчеркивают, что при этом возможно проведение ЛТ до
СОД 66–70 Гр. Выполнение на первом этапе хирургического вмешательства на первичном очаге и лимфопутях шеи позволяет детально изучить морфологический материал с оценкой краев резекции первичной опухоли, числа пораженных метастазами регионарных лимфатических узлов шеи, наличие экстракапсулярного распространения метастатического процесса. Эта информация позволяет оценить
прогноз заболевания, выявив неблагоприятные в отношении рецидивирования и метастазирования факторы. При их наличии предлагается сочетание послеоперационной ЛТ и лекарственного лечения. Так, по данным проспективного рандомизированного исследования Bernier и соавт. [13], проведение в послеоперационном периоде конкурентной химиолучевой терапии (ХЛТ) с включением цисплатина в дозе 100 мг/м2 каждые три недели облучения обеспечивало статистически достоверное улучшение
отдаленных результатов лечения по сравнению с группой послеоперационной ЛТ в самостоятельном варианте. Безрецидивная выживаемость в группе ХЛТ и ЛТ составила 47 и 36 % соответственно (p = 0,04), а общая выживаемость 53 и 40 % соответственно (p = 0,02). Общеизвестно, что применение радикальных доз ЛТ (СОД до 66–70 Гр) на дооперационном этапе значительно ухудшает заживление
раны, увеличивает частоту послеоперационных осложнений. Применение жепредоперационной ЛТ в СОД 40–46 Гр ограничивает возможности клиницистов в лечении больного, особенно если хирургическое вмешательство на втором этапе лечения носило условнорадикальный характер.
При неоперабельных местнораспространенных опухолевых процессах рекомендуется начинать лечение с индукционной полихимиотерапии (ПХТ). Применение системной ПХТ преследует несколько целей: уменьшить размеры опухоли, снизить вероятность развития отдаленных метастазов и оценить чувствительность опухолевого процесса к ХЛТ. Основной комбинацией, используемой в виде
индукционной ПХТ, на сегодняшний день признана схема ТПФ (доцетаксел с цисплатином и фторурацилом). Последняя схема представляется как наиболее эффективная, но и наиболее токсичная. В рандомизированном многоцентровом исследовании V-324 было наглядно показано преимущество схемы ТПФ над таковой ПФ (цисплатин + фторурацил) в отношении как непосредственной эффективности, так и отдаленных результатах. Так, медиана общей выживаемости в группе ТПФ была значительно больше, чем в группе ПФ (71 против 35 месяцев; p = 0,013) [14].
Вторым этапом после применения индукционной ПХТ проводится конкурентное ХЛТ, т. е. ЛТ с одновременным применением химиопрепаратов. Применение конкурентного ХЛТ с введением цисплатина в дозе 100 мг/м2 в 1-й, 22-й и 43-й дни ЛТ считается крайне эффективной схемой лечения,
которая обеспечивает высокий локорегионарный контроль и увеличивает продолжительность жизни пациентов. Так, в мета-анализе Pignon и соавт. [15] наглядно показано, что применение конкурентного ХЛТ повышает выживаемость больных плоскоклеточным раком головы и шеи до 8 %.
При этом можно заметить, что в настоящее время при невозможности применения платиносодержащих препаратов при конкурентном ХЛТ возможно включение в эту схему лечения
таргетного препарата цетуксимаба, который вводят за неделю до начала лучевого лечения в дозе 400 мг/м2 и в последующем – еженедельно в процессе облучения в дозе 250 мг/м2. Эффективность такой замены доказана в исследовании TREMPLIN [16]. Группы с применением цетуксимаба имели те же результаты локорегионарного контроля и выживаемости, как и группа с применением цисплатина.
Лечение зон регионарного метастазирования
Важным аспектом лечения больных раком полости рта является вопрос воздействия на зоны регионарного метастазирования. Лечение выявленного метастатического поражения лимфатических узлов шеи не вызывает вопросов и осуществляется либо хирургическим путем, либо комбинированным методом (шейная диссекция и ЛТ). Метастазирование в регионарные лимфатические узлы для больных
плоскоклеточным раком полости рта, бесспорно, важнейший фактор прогноза. Оценка вероятности развития этих метастазов является достаточно сложной задачей. Именно поэтому многие ученые считают очень важным распознавание клинически скрытых регионарных метастазов.
По мнению некоторых авторов, вероятность наличия скрытых регионарных метастазов, превышающая
20 %, сама по себе является показанием к проведению профилактической шейной лимфодиссекции.
Профилактическая шейная диссекция, которая ранее проводилась в большинстве случаев, теперь же все больше считается некоей процедурой, определяющей стадию опухолевого процесса (N). Большинство онкологов рекомендуют проводить послеоперационную ЛТ или ХЛТ в том случае, когда в
удаленном макропрепарате клетчатки шеи обнаруживаются метастазы [17, 18]. С другой стороны, профилактическую шейную диссекцию выполняют с лечебной целью, когда онколог ставит перед собой задачу подбора необходимого лечения для зон регионарного лимфатического коллектора [19–21].
Несмотря на лечебные и диагностические показания к выполнению профилактической шейной диссекции у больных с шейными лимфатическими узлами в статусе N0, многих пациентов (50–70 %) оперируют не совсем обоснованно. Данное мнение является основой для использования некоторыми специалистами т. н. методики динамического наблюдения или, как она называется в зарубежной литературе, методики “наблюдать и ждать” (watch and wait) [22]. Однако в настоящее время нельзя игнорировать исследования, демонстрирующие улучшение показателей выживаемости больных, которым была выполнена профилактическая шейная диссекция, по сравнению с больными групп динамического наблюдения [23–25]. В этих результатах нет ничего удивительного, т. к., по данным различных авторов, при профилактической шейной диссекции скрытые метастазы выявляются в 25–45 % случаев даже на ранних стадиях опухолевых процессов [22,26–29].
Таким образом, главнейшим аргументом для выполнения профилактической шейной диссекции по сравнению с методикой динамического наблюдения является значительное снижение показателей продолжительности жизни больных, у которых регионарные метастазы выявляются после проведенного лечения по поводу первичной опухоли [30–33].
Схемы лечения рецидивов рака органов головы и шеи
Хирургическое лечение местного рецидива или регионарного метастаза плоскоклеточного рака органов головы и шеи после предшествующего радикального ХЛТ может быть пред-ложено от 15 до 30 % пациентов с каким-либо шансом на длительную выживаемость. Пациентам, которые не подходят для хирургического лечения, обычно предлагается химиотерапия как лечение первой линии. Есть
много препаратов, показавших свою активность в режимах монохимиотерапии, с уровнем объективного ответа около 15 % (цисплатин, карбоплатин, метотрексат, фторурацил, блеомицин
и таксаны). Цисплатин является наиболее важным препаратом этой линии, и он является основой многих комбинаций химиопрепаратов, применяющихся в лечении пациентов с этой патологией [34]. В настоящее время комбинация цисплатина с фторурацилом или таксанами стала наиболее
часто применяемым режимом, который дает уровень объективных ответов от 30 до 40 %. Однако в общем средняя продолжительность жизни не повышается по сравнению с применением монотерапевтических режимов и остается на уровне от 6 до 9 месяцев [34]. Проявления токсичности, связанные с применением цисплатина(гемо-, нефро-, нейро- и ототоксичность), хорошо известны и ограничивают попытки применять более высокие дозы цисплатина.
С точки зрения ограниченных возможностей лечения эти категории пациентов с плоскоклеточным раком головы и шеи нуждаются в разработке более современных химиотерапевтических средств. Однако за последние 25 лет не появилось комбинаций химиопрепаратов, хоть как-нибудь улучшавших показатели средней продолжительности жизни этих больных.
Проведено несколько крупных рандомизированных международных клинических исследований по оценке эффективности включения цетуксимаба в схемы лечения больных рецидивным и/или метастатическим плоскоклеточным раком головы и шеи. Основные достижения прибавления цетуксимаба к ПХТ с использованием цисплатина и фторурацила были продемонстрированы в недавно
завершенном европейском исследовании III фазы (EXTREME): цетуксимаб в комбинации с цисплатином
или карбоплатином и фторурацилом в лечении 1-й линии пациентов с рецидивным и/или метастатическим плоскоклеточным раком головы и шеи. Всего в исследование были включены
442 пациента для проведения ПХТ с использованием цисплатина или карбоплатина и фторурацила с добавлением цетуксимаба или без него [35]. Исследование дало самый главный ответ: средняя общая продолжительность жизни была значительно больше у пациентов, леченных с применением цетуксимаба и ПХТ, по сравнению с группой, где применялась только ПХТ (10,1 против 7,4 месяца; p =
0,036). Анализ безопасности показал, что добавление цетуксимаба не увеличивало числа характерных побочных эффектов, свойственных стандартной ПХТ (цисплатин + фторурацил) [35]. На основании этих убедительных данных можно сказать, что в химиотерапевтические схемы, применяемые при лечении рецидивов и метастазов рака полости рта, необходимо включать цетуксимаб.
Итак, мы можем еще раз подчеркнуть, что лечение рака слизистой оболочки полости рта – крайне сложная задача в основном из-за необходимости взвешенного полидисциплинарного подхода к лечению данных пациентов на всех этапах развития болезни.


