Введение
Сахарный диабет (СД) представляет собой одну из глобальных проблем современного здравоохранения, т.к. вызывает осложнения со стороны нервной и сердечно-сосудистой систем, снижает качество жизни, повышает риск внезапной смерти [1]. В настоящее время, по данным Международной федерации диабета, СД страдают 415 млн взрослых (каждый 11-й житель земного шара). По данным Федерального регистра СД, в 2016 г. в России зарегистрированы 4,3 млн человек, страдавших этим заболеванием [2, 3].
Диабетическая полинейропатия (ДПН), по данным разных авторов, встречается среди 50–80% больных СД 2 типа (СД2) и ассоциируется с выраженным болевым синдромом, что ведет к снижению качества жизни. В исследовании DIAD показано, что сенсорный дефицит и нейропатическая боль являются независимыми факторами риска внезапной смерти от заболеваний сердца или нефатального инфаркта миокарда. В исследовании ACCORD установлено, что наличие нейропатии в анамнезе позволяет прогнозировать повышение смертности среди пациентов [4]. Дистальная симметричная сенсомоторная полинейропатия – самый частый вариант ДПН: до 75% случаев, и, по данным некоторых авторов, развивается уже на этапе преддиабета [5].
Патогенез ДПН в настоящее время рассматривается в рамках взаимодействия между метаболическими и сосудистыми факторами [6]. Известно, что при СД2 жесткий контроль гликемии лишь незначительно снижает риск развития нейропатических осложнений. Согласно данным современных исследований, к факторам, влияющим на развитие ДПН, относят возраст больного, дислипидемию, артериальную гипертензию, курение [7].
В свете современных данных лечение ДПН должно включать воздействие на факторы риска, патогенетическую и симптоматическую терапию, лечение самого СД. Это делает актуальной необходимость комплексного лечения ДПН с включением препаратов, воздействующих на ее патогенез [8].
Одним из новых препаратов, предложенных для комплексного патогенетического и симптоматического лечения ДПН, является Кокарнит, содержащий трифосаденина 10 мг, цианокобаламина 0,5 мг, никотинамида 20 мг и кокарбоксилазы 50 мг.
Цель исследования: оценка эффективности комплексной терапии, включающей препарат Кокарнит, для пациентов с ДПН.
Методы
В исследование были включены 20 пациентов с СД2 (средний возраст – 62,35±7,9 года), в т.ч. 14 женщин (70%) в возрасте 63,2±8,1 и 6 мужчин (30%) в возрасте 60,1±7,9 года. Средняя длительность СД составила 11,9±4,7 года (15%<5 лет, 60% – 5–15 лет, 25%>15 лет).
Критерии включения в исследование: пациенты обоего пола в возрасте от 18 лет, страдавшие ДПН, подписавшие информированное согласие.
Критерии исключения: наличие противопоказаний в соответствии с инструкцией по применению Кокарнита; полинейропатия иного генеза; прием альфа-липоевой кислоты, витаминов группы В и Актовегина в течение месяца до включения в исследование.
Все пациенты проходили комплексное клиническое обследование, включившее общеклинический и биохимический анализы крови, общий анализ мочи, электрокардиографию, рентгенографическое исследование органов грудной клетки. Каждый пациент был консультирован неврологом и эндокринологом в 1-й (визит 1), 9-й (визит 2), 30-й (визит 3) и 90-й (визит 4) дни, каждому больному проведена электронейромиография (ЭМГ) на 1-й, 9-й и 90-й дни.
Исследование функционального состояния периферических нервов методом стимуляционной ЭМГ проведено на 4-м канальном приборе Viking Quest (Nicolet Biomedical, США). Проведена стимуляция двигательных нервов (n. рeroneus, или малоберцовый нерв, – поверхностный и глубокий, n. tibialis, или большеберцовый нерв) c регистрацией амплитуды двигательного М-ответа и скорости распространения возбуждения, дистальной и резидуальной латенции. Для оценки состояния сенсорных нервов (n. рeroneus – поверхностный и глубокий, n. suralis, или икроножный нерв) применяли антидромную стимуляцию с определением амплитуды сенсорного S-ответа и скорости распространения возбуждения. При анализе полученных результатов в качестве величин нормы использовали данные 20 здоровых пациентов [9, 10].
Эффективность применения препарата оценивалась в баллах с помощью шкалы общей оценки симптомов нейропатии – (Total Symptom Score; TSS), шкалы неврологических симптомов (Neurogical Symptoms Score; NSS) и шкалы нейропатического дисфункционального счета (Neuropathy Disability Score; NDS).
Осмотр неврологом включал исследование коленных и ахилловых рефлексов, тактильной, болевой, температурной и вибрационной чувствительности. Вибрационная чувствительность исследовалась с помощью градуированного камертона с частотой вибрации 128 Гц. Качество жизни пациентов оценивалось на первом и четвертом визитах с помощью шкалы оценки качества жизни (The Short Form 36; SF-36).
Каждый из пациентов получал Кокарнит 1 раз в сутки внутримышечно в дозе 2 мл на протяжении 9 суток ежедневно дополнительно к комплексной терапии. Комплексная терапия была представлена сахароснижающими, гипотензивными препаратами, а также антиагрегантами. Сахароснижающие препараты включали инсулины различного спектра действия, таблетированные средства (метформин, сульфанилмочевина, ингибиторы дипептидилпептидазы-4). Гипотензивные препараты были из различных групп (блокаторы кальциевых каналов, ингибиторы АПФ, бета-адреноблокаторы, сартаны, центрального действия, мочегонные). Антиагрегантная терапия в виде ацетилсалициловой кислоты.
В исследование не включались пациенты, получавшие терапию витаминами группы В, препаратами тиоктовой кислоты в течение 6 месяцев до старта исследовательской программы.
Статистическая обработка полученных результатов осуществлена с использованием программного обеспечения Excel Worksheet из пакета Microsoft Office 2013. Вычислены среднее арифметическое, стандартное отклонение и критерий достоверности (t). За достоверные принимались различия на уровне значимости 95% при р<0,05.
Результаты исследования
У всех обследованных нами пациентов, страдавших СД, была выявлена дистальная симметричная сенсомоторная полинейропатия, смешанный вариант (Классификация диабетичской нейропатии; Дедов И.И., 2002) разной степени выраженности, которая в 25% случаев сочеталась с радикулопатией, в 10% – с мононейропатией периферических нервов. Все пациенты испытывали нейропатическую боль разной степени выраженности, что подтверждалось данными шкал TSS, NSS и NDS. На фоне проведенной терапии отмечено достоверное уменьшение болевого синдрома, что отражено в табл. 1.
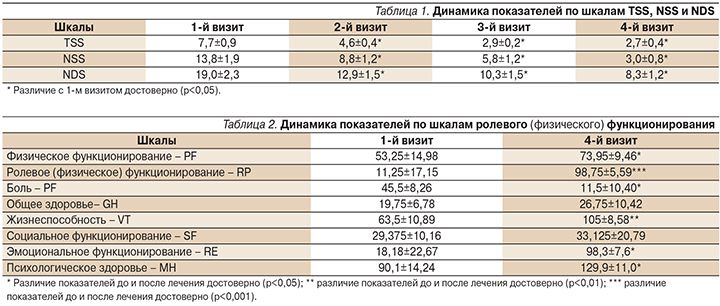
С помощью опросника SF-36 оценивали качество жизни, физическое, психологическое, социальное и психическое здоровье, интенсивность боли и жизненную активность. Тестирование проведено на 1-м и 4-м визитах. У всех пациентов установлено достоверное улучшение по шкалам, указанным в табл. 2. Наиболее выраженное улучшение наблюдалось по шкалам ролевого (физического) функционирования (табл. 2).
При проведении ЭМГ проявления дистальной сенсорно-моторной полинейропатии различной степени выраженности были выявлены у 100% пациентов. Характер изменений был аксонально-демиелинизирующим, наиболее пораженными оказались сенсорные волокна. Из сенсорных нервов самый пораженный – поверхностный n. рeroneus: зарегистрированы самая низкая скорость проведения импульсов и самая низкая амплитуда потенциала действия (табл. 3, 4). В 20% случаев потенциалы действия на малоберцовых нервах не регистрировались. По сравнению с контрольной группой у всех пациентов были достоверно снижены скоростные показатели и амплитуды в отношении сенсорных и моторных нервов.
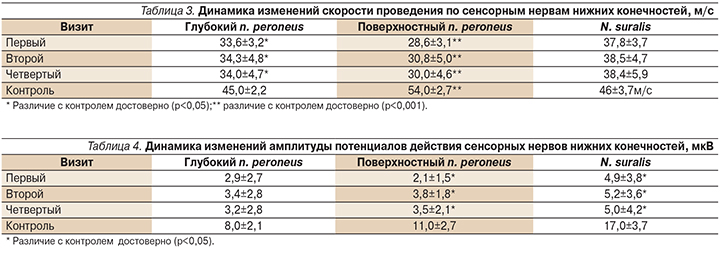
При исследовании моторных нервов аксональное поражение выявлено у 72% пациентов. Самые низкие показатели амплитуды М-ответа отмечены при исследовании поверхностного n. рeroneus, что отражено в табл. 5.
Данные о скорости проведения по моторным нервам представлены в табл. 6.
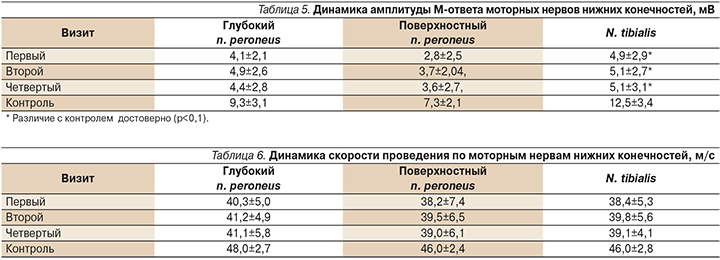
По данным ЭМГ, наиболее чувствительными к лечению оказались сенсорные нервы, в отношении которых в результате терапии отмечено более выраженное повышение показателей скорости проведения импульсов, хотя степени статистической значимости эти изменения не достигли. У 4 (20%) пациентов до лечения не регистрировались потенциалы действия на n. рeroneus, но после проведенной терапии они по малоберцовым нервам до лечения не регистрировались, после лечения они появились у 2 из этих больных.
Показатели функционального состояния n. рeroneus (сенсорных волокон) и n. suralis продемонстрировали наличие достоверной обратной связи между амплитудой потенциалов действия сенсорных нервов и длительностью СД. У пациентов с длительностью СД >20 лет отмечены наиболее низкие амплитуды потенциалов на n. suralis: 1,8±1,2 против 4,9±3,8 мкВ в общей группе.
Также установлена достоверная обратная связь между неконтролируемой гликемией и поражением сенсорных нервов нижних конечностей: 2,1±0,5 (у пациентов с неконтролируемой гликемией) против 4,9±3,8 мкВ в общей группе.
Обсуждение
Анализ полученных нами результатов обследования пациентов с ДПН свидетельствует о достоверном снижении у них скорости проведения и амплитуд импульсов по моторным и сенсорным нервам нижних конечностей по сравнению со здоровыми лицами. Сенсорные нарушения превалировали у наблюдавшихся нами больных над моторными расстройствами, что согласуется с результатами, полученными другими авторами [11].
Нервы были поражены по типу аксономиелинопатии с преобладанием поражения по типу миелинопатии. Наиболее низкие скорости проведения импульсов и самые низкие амплитуды выявлены в поверхностных n. рeroneus. Это указывает на целесообразность его включения в ЭМГ-обследование пациентов с СД2.
В результате применения Кокарнита в составе комплексной терапии удалось улучшить проведение по моторным и сенсорным нервам нижних конечностей, наиболее выраженные улучшения наблюдались в более пораженных сенсорных нервах. Выявлено достоверное повышение амплитуды потенциалов действия на поверхностном n. рeroneus, что указывает на влияние Кокарнита на аксональную функцию. Также было отмечено достоверное улучшение по показателям качества жизни и ощущению нейропатической боли самими пациентами по показателям шкал TSS, NSS и NDS. Все эти данные убедительно свидетельствуют о положительном влиянии Кокарнита на основные симптомы ДПН. Регресс неврологического дефицита в ходе лечения был подтвержден результатами ЭМГ. Полученные в настоящей работе данные совпадают с результатами проведенных ранее исследований.
Заключение
Кокарнит – эффективный препарат для лечения пациентов с диабетической дистальной сенсомоторной полинейропатией. Применение Кокарнита, содержащего витамины группы B, а также трифосаденин и никотинамид, представляется патогенетически обоснованным и эффективным в составе комплексного лечения пациентов с диабетической нейропатией.


