Введение
Эндотелиальная дисфункция (ЭД) – неотъемлемое звено патогенеза сердечно-сосудистых заболеваний [1–3]. При ЭД нарушаются механизмы регуляции сосудистого гомеостаза, что приводит к развитию вазоконстрикции, лейкоцитарной адгезии, активации тромбоцитов, окислительному стрессу, тромбозу, коагуляции и воспалению [1–3]. В норме эндотелий непрерывно высвобождает релаксирующие факторы, прежде всего оксид азота (NO), для поддержания сосудов в постоянном состоянии дилатации. При ЭД образуется дисбаланс между выработкой эндотелием вазодилатирующих и констриктивных стимулов в сторону увеличения последних, что приводит к повышению сосудистого тонуса, развитию внутрисосудистого воспаления, изменению структуры сосудистой стенки, ускорению атерогенеза [1–3].
На оценке способности эндотелия синтезировать вазодилатирующие субстанции (в первую очередь NO) в ответ на медикаментозные или физические раздражители основывается большинство методов определения ЭД, при этом наиболее широко используется окклюзионный тест или проба с реактивной гиперемией (РГ) [4]. Суть метода заключается в оценке изменения диаметра и скоростных характеристик кровотока в плечевой артерии в ответ на ее временную окклюзию пневматической манжетой. Реактивность плечевой артерии коррелирует с таковой сонных и коронарных артерий, что позволяет проецировать на них полученные результаты [4]. Проба с РГ – достаточно простой, неинвазивный и информативный метод диагностики ЭД.
В настоящее время много исследований посвящено влиянию на развитие ЭД ренин-ангиотензин-альдостероновой системы (РААС), результаты которых оказались настолько впечатляющими, что терапия блокаторами РААС стала основой вазопротекции. При этом ведущая роль отведена препаратам, блокирующим активность ангиотензина II, – ингибиторам ангиотензинпревращающего фермента (ИАПФ) и сартанам, в то время как блокада эффектов альдостерона рекомендована только при хронической сердечной недостаточности со сниженной фракцией выброса левого желудочка, в отдельных случаях – при ишемической болезни сердца [5]. В то же время в ряде исследований показано, что альдостерон играет важную роль в развитии и поддержании ЭД: в клетках эндотелия он активирует оксидативный стресс, снижает биодоступность NO, вызывает воспаление, способствует развитию фиброза, усиливает пролиферацию и миграцию клеток [6]. Мы предположили, что дополнительная блокада неблагоприятных эффектов альдостерона антагонистами минералокортикоидных рецепторов способна улучшить функцию эндотелия у больных сердечно-сосудостой патологией.
Цель исследования: оценить влияние комбинированной терапии валсартаном и спиронолактоном на функцию эндотелия у пациентов с артериальной гипертензией (АГ).
Методы
Обследованы 60 пациентов с АГ 2-й стадии. Методом случайной выборки пациенты разделены на 2 группы: 1-ю (n=30) и 2-ю (n=30); существенных различий между ними в распределении по полу, в средних значениях возраста, давности АГ, исходных уровней артериального давления (АД) не было. Первая группа (17 мужчин и 13 женщин, возраст – 57,8±9,1 года) в качестве антигипертензивной терапии получала валсартан (начальная доза – 160 мг, 2-я группа (14 мужчин и 16 женщин, возраст – 61,3±9,0 лет) получала валсартан в той же стартовой дозе в комбинации со спиронолактоном в дозе 25 мг/сут. При необходимости дополнительного снижения АД к терапии в обеих группах по усмотрению врача добавлялись гидрохлоротиазид (ГХТЗ) в дозе 12,5–25 мг и/или амлодипин в дозе 5–10 мг. Длительность наблюдения составила 12 месяцев.
Всем больным в начале и в конце исследования наряду со стандартным клинико-лабораторным и инструментальным обследованиями выполняли амбулаторное мониторирование АД (АМАД) прибором «Кардиотехника 07-АД-3/12Р» («ИНКАРТ», Санкт-Петербург, Россия) и пробу с РГ по стандартной методике [7]. Тест РГ проводили в утреннее время в положении лежа на спине в тихом помещении при температуре воздуха в кабинете 20–22°С. В течение суток перед проведением исследования исключали прием обильной пищи, курение, употребление кофе, тяжелые физические нагрузки. После 10-минутного отдыха проводили измерение диаметра плечевой артерии (ПА) и индекса резистивности (IR) методом ультразвуковой допплерографии на аппарате Samsung Medison Sono Ace X6, Корея, а также исходного АД. Изображение ПА анализировали в продольном сечении, на 5 см проксимальнее локтевой ямки. Через 5 минут осуществляли компрессию ПА: на плечо испытуемого накладывали манжету сфигмоманометра соответствующего размера, в которой создавали давление, превышавшее исходное систолическое АД на 50 мм рт.ст. с обязательным контролем окклюзии ПА ультразвуковой допплерографией. Длительность компрессии составляла 5 минут, после чего быстро выпускали из манжеты воздух. Через 15 и 90 секунд после декомпрессии проводили измерение диаметра ПА и IR. Результат теста оценивали по приросту диаметра ПА после окклюзии. Нормальной реакцией ПА считали увеличение ее диаметра более чем на 10%. Полученную информацию подвергали статистической обработке с помощью программы Statistica for Windows/version 10/StatSoft, Inc. (2011). Для сравнения данных групп использовали тест Манна–Уитни, для сравнения данных внутри групп – критерий Вилкоксона. Статистически значимыми считали различия на уровне р<0,05.
Результаты
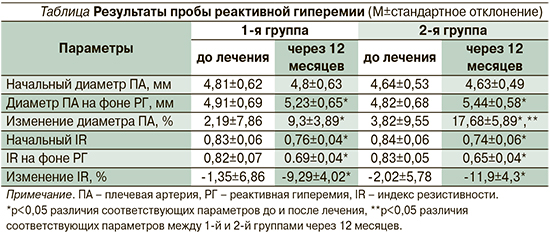
Исходные значения параметров АМАД, а также содержание калия и креатинина крови между группами существенно не различались. Исходно и в 1-й, и во 2-й группах наблюдалась сниженная реакция ПА на окклюзионную пробу. ЭД в виде отсутствия прироста диаметра ПА на 10% при проведении пробы с РГ и более была выявлена в 26 (86,7%) случаях в 1-й группе и в 23 (76,7%) – во 2-й. Кроме того, у части пациентов в обеих группах наблюдалась парадоксальная вазоспастическая реакция ПА на пробу с РГ: после прекращения окклюзии ПА регистрировалось уменьшение ее диаметра (вазоспазм) у 11 (36,7%) пациентов 1-й группы и 8 (26,7%) – 2-й. У 4 (13,3%) пациентов 1-й группы и 5 (16,7%) 2-й диаметр ПА в течение исследования не менялся. В среднем прирост диаметра ПА в 1-й и 2-й группах составлял 2,19±7,86 и 3,82±9,55% соответственно, аIR уменьшался на 1,35±6,86 и 2,02±5,78% соответственно.
Переносимость лечения всеми больными была удовлетворительной. В ходе терапии в обеих группах наблюдалось небольшое (статистически незначимое) увеличение уровней калия и креатинина сыворотки крови, степень выраженности этого повышения была сравнимой (р>0,05). На фоне лечения во 2-й группе ни у одного из мужчин не отмечено случаев развития гинекомастии.
На фоне лечения во всех случаях были достигнуты целевые уровни АД. По данным АМАД, систолическое и диастолическое АД к 12-му месяцу лечения в 1-й группе составило 126,9±5,4 и 77,6±4,8 мм рт.ст. соответственно, во 2-й – 121,9±7,4 и 73,9±6,3 мм рт.ст. соответственно. При этом как степень снижения АД, так и благоприятные эффекты лечения на вариабельность АД, утренний подъем АД и пульсовое АД во 2-й группе были более выраженными, чем в 1-й (все р<0,05). Использовавшаяся в процессе лечения доза валсартана была достоверно ниже во 2-й группе (196±69,9 мг/сут) по сравнению с 1-й (226,7±84,3 мг/сут), р<0,05. ГХТЗ применяли 30 (100%) больных 1-й группы и 25 (83,3%) 2-й (р<0,05); амлодипин – 13 (52%) в 1-й группе и 4 (13,3%) – во 2-й (р<0,05). Средние использовавшиеся дозы ГХТЗ и амлодипина существенно не различались.
Через 12 месяцев от начала исследования в обеих группах наблюдалось достоверное улучшение сосудистой реактивности (см. таблицу), более выраженное во 2-й группе. В 1-й группе при РГ наблюдалось увеличение диаметра ПА на 9,3±3,89%, во 2-й прирост диаметра ПА был достоверно выше, чем в 1-й группе, и составил 17,68±5,89% (р<0,05). Также в обеих группах достоверно снижался IR: на 9,29±4,02% в 1-й группе и на 11,9±4,3% во 2-й, статистически значимых различий в степени снижения IR между группами выявлено не было.
Обсуждение
В представленном исследовании отмечены более высокая гипотензивная эффективность и удовлетворительная переносимость, а также более выраженные вазопротекторные эффекты комбинированной терапии валсартаном и спиронолактоном по сравнению с изолированным валсартаном у больных с АГ. Место антагонистов минералокортикоидных рецепторов (АМР) при АГ до настоящего времени четко не определено. Представлены данные более высокой гипотензивной способности у неселективного представителя класса АМР – спиронолактона, по сравнению с селективным – эплереноном (при этом переносимость последнего оказывается лучше, но стоимость его применения существенно дороже) [8]. Одним из мотивов более широкого применения АМР при АГ ряд авторов считают достаточно высокую частоту субклинического гиперальдостеронизма, в т.ч. при эссенциальной АГ (особенно у лиц, резистентных к назначению трех классов гипотензивных средств) [9]. В подобных случаях (резистентная АГ) АМР сейчас рассматриваются как важный компонент комбинированной гипотензивной терапии (в отсутствие противопоказаний – значимого снижения функции почек и гиперкалиемии) [5]. В недавнем исследовании PATHWAY-2 показаны благоприятные эффекты комбинированной гипотензивной терапии с использованием АМР спиронолактона у лиц с АГ [10]. В то же время АМР не входят в число ведущих классов гипотензивных препаратов, поскольку не обладают данными «доказательной медицины» о благоприятном влиянии на сердечно-сосудистый прогноз; кроме того, имеются сомнения в отношении их безопасности, особенно при неизбежном частом сочетании с другими классами блокаторов РААС [5].
Данные настоящего сообщения об удовлетворительной переносимости невысоких доз спиронолактона подобны приводимым другими авторами. Так, в исследовании PATHWAY-2 [10] только у 2% пациентов, получавших спиронолактон в дозе 25–50 мг/сут, зарегистрирована гиперкалиемия выше 6,0 ммоль/л, но не выше 6,5, а частота значимых побочных эффектов спиронолактона не превышала таковую у препаратов сравнения. Случаев гинекомастии в данном исследовании выявлено не было, что авторы объясняют его короткой продолжительностью (3 месяца).
По данным других работ, при длительном использовании спиронолактона гинекомастия возникает примерно у 6% пациентов [11]. Отметим, что в исследовании PATHWAY-2 все больные получали спиронолактон в сочетании с сартаном или ИАПФ, что служит дополнительным аргументом в пользу безопасности этой комбинации.
Полученные нами данные о дополнительном позитивном влиянии спиронолактона на вазопротекторные эффекты сартана также находят параллели в результатах, приводимых другими исследователями [12]. Более выраженное позитивное действие комбинации валсартана с альдостероном на сосудистую реактивность по сравнению с приемом только валсартана, вероятно, связано с дополнительным уменьшением воспаления, окислительного стресса, фиброза и ремоделирования сосудистой стенки [13].
Выводы
У большинства пациентов с АГ выявлена ЭД в виде патологической реактивности ПА (недостаточной вазодилатации или парадоксальной вазоконстрикции) при проведении пробы с РГ.
Комбинированная терапия валсартаном и невысокими дозами спиронолактона при проспективном исследовании длительностью 12 месяцев продемонстрировала удовлетворительную переносимость: ни в одном из случаев не наблюдалось развития выраженной гиперкалиемии и гинекомастии; отмены лечения не потребовалось ни в одном из наблюдений.
Применение комбинированного лечения спиронолактоном с использованием валсартана обеспечивало достижение более значимого гипотензивного эффекта, что выражалось в более существенном снижении параметров АМАД: среднедневных и средненочных цифр систолического и диастолического АД, вариабельности систолического, диастолического и пульсового АД.
Использование валсартана и его комбинации со спиронолактоном ассоциировалось с улучшением функции эндотелия у пациентов с АГ: в обеих группах наблюдалось увеличение прироста диаметра ПА и дополнительное снижение IR в ответ на окклюзионную пробу. При этом более значимая вазодилатация ПА регистрировалась в группе спиронолактона.
Положительное влияние на суточный профиль АД и ЭД двойной блокады РААС в виде комбинированной терапии спиронолактоном и валсартаном в сочетании с хорошей переносимостью позволяют рассмотреть необходимость более широкого применения блокаторов минералокортикоидных рецепторов в качестве полноправных компонентов антигипертензивной терапии.



